细胞色素P450家族基因的检测方法及其在非酒精性脂肪性肝病中的作用研究进展*
2022-07-11张丹彤逯素梅马万山山东第一医科大学第一附属医院山东省千佛山医院检验医学科山东省医药卫生临床检验诊断学重点实验室济南250014
张丹彤,逯素梅,马万山(山东第一医科大学第一附属医院&山东省千佛山医院检验医学科,山东省医药卫生临床检验诊断学重点实验室,济南250014)
中国肥胖者的比例正在逐年上升,诱发的非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)也正在成为危害国人身体健康的重要慢性疾病。细胞色素P450(cytochrome P450,CYP450)家族是主要存在于肝脏、肠道中的单加氧酶,是自然界中发现的最大的以及功能最多样的超家族之一,负责包括环境污染物、药物、类固醇、脂肪酸等在内的很多内源性和外源性底物的代谢。CYP450在NAFLD及其相关疾病中的作用近年来被持续关注,值得进一步深入总结和探讨。
1 CYP450家族
CYP450有很多的亚型组成,人类约有57种CYP基因,被分成18个家族和43个亚家族。涉及药物和脂肪酸代谢的CYP450主要为CYP1、CYP2、CPY3家族,负责大约75%的临床药物的代谢。肝脏是CYP基因表达的主要器官,其他器官如脑、小肠、肾脏、肺等也是CYP基因表达的来源[1]。
2 CYP450家族的检测方法
据研究,患有NAFLD的个体对药物性肝损伤的易感性更高,原因之一在于部分CYP450成员的活性受到抑制。因此,为尽量减轻肝脏损伤,在对患者用药前可提前检测NAFLD患者体内CYP450活性,针对表达异常者推荐合适药物剂量并密切关注肝功能水平。根据CYP450的特点,可以在DNA、RNA、蛋白质以及酶活性等角度对其进行检测分析。CYP450最早的检测方法为紫外分光光度法。随着检测技术的进步,CYP450检测方法越来越多,也被逐渐应用至科室检测,除高效液相色谱法(high performance liquid chromatography,HPLC)、发光法、ELISA、实时荧光定量PCR对总CYP450以及各亚型检测外,根据实际临床检测需求也开展了CYP450基因的多态性检测。不同个体药物治疗效果不同,部分原因在于其体内存在CYP450基因多态性。CYP450的基因多态性检测对指导临床用药安全十分重要,例如CYP2C19*2和CYP2C19*3的多态性会引起基因编码的酶活性丧失,会影响奥美拉唑、苯妥英钠等药物的代谢,在常规临床剂量用药时会引起患者体内药物的蓄积,使得药物副作用增强。CYP2C19*17则使底物代谢能力增强,因此需增加用药量。现常用的多态性检测方法主要有Sanger测序法、PCR-荧光探针法、CYP450检测芯片。Sanger测序法被认为是基因检测的“金标准”。经过此方法验证出的CYP多态性序列,可以作为室间质控品帮助实验室提高检测质量。但在实际室间质控中使用Sanger测序进行临床标本分析的实验室却未能做到100%的准确度,这可能与实验人员操作不规范、结果判读发生错误有关。PCR-荧光探针法却在室间质控中表现出100%的特异性与敏感性,室间质控结果显示出与测序验证的CYP450基因的野生型、纯合以及杂合突变型结果一致,该方法在临床检测中能达到比Sanger测序更高的准确度的原因或许在于此方法与Sanger测序相比操作较便捷,结果判读较简单[2-3]。美国食品药品监督管理局(Food and Drug Administration, FDA)审批通过的可以用于临床诊断的罗氏Amplichip CYP450微阵列包含超过15 000个核苷酸探针,共可分析31个单核苷酸多态性(single nucleotide polymorphism, SNP)。检测首先对预先选定的DNA片段进行PCR扩增,再将片段标记的DNA用于微阵列进行杂交以及染色,激光扫描荧光杂交强度模式,软件分析基因型和表型,此方法可一次性对多种SNP进行检测,较为便捷[4]。以上检测方法的差异见表1。

表1 CYP450检测方法学的比较
3 CYP450与肥胖、NAFLD关系的研究进展
在肥胖患者的体内可以观察到CYP家族基因表达的变化。肥胖患者随其体质指数的增加,CYP3A发生降低,而CYP2E1水平发生升高[5-6]。儿童肥胖患者以及2型糖尿病患者的CYP1B1基因表达水平均显著升高,并且多因素分析显示CYP1B1对肥胖有很高的诊断潜力[7-8]。与健康人群相比, NAFLD患者中CYP450的表达也发生明显改变,如表2所示,在NALFD的进展期肝脏CYP2C19、CYP3A4的表达和活性随着NALFD的进展而降低[9]。但在NAFLD的发生发展过程中,部分CYP450的活性变化不是一成不变的;例如仅在肝脏中存在的CYP1A2,其活性在NAFLD中呈现先升高后下降的趋势,但由于观察时间的原因,升高的过程常被忽略。由此可见CYP450家族的检测或许可以成为一种筛查肥胖与NAFLD的潜在临床指标。
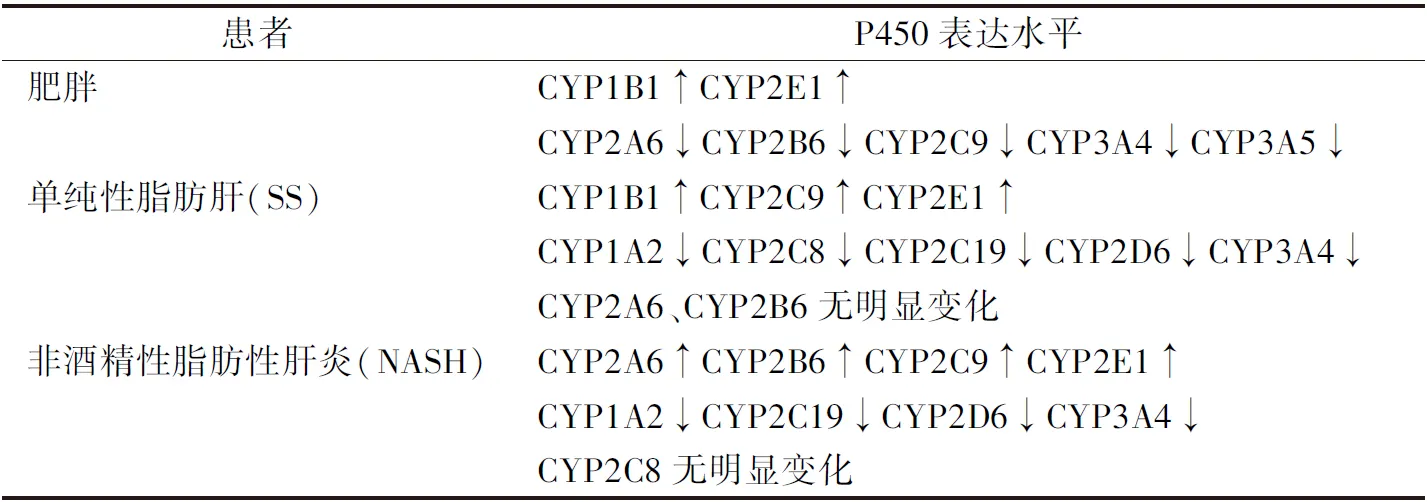
表2 肥胖及非酒精性脂肪性肝病患者P450表达变化
3.1CYP1家族 CYP1家族包括CYP1A和CYP1B两个亚家族。CYP1A1是CYP1A亚家族的功能性基因。CYP1B1也被证明在调节脂肪酸、类固醇激素的代谢有重要作用。
3.1.1CYP1A1 NAFLD的形成及进展与氧化应激、脂质过氧化密切相关,阻断CYP1A1可以通过抑制活性氧(reactive oxygen species, ROS)水平以及升高抗氧化剂超氧化物歧化酶(superoxide dismutase,SOD)水平来抑制肝脏的氧化应激和脂质过氧化,致使丙二醛(malondialdehyde,MDA)、4-羟基壬烯醛(4-hydroxynonenal,HNE)的沉积减少;MDA有促进载脂蛋白B100降解、降低低密度脂蛋白胆固醇分泌的功能,会导致肝脏脂质输出减少,肝脏脂肪堆积加剧。MDA也是一种重要的炎症介质,可以诱导炎症细胞的聚集和浸润,诱发炎症反应,可导致肝进一步损伤[10]。因此,对CYP1A1进行干扰会在一定程度改善肝脏脂肪的堆积以及肝脏炎症反应。
此外,CYP1A1还是一种雌激素代谢酶。绝经前女性免受肥胖相关的肝脏代谢并发症的影响,这种保护机制与雌激素限制肝脏脂肪积累的能力有关。文献表明,雌激素对肝脏脂肪变的发展具有明显的保护作用,雌激素缺乏是导致肥胖以及NAFLD的主要原因之一[11],CYP1A1活性的增高会导致雌激素缺乏。苯并芘(benzoapyrene,Bap)暴露会大大增加NAFLD的患病风险[12],其机制之一在于BaP激活芳香烃受体(aryl hydrocarbon receptor,AHR)通路后激活了CYP1A1的基因转录,导致雌激素代谢酶CYP1A1的过表达,使雌激素出现缺乏,抑制雌激素对肝脏的保护作用,导致肝脏中脂肪的积累增多[11];α-萘黄酮是一种有效的AHR的抑制剂,其发挥作用的部分机制是通过抑制AHR-CYP1A1通路达到缓解NAFLD的目的[13]。
3.1.2CYP1B1 CYP1B1活性改变使很多肝脏基因的表达受到影响,其中包括与肝脏脂肪合成与转运堆积密切相关的多种因子[8]。干扰CYP1B1可以减轻肥胖、改善葡萄糖耐量和胰岛素敏感性、改善肝脏中的脂代谢、抑制肝脏的增大[14],其缓解NAFLD的作用机制部分在于CYP1B1干扰使得硬脂酰辅酶A去饱和酶-1(stearyl coenzyme A dehydrogenase-1,SCD-1)、脂肪酸转运蛋白CD36、乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)、脂肪酸合酶(fatty acid synthase,FAS)、二酰基甘油酰基转移酶1(diacylglycerol acyltransferase,DGAT1)表达出现下调,棕榈酰转移酶1A(recombinant carnitine palmitoyltransferase 1A,CPT-1a)以及腺苷酸激活蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)的表达上调。这些因子在体内脂肪酸代谢中发挥重要作用。SCD-1是控制肝脏新生脂肪生成的末端酶。FAS催化生成长链脂肪酸,其活性的增加会导致游离脂肪酸的增加,长期使用FAS抑制剂可降低脂肪生成以及NAFLD的形成[15-16]。CD36分子参与肝脏脂肪酸的跨膜转运,CD36的抑制会降低肝脏对脂肪酸的吸收[17]。AMPK在全身能量平衡中发挥重要作用,AMPK激活会增加脂肪酸的氧化,降低mTOR的磷酸化水平,增强肝脏自噬,抑制脂肪酸的合成,减轻肝脏脂肪变性[18]。另外,CYP1B1特异性抑制剂还可用于治疗由于脂代谢紊乱致使的高胆固醇血症引起的动脉粥样硬化、高血压,以及由于CYP1B1过表达引起的机体对部分抗癌药物的耐药性[19]。CYP1B1抑制剂的发现和使用可以为预防或者治疗肥胖、脂肪肝提供新途径。目前有50多个天然或合成化合物为CYP1B1的抑制剂,包含反式二苯乙烯、香豆素、生物碱、蒽醌和其他几种化合物,其中二苯乙烯类的化合物是CYP1B1的高效特异性抑制剂。
3.2CYP2家族 CYP2家族是P450系统中最大的家族,CYP2家族有5个亚家族,其中研究比较多的亚型是CYP2C9、CYP2C19、CYP2E1。其家族成员在类固醇激素、前列腺素和脂肪酸的代谢过程中发挥着重要作用。
CYP2E1在所有哺乳动物的肝组织以及肝外组织中均有表达,参与脂肪酸、甘油、临床药物、有毒化学品的生物转化。CYP2E1的活性在肥胖、NAFLD患者中均显著增加。CYP2E1活性的异常上调使胰岛素受体底物1和2的磷酸化水平降低,胰岛素信号敏感性减弱,促进胰岛素抵抗(insulin resistance,IR)的发生,IR又会促进肝脏的脂质堆积,另外IR导致患者体内酮体增多,酮体会维持CYP2E1的稳定,最后使得CYP2E1的降解减少,在体内活性增加,进一步加剧IR,形成恶性循环,而在NAFLD发生发展的第一击中发挥作用[20]。此外,CYP2E1还具有较高的氧化酶活性,是体内重要的氧化自由基的诱导剂,其表达的增加会使ROS的产生增多,导致氧化应激,在NAFLD形成发展的“第二击”中发挥作用。ROS引起肝星状细胞以及kupffer细胞的激活,引起细胞炎性因子的释放,导致细胞膜的脂质以及蛋白质发生过氧化。生成的过氧化脂质破坏肝脏细胞的结构,致使细胞功能失调、肝脏损害,同时也会通过活化IκB激酶β途径引起NAFLD的发生[21]。此外,由ROS引起的铁死亡,会进一步加剧肝脏免疫细胞和炎症浸润[22],促使非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)的发生。
黄酮类化合物具有保肝作用,并可通过调节CYP2E1的活性对NAFLD起到有益的作用。此外,CYP2E1的表达抑制在临床中介导改善NASH肝脏炎症的有效治疗方法nanoSOD的肝保护作用中发挥部分作用[23]。总之,CYP2E1已被证明是NAFLD发生发展中的一个十分关键的因素,有望成为一个重要的早期治疗靶点。
3.3CYP3家族 CYP3家族只包含CYP3A一个亚家族。CYP3A在肝脏CYPs中含量丰富,约占30%,参与大约30%的临床药物代谢。
研究发现肝脏CYP3A的缺失会导致或加重脂肪肝。在NAFLD患者中CYP3A表达抑制与孕烷X受体(pregnane X receptor, PXR)有关。PXR是包括CYP3A在内的多种CYPs的关键调节因子。据报道,在患有NAFLD人体内一种主要由肝脏分泌的激素成纤维细胞生长因子21表达升高,导致肝脏受体丝裂原活化蛋白激酶信号的激活,进一步影响PXR或辅助伴侣蛋白的磷酸化,使PXR的激活抑制,PXR在核内的移位减少,从而减少CYP3A基因的转录与表达[24]。另外一种机制是在NASH患者体内常有的炎性浸润会导致NF-κB被激活,活化的NF-κB会促使IL-6、TNF-α等炎症因子的大量产生,同时炎症浸润会进一步激活NF-κB,致PXR受到抑制,使CYP3A表达减少[25],进一步促使NAFLD的发展。
4 结语与展望
NAFLD是全球公认的发病机制复杂的慢性肝病,没有药物可以根治,临床对于大多数患者的建议是通过减肥对脂肪肝进行控制。但实际只有一小部分的患者可以减肥成功而达到控制脂肪肝的目的。因此,寻找安全有效的方法治疗脂肪肝意义重大。CYP450家族与NAFLD的发生与发展密不可分,可为临床治疗提供新思路。并且在NAFLD发病率逐年增高且有年轻化趋势的环境下,或许可以首先通过检测CYP450水平对人群进行初步筛查。
