巨噬细胞胞外诱捕网在类风湿关节炎患者滑膜中的表达及其临床意义*
2022-07-11黄赛赛孙玥陈子嫣梁军赵成南京大学医学院附属鼓楼医院风湿免疫科南京210008
黄赛赛,孙玥,陈子嫣,梁军,赵成(南京大学医学院附属鼓楼医院风湿免疫科,南京 210008)
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的慢性炎症性自身免疫性疾病[1],其确切的发病机制尚未完全阐明。胞外诱捕网(extracellular traps, ETs)是由双链DNA、蛋白酶、组蛋白和抗菌肽等结构组成的网状结构。最早于2004年在中性粒细胞中发现并命名为中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs),活化的中性粒细胞可以通过形成NETs捕获并杀灭病原菌,这种死亡方式称为NETosis[2]。最近研究表明,除中性粒细胞,其他免疫细胞如巨噬细胞、肥大细胞等也可形成胞外诱捕网[3]。巨噬细胞胞外诱捕网(macrophageextracellular traps,METs)的组分包括瓜氨酸化组蛋白H3(citrullinated histone H3,CH3)、髓过氧化物酶等[4]。METs的形成与活性氧及肽酰基精氨酸脱亚胺酶4(peptidylarginine deiminase 4,PAD4)等相关,在感染、急性肾损伤等疾病中发挥重要作用[5-6]。滑膜是RA常累及的部位之一,RA滑膜中含有丰富的巨噬细胞,RA滑膜巨噬细胞是否存在METs及其可能发挥的作用目前仍未可知。本研究通过检测RA患者滑膜中巨噬细胞的极化和METs形成情况,探讨RA中是否存在METs的表达异常,为后续研究METs在RA发病和治疗中的作用提供基础。
1 材料与方法
1.1研究对象 选取2020年11月至2021年5月就诊于南京大学医学院附属鼓楼医院的5例RA患者,RA诊断均符合2010年美国风湿病学会(American College of Rheumatology,ACR)制定的RA分类诊断标准[7],排除急性感染、肿瘤和其他确定的自身免疫病。5例RA组患者中包括4例女性和1例男性,年龄(56.0±5.7)岁,病程(13.0±3.8)年,28个关节的疾病活动度评分DAS28(4.0±0.3)分。同时选取5例创伤患者作为对照组,包括4例女性和1例男性,年龄(55.0±6.4)岁。两组间性别和年龄差异无统计学意义(P>0.05)。取所有研究对象膝关节新鲜滑膜组织。本研究经医院医学伦理委员会批准(批准文件号2021-544-01),患者均知情同意。
1.2主要试剂及仪器 苏木精-伊红(HE)染液(南京建成公司),胎牛血清、牛血清蛋白(BSA)、0.25%胰蛋白酶和Ⅱ型胶原酶(美国Gibco公司),Triton-100、DAPI(上海碧云天生物公司),多聚甲醛(武汉谷歌公司),兔抗人F4/80、兔抗人CD86、兔抗人CD206、兔抗人H2A抗体(美国eBioscience公司),RIPA蛋白裂解液(美国CST公司),磷酸酶抑制剂(中国凯基公司),苯甲基磺酰氟(PMSF,美国Sigma公司),PAD4抗体、CH3抗体、GAPDH抗体(美国Proteintech公司),辣根过氧化物酶标记的羊抗兔二抗、Alexa Flour 488、Alexa Flour 555标记的羊抗兔二抗(美国ImmunoWay公司)。FSX100生物导航仪(日本Olympus公司),Western Blot凝胶成像仪(英国Syngene公司),SDS-PAGE电泳仪和转膜仪(美国Bio-Rad公司),TCS SP8激光共聚焦显微镜(德国Leica公司)。
1.3人滑膜细胞分离 将1 cm2组织块放入平皿中,漂洗后用剪刀将组织剪至1 mm2匀浆状并置于离心管中,加入Ⅱ型胶原酶和等体积的0.25%胰蛋白酶37 ℃消化60 min,加入含10%胎牛血清的培养液终止消化后过滤收集细胞悬液,1 300 r/min离心5 min除去细胞碎片。
1.4HE染色 收集滑膜组织,用4%的多聚甲醛固定,经过脱水透明、浸蜡包埋、切片和贴片、脱蜡和水化制备常规切片,将制作好的切片置于苏木紫溶液中染色10 min,用蒸馏水洗掉多余的液体,用1%盐酸酒精处理数秒钟,使细胞核呈现出蓝紫色后用蒸馏水充分洗涤,再用1%氨水处理数秒钟,至切片返蓝后再用蒸馏水充分洗涤;用1%伊红继续染色3 min,染色后的切片再次进行脱水和透明操作后即可封片;显微镜下观察标本并摄片保存。
1.5免疫荧光染色 石蜡切片脱蜡,4%多聚甲醛固定30 min,PBS清洗3次,1% Triton-100破膜20 min,滴加含3%BSA和含10%正常山羊血清的PBS各250 μL,湿盒内4 ℃反应1 h;轻轻倒去反应液,然后分别滴加一抗,如兔抗人F4/80、兔抗人CD86、兔抗人CD206、兔抗人H2A抗体(1∶150稀释),以PBS代替一抗作阴性对照,4 ℃湿盒反应过夜;PBS清洗3次,滴加Alexa Flour 488、Alexa Flour 555标记的羊抗兔IgG二抗(1∶200稀释)及DAPI,4 ℃湿盒避光反应1 h;PBS冲洗3次,抗荧光猝灭剂封片,激光共聚焦显微镜观察和拍照。运用免疫荧光法分别检测连续切片中F4/80、CD86、CD206、H2A的表达水平。当一抗为兔抗人F4/80、二抗为Alexa Flour 488标记羊抗兔IgG时,F4/80染色阳性(绿色)代表巨噬细胞浸润。当一抗为兔抗人CD86、二抗为Alexa Flour 488标记羊抗兔IgG,一抗为兔抗人F4/80、二抗为Alexa Flour 555标记羊抗兔IgG时,F4/80阳性(红色)巨噬细胞中CD86阳性(绿色)细胞即M1型巨噬细胞。当一抗为兔抗人CD206、二抗为Alexa Flour 488标记羊抗兔IgG,一抗为兔抗人F4/80、二抗为Alexa Flour 555标记羊抗兔IgG时,F4/80阳性(红色)巨噬细胞中CD206阳性(绿色)细胞即M2型巨噬细胞。当一抗为兔抗人H2A、二抗为Alexa Flour 555标记羊抗兔IgG,一抗为兔抗人F4/80、二抗为Alexa Flour 488标记羊抗兔IgG时,F4/80阳性巨噬细胞(绿色)中H2A染色阳性(红色)表明METs形成。采用Image J软件对阳性细胞的数目以及共定位的阳性细胞进行数量化和统计。对双染细胞的共定位进行皮尔斯相关系数的分析(1表示完全相关,0表示随机分布,-1表示完全排除)。
1.6蛋白免疫印迹法 收集制备好的滑膜组织悬液,加入适量蛋白裂解液(RIPA蛋白裂解液1 mL+磷酸酶/蛋白酶抑制剂10 μL+PMSF 10 μL),置于冰上,于摇床上裂解30 min,确保细胞充分裂解;12 000×g离心20 min,取上清液,用BCA法测蛋白质浓度。根据所测样本蛋白质浓度,用蛋白裂解液将各样本浓度调为相同,加入1/4体积的5×loading buffer,100 ℃加热样本10 min使蛋白质变性。向聚丙烯酰胺凝胶中每孔加入20~30 μg蛋白质样品,经过电泳、转膜等步骤将蛋白质转至PVDF膜上,洗涤后加入封闭液室温封闭1 h,洗膜后分别与相应的一抗PAD4抗体、CH3抗体(1∶1 000稀释),4 ℃反应过夜。TBST洗膜3~4次,辣根过氧化物酶标记的羊抗兔二抗室温反应1 h后再用TBST洗膜3~4次,加入显影液,曝光拍照。以GAPDH作为内参蛋白,分别检测PAD4抗体、CH3的表达。采用Image J软件对获取的蛋白质条带图像进行吸光度测定,以目的蛋白质与GAPDH内参蛋白吸光度值比值作为目的蛋白质的相对表达水平。
1.7统计学分析 用SPSS 17.0软件进行。连续变量数据符合正态性分布,以均数±标准差表示,两组间数据比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1RA患者滑膜巨噬细胞明显增多 与对照组相比,RA组滑膜细胞仅少量形态正常,可见大量淋巴细胞、中性粒细胞等炎症细胞浸润,见图1A。激光共聚焦显微镜下观察结果示RA组滑膜组织中巨噬细胞浸润明显增多,其中DAPI染色阳性(蓝色)代表细胞核,F4/80染色阳性(绿色)代表巨噬细胞浸润(图1B)。RA组的巨噬细胞数(98±7.09)显著高于对照组(10±1.15),差异有统计学意义(t=12.24,P<0.001)。

注:A,正常滑膜与滑膜炎组织的HE染色结果(20×,标尺为100 μm);B,巨噬细胞在正常滑膜与滑膜炎组织中的免疫荧光表达的代表性图片(n=5),蓝色是细胞核(DAPI),绿色是F4/80,标尺为100 μm。
2.2RA患者滑膜巨噬细胞向M1极化增多 结果显示RA患者滑膜中M1型巨噬细胞的共定位系数较正常对照组显著增多(0.78±0.022 vs 0.13±0.011,t=26.16,P<0.001),两组间M2型巨噬细胞差异无统计学意义(0.23±0.019 vs 0.18±0.012,t=1.81,P>0.05)。见图2。
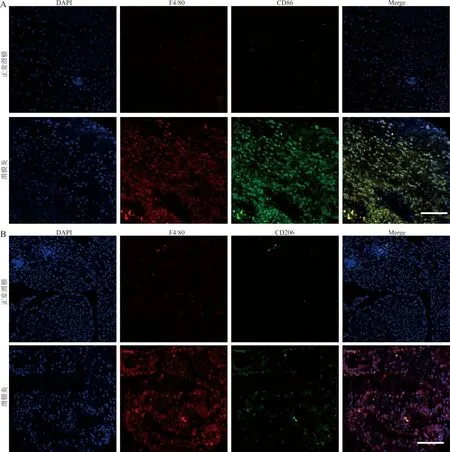
注:A,巨噬细胞在正常滑膜与滑膜炎组织中M1极化的免疫荧光表达的代表性图片(n=5),蓝色是细胞核(DAPI),绿色是CD86,红色是F4/80,标尺为100 μm;B,巨噬细胞在正常滑膜与滑膜炎组织中M2极化的免疫荧光表达的代表性图片(n=5),蓝色是细胞核(DAPI),绿色是CD206,红色是F4/80,标尺为100 μm。
2.3RA患者滑膜巨噬细胞METs形成显著增多 激光共聚焦显微镜观察可见,RA组滑膜组织中部分巨噬细胞发生染色质解聚,导致DNA释放到胞外,其中H2A染色阳性(红色)表明METs形成,蓝色是细胞核(DAPI),绿色为F4/80。RA组F4/80阳性H2A阳性细胞共定位系数(0.65±0.023)显著高于对照组(0.18±0.012)(t=19.8,P<0.001)。见图3。
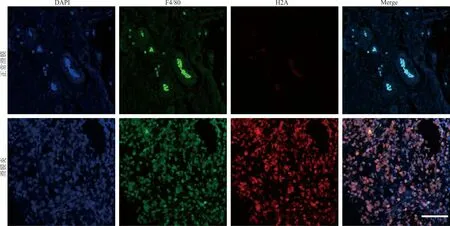
注:巨噬细胞诱捕网在正常滑膜与滑膜炎组织中免疫荧光表达的代表性图片(n=5),蓝色是细胞核(DAPI),红色是H2A,绿色的是F4/80,标尺为100 μm。
2.4RA患者滑膜组织中PAD4和CH3表达明显增多 利用蛋白免疫印迹法检测参与调节METs形成的PAD4和METs主要成分CH3的表达。与对照组相比,RA滑膜组织中PAD4和CH3表达水平均明显升高(0.82±0.018 vs 0.20±0.015,t=26.43,P<0.001;0.83±0.013 vs 0.40±0.012,t=24.91,P<0.001)。见图4。
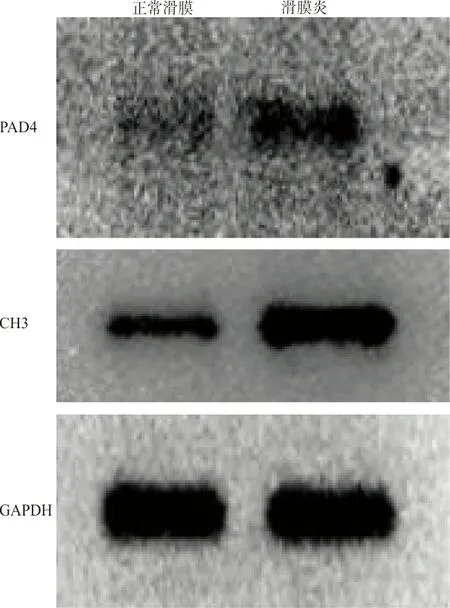
图4 WB检测PAD4与CH3在正常滑膜与滑膜炎组织中蛋白质表达量变化
3 讨论
RA是以慢性滑膜增生和进行性关节破坏为特征的全身性自身免疫病,早期的诊断和治疗对RA患者意义重大,寻找RA的新发病机制,将为RA的治疗提供新的思路和方向[8]。巨噬细胞是机体固有免疫中的重要组成部分,METs作为一种新型的巨噬细胞形态也越来越受到大家的重视。METs的组成成分及结构与NETs类似,能够固定和杀死部分病原微生物,参与多种自身免疫病及炎性疾病的病理过程[9]。巨噬细胞作为滑膜的重要组成成分之一,滑膜METs在RA中的表达及其与RA发病的关系目前尚未可知。
本研究收集RA及创伤患者的滑膜组织,检测其中巨噬细胞数量、巨噬细胞极化和METs的水平,结果显示RA患者滑膜巨噬细胞明显增多,且以促炎的M1型巨噬细胞为主。PAD是催化精氨酸转化为瓜氨酸的关键酶,而瓜氨酸化抗原可能是RA发病的始作俑者。研究发现PAD4参与METs的形成,Mohanan等[10]发现PAD4能通过组蛋白脱亚胺作用参与肿瘤坏死因子α(tumor necrosis factor,TNF-α)介导的小鼠巨噬细胞METs形成过程。本研究通过免疫荧光和蛋白质免疫印迹法证明RA患者滑膜METs形成显著升高,PAD4和CH3较对照组明显增多。导致METs增多的因素很多,研究发现次氯酸(hypochlorous acid,HOCL)、活性氧、干扰素γ(interferon gamma,IFN-γ)、TNF以及微生物如白念珠菌、马氏分枝杆菌、金黄色葡萄球菌等均可刺激巨噬细胞形成METs[11]。Zhang等[12]发现巨噬细胞可以先向M1型极化,然后在炎性物质的刺激性下形成METs。不同表型的巨噬细胞形成METs的能力有差异,Rayner等[13]发现M1型巨噬细胞较M2型巨噬细胞更易形成METs。感染是RA发病的诱因之一,RA滑膜中存在多种慢性炎症细胞浸润,体内TNF-α、白介素17(interleukin 17,IL-17)、IL-22等炎症因子明显升高[14],巨噬细胞和成纤维样滑膜细胞(fibroblast-like synoviocytes,FLSs)是RA滑膜中最丰富的细胞类型,滑膜巨噬细胞产生的TNF-α和IL-1β等细胞因子可激活FLSs,活化的FLSs明显增加巨噬细胞集落刺激因子及其他炎症因子的产生,促成巨噬细胞极化和激活[15],导致METs形成增多,滑膜巨噬细胞和FLSs的相互作用促进和放大这两种细胞的致炎效应,导致软骨降解和骨质破坏,在RA发病机制中发挥核心作用。
不同组织来源的巨噬细胞形成METs的能力也不同,如他汀类降胆固醇药物可增强RAW 264.7巨噬细胞系或小鼠腹腔巨噬细胞METs的形成,但人单核细胞来源的巨噬细胞尚未发现类似的功能[16]。由于滑膜是RA患者重点累及器官,本研究侧重于RA滑膜METs的形成,后续也将进一步探讨其他组织如外周血中METs的形成及作用。
本研究也存在一些局限性。受取材的限制,入组的患者数量较少,仍需要更大样本量进行研究。另外滑膜METs怎样参与RA发病,其具体机制还需要进一步通过体外实验和动物实验探索和发现。
