植物氮素吸收、转运和同化的分子机制
2022-06-23段永康杨海燕吴文龙李维林
段永康,杨海燕 ,吴文龙,李维林
(1.南京林业大学林学院/南方现代林业协同创新中心,江苏 南京 210037;2.江苏省中国科学院植物研究所,江苏 南京 210014)
0 引言
氮素是植物生长和粮食高产的重要限制因子,它不仅参与许多生命物质如核酸、酶、氨基酸和蛋白质等组成,而且直接由氮素构成的叶绿素对植物光合作用碳同化起着关键作用,素有“生命元素”之称[1]。氮素的吸收利用程度与植物生长发育状况以及能否达到优质丰产都有着密不可分的联系,与此同时,植物的各个代谢过程都离不开氮素的调节[2]。有研究表明,多数植物一生中对氮素的吸收量要远大于P、K 等各种元素[3],因此为实现农作物丰产,在实践操作中人们常常施用大量的氮肥。据国家统计局数据显示,2019 年我国农业氮肥(纯氮)用量为1 930万t,预计2022 年春耕期间需氮量将突破944 万t[4]。现阶段,我国氮肥消耗量已超过全球总氮肥量的三分之一[5],氮肥平均利用率仅为30%。氮肥的过量施用是影响氮肥利用率的因素之一,这样不仅无法给农业生产带来高经济效益,而且还会加剧生态环境恶化和环境污染。因此,降低氮肥用量,提高植物氮素利用效率(nitrogen use efficiency,NUE),是实现环境友好、绿色高效可持续性农业生产的核心要义。
植物对氮素的利用首先是植物根系从土壤中吸收各种形态氮素,其次在体内进行转化运输,最后在各种酶的作用下进行同化[6]。植物利用土壤中的氮素主要是有机态氮和无机态氮两种,作为植物主要吸收形式的无机态氮又包括硝态氮(NO3-)和铵态氮(NH4+)[7]。植物在长期演替过程中逐渐形成了高效利用氮素的调控机制[8],其中miRNAs 在植物响应氮素方面发挥着重要作用。目前,对氮素形态的研究大多集中在硝态氮和铵态氮转运蛋白的功能和氮素在植物体内还原同化相关基因表达上,在转录因子和miRNA 方面报道较少。了解植物对不同氮素吸收转运以及同化的分子机制对于农林业生产具有重要指导意义。本文综述了植物对不同氮素形态吸收利用的生理和分子机制,并阐述了转录因子和miRNA 参与氮素响应的作用机理,从分子水平上阐明植物如何高效吸收利用氮素,并对未来研究方向进行了展望。
1 植物的氮素代谢
N2约占空气的79%,是很好的氮素来源,但无法被植物直接利用。豆科植物凭借体内存在的固氮微生物,能够很好地将空气中单质氮转化为生长所需要的氮肥。然而绝大部分植物只能吸收利用土壤中部分可溶性氮,主要以无机态氮的形式。一般农用地中NH4+浓度低于0.1 mmol·L-1,而NO3-浓度在为0.5~1.0 mmol·L-1[9]。土壤中NO3-的含量通常要高于NH4+,但是在淹水、冻害和酸性环境中时NH4+占多数[10]。不同植物对铵盐和硝酸盐的偏好程度不一致,例如偏好铵盐的植物有水稻、马铃薯、蓝莓和茶树等,而烟草、拟南芥、番茄和小麦等则被认为偏好硝酸盐。对于哪种无机态氮素更有利于植物生长一直无法达成统一意见,有些研究学者认为植物吸收NO3-和NH4+差异并不明显[11],有些则指出大部分植物在早期幼年时期更偏好NH4+[12],有研究表明植物吸收NH4+的速率远大于NO3-[13]。相关研究人员在进行电化学试验时发现,NH4+是植物根系从土壤中选择吸收的主要类型[14]。
1.1 植物对NO3--N 的吸收转运及分子调控机制
植物根系从土壤中吸收的NO3-通常会被还原成NH4+,只有这样植物才能利用。同时小部分NO3-可以通过木质部导管主动运输到植物地上部分,剩余部分则被储存在液泡中来调节细胞渗透势[15]。将NO3-还原成NH4+的整个化学反应过程不仅能在根中进行,还能在茎和叶中发生,但以叶片为主。首先硝酸盐转运蛋白(NRT)将NO3-转运进入细胞,随后利用供氢体(NADH)提供还原力,最终被硝酸还原酶(NR,nitrate reductase)还原,整个反应为:
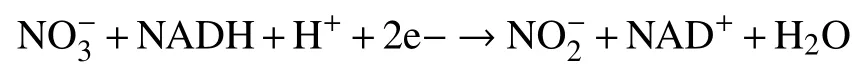
在叶绿体或根中,通过铁氧还蛋白(Fd)提供还原力,亚硝酸还原酶(NIR,nitrite reductase)将NO2-还原为NH4+,NH4+转化成NH3后再参与后续的同化过程[16]。其酶促反应过程如下:

试验证明,NR 是植物氮代谢过程中的限速酶,它不仅能直接影响植物氮代谢过程,而且对植物的光合碳代谢过程也有一定的调控功能[17]。环境中光照的强弱、温度的高低以及氮源的浓度均会影响NO3-的还原,当土壤中存在大量NO3-时,会导致植物根系吸收的NO3-不能及时被还原,从而对植株产生毒害作用[18]。
硝酸盐是植物形态建成中必不可少的营养物质,同时自身具备信号调控的功能。在植物体内存在吸收硝酸盐不同功能的基因,这些基因受环境条件的不同存在空间表达上的差异。植物对NO3-的吸收转运包括硝酸盐转运蛋白1(nitrate transport 1,NRT1)/肽转运蛋白(peptide transporter,PTR)家族、硝酸盐转运蛋白2(nitrate transport 2,NRT2)/硝酸盐-亚硝酸盐转运体(nitrate-nitrate porter,NNP)家族、氯离子通道(Chloride channel,CLC)家族和慢阴离子通道相关同系物(Slow anion associated channel homolog,SLAC/SLAH)家族[19],在拟南芥中它们分别由53、7、7 和5 个成员组成[20]。根据吸收动力学特性不同,硝酸盐转运系统分为低亲和力转运系统(1ow-affinity transport system,LATS)和高亲和力转运系统(high-affinity transport system,HATS)[21-22]。目前研究人员已在拟南芥、水稻、大豆和番茄等植物中分离出了NO3-转运蛋白NRT1基因和NRT2基因。
在研究水稻NRT1时发现,其基因家族有上百个成员,而NRT2却不到10 个[23]。在NRT1家族中,一部分基因可以转运二肽或NO3-,而另一部分则可以转运茉莉酰异亮氨酸、脱落酸、生长素和赤霉素等。NRT2.1、NRT2.2、NRT2.4和NRT2.5一般在外界硝酸盐含量较少时发挥调控作用,促进根系吸收NO3-,NPF6.3(CHL1/NRT1.1)和NPF4.6(NRT1.2)作用则相反;NPF2.7介导NO3-的跨膜运输;NPF1.1(NRT1.11)、NPF1.2(NRT1.12)、NPF2.13(NRT1.7)、NRT2.4和NRT2.5可以促进NO3-的重吸收利用;NPF2.3、NPF2.9(NRT1.9)、NPF7.3(NRT1.5)和NPF7.2(NRT1.8)在参与从地下部分至地上部分运输NO3-过程中起至关重要的作用。NRT1.5属于低亲和性双向转运体,主要在根原生木质部的中柱鞘中表达,其功能是将NO3-装载到木质部后进行长距离运输,与此同时NRT1.5也介导NO3-外排[24]。当硝酸盐浓度过高时,植物会将其储存在叶片中的液泡内,当需要时液泡中的NO3-能被转运出来进行代谢消耗。CLC基因家族参与液泡硝酸盐的运输,并参与调节植物氮素利用效率。有研究发现拟南芥中存在9 种CLC 转运蛋白,调节NO3-在液泡膜内外的运输,其中只要有一位成员发生改变都会影响NO3-在叶片中的积累[25]。随着科技的进步,人类通过克隆手段从大豆[26]、玉米[27]等植物中得到了CLC家族基因。拟南芥中也鉴定出与NO3-转运有关 的5 种S 型阴离子通道及其同系物家族基因,他们对保持植物细胞内阴离子动态平衡和CO2调控有重要意义,然而这类转运蛋白的功能研究较少[28-29]。
1.2 植物对NH4+-N 的吸收转运及分子调控机制
土壤中NH4+是植物生长的另一重要氮素来源,但是过量的NH4+对细胞有毒害作用[30]。目前,关于植物吸收NH4+的相关机制尚不明确。有人认为可能是植物根系细胞与外界NH4+浓度存在压力差,NH4+顺着这种势能差进入细胞,并在H+/NH4+协同运输载体的作用下,向土壤中泵出H+,以保持电荷平衡[31]。也有人认为当NH4+移动到原生质膜上时,随即在膜外脱去一个质子,并以 NH3的形式运输到膜内,膜内的NH3会进行再质子化,最终转化为NH4+[18]。还有一些人发现植物根系细胞可借助K+通道将NH4+运输至细胞内[32]。除了从外界环境中直接吸收NH4+,植物还可以通过呼吸作用、氨基酸代谢形成 NH4+,供自身利用。
研究显示,植物吸收NH4+也 有HATS 和LATS两类。当介质中NH4+浓度小于1 mmol·L-1时,前者起主导作用,当介质中NH4+浓度大于1 mmol·L-1时,后者起主导作用[33]。NH4+的HATS 主要是由根系表皮细胞上的铵转运蛋白(ammonium transporter,AMT)介导,分为AMT1 和AMT2 子家族[34]。迄今为止,已经从拟南芥、番茄、水稻、苜蓿、小麦、大豆以及人类动物中发现了AMT 的存在,表明AMT 在生物界中具有广泛分布[30]。目前发现水稻中有12 个铵盐转运蛋白基因,分为5 类OsAMT1~OsAMT5。其中,OsAMT1由3 个不同的成员组成,包括OsAMT1;1、OsAMT1;2和OsAMT1;3。OsAMT1;1在地上部分表达,OsAMT1;2在根中表达,两者都会受铵盐诱导;OsAMT1;3在根中表达,但受铵盐抑制[35]。对拟南芥的研究发现,拟南芥中存在5 个AMT1和1 个AMT2 转运蛋白,分别在不同条件下发挥作用[36]。
1.3 植物对有机态氮的吸收转运及分子调控机制
自矿质营养学说诞生以来,一种主流的观点是植物只能吸收像铵盐和硝酸盐这类的无机氮源[37-38]。随着科学技术的进步,人们借助于无菌培养和分子生物学技术发现植物能够直接吸收如尿素、氨基酸等有机态氮。尿素是一种人工合成且固体肥料中含氮量最高的有机氮肥,加上其化学性质稳定的优点,一直是我国农业生产中使用最多的一类氮肥。大多数人认为尿素只有水解为 NH4+后才能被植物吸收,该过程需要在土壤脲酶的参与下发生[39],其方程式为:

然而,人们发现植物的根和叶能直接吸收尿素,但其调控机制还未明确。一些植物如黄瓜、马铃薯、莴苣等,它们在没有脲酶参与下也能够直接吸收尿素,证明脲酶并不是植物吸收尿素的必备因素。研究发现尿素可与磷酸直接发生反应转变为氨甲酰磷酸,然后通过鸟氨酸代谢过程最终形成精氨酸参与蛋白质的合成。王彦辉等[40]研究发现,在谷子叶面喷施尿素能够有效提高植株光合效率并提高谷子产量。栗方亮等[41]已证实尿素还能促进土壤中硝化微生物繁殖,提高硝化反应速率,促进根系吸收尿素。
氨基酸是植物吸收利用有机态氮的另一种形式,不同氨基酸被植物吸收后在体内转运和分配过程不同。植物吸收氨基酸是通过细胞质膜上存在的特异性载体蛋白完成的。质膜上存在ATP 合成酶,其催化产生的H+电化学势梯度推动氨基酸由根部向茎叶部分输送[42]。氨基酸可以通过某些反应转化为其他种类的氨基酸,再被植物利用。研究发现,水稻幼苗依靠转氨基和脱氨基作用能够将14C-甘氨酸同化为不同类型的氨基酸[43]。目前,氨基酸转运家族被发现的不少于5 种,而且他们对不同的底物表现出不同的选择性和亲和力[44],分别为氨基酸转运AFT 家族(aminoacid/auxin permease,AAP1-5)、APC家族(aminoacid-polyamine-choline,APC)、MCF 家族(mitochon-drial carrier family,MCF)、PRAT/OEP16家族(pre-protein and amino acid transport)和DASS家族(DiT2.1,dicarboxylate transport)。研究表明,拟南芥 AtCATs1 和 AtCATs5 对阳离子氨基酸具有较高亲和力[45],AtCATs6 能转运必需中性氨基酸和碱性氨基酸(如赖氨酸)[46]。
1.4 氮的同化
NH4+同化是植物利用无机氮源经过各种生理生化反应最终转变成能被自身利用的有机氮的过程。在高等植物中,直接运输到体内或转化而来的NH4+借助谷氨酰胺合成酶(GS)/谷氨酸合成酶(GOGAT)循环完成氨基酸和蛋白质的代谢。其中对NH4+具有高亲和力的GS 广泛存在于根、茎、叶、花和果实等各种植物组织中,它是植物氮代谢过程中的关键酶和多功能酶。由于定位的差异,GS 分胞质型GS1 和质体型GS2。在拟南芥中有5 个GS1 蛋白(GS1;1、GS1;2、GS1;3、GS1;4、GS1;5,分 别 由GLN1;1、GLN1;2、GLN1;3、GLN1;4、GLN1;5 编 码)和1 个GS2(由GLN2 编码)。水稻内有3 类GS1(OsGS1;1、OsGS1;2 和OsGS1;3)。OsGS1;1 和OsGS1;2 为 高 亲和型GS,与拟南芥相对应的低亲和型合成酶(GS1;2和GS1;3)类似[47-48]。此外,有研究表明铵盐能引起代谢、基因表达以及根系结构的改变,这些过程不依赖铵盐的同化过程,说明铵盐可能本身也可作为信号分子发挥作用[49-50]。
此外,谷氨酰胺脱氢酶(GDH)、天冬氨酸转氨酶(AT)和天冬氨酸合成酶(AS)是植物氮同化的辅助途径。当细胞质内 NH4+浓度升高时,为保证细胞正常的生理活动不会紊乱,GDH 和AS 的活性会相应增强,迅速清除体内的NH4+并将其同化成谷氨酸,防止过高浓度的NH4+对植物组织产生毒害作用[51-52],但是它们的同化能力远不如GS/GOGAT 循环。也有研究证实,当GS 途径不能及时同化外界环境中的NH4+时,植物中的GDH 活性将会增加[53],植物在氮素同化过程中需要与其他代谢过程相互协调才能更好地促进植物生长。
2 转录因子在氮素响应中的作用
氮的吸收、转运和同化等过程都涉及高度精细的基因调控网络。随着科技的进步,涉及这些基因调控的转录因子也被陆续报道,如MADS-box、LBD、NLP、bZIP、MYB、NAC、BTB、TGA以及GRF等基因家族成员,它们在局部或整体水平上参与调控氮素的运输、信号转导和生长发育过程,在氮素响应中发挥重要作用[54]。AtANR1是一个参与编码 MADSbox 转录因子的基因,主要在CHL1 的下游发挥作用[55-56],其功能是调控侧根的生长,从而加强植物对氮素的吸收能力。AtAGL21也参与编码MADS-box转录因子,其功能主要在根中表达,通过控制根中生长素的合成来调控侧根的生长发育[57]。LBD(lateral organ boundary domain)基因家族中存在的LBD37、LBD38 和 LBD39 三个成员是硝酸盐信号的负调控因子,在各种形式氮源的诱导下会抑制NO3-吸收与同化[58]。NLPs(NIN-like protein)是硝酸盐信号通路中的一个正向调控因子,同时它也是调控硝酸盐信号的关键转录因子。试验表明拟南芥中存在9 个NLPs转录因子,它们都有可能参与氮素响应的调控[59]。其中,NLP7 是硝酸盐信号途径中的核心转录因子,负责调控NLP7 在细胞核内的积累而发挥功能,当NLP7 突变后硝酸盐对AtNIA1和AtNRT2.1的诱导将会受到抑制[60]。与此同时,NLP7 过量表达后会增强植物对氮素的吸收利用以及碳同化效率,提高植物光合作用速率[61]。bZIP 类转录因子主要在地上部分发挥作用,HY5 是该转录因子的核心,参与根系中硝酸盐的吸收和碳同化调控过程,并激活SWEETs和TPS1基因的表达[62]。同时,HY5 作为移动的信号分子还可以通过韧皮部从地上向地下部分移动,通过结合在自身启动子区域激活根中HY5 的表达,从而激活NRT2.1基因,对促进植物吸收氮素和维持C/N 平衡具有重要意义。GRF(growth regulating factors)类转录因子主要负责调控植物组织器官大小的作用。研究发现水稻中miR396-OsGRF4-OsGIFs 模块能够通过调控细胞大小和细胞数量来提高水稻籽粒的大小及饱满度,对水稻产量的提高至关重要[63-64]。
3 miRNA 在氮素响应中的作用
MicroRNA(miRNAs)是一类与特定“靶”信使核糖核酸(mRNA)配对的、内源性表达的非编码微小核糖核酸,通过翻译抑制或mRNA 降解负调节其表达[65]。同时它是真核生物基因组中基本的且序列特异性的调节元件[66]。miRNA 不仅与植物生长发育和多种代谢调控有关,而且在氮素响应方面也发挥了关键作用,尤其在植物对氮胁迫反应的响应方面。徐振华等[67]在对玉米中短暂硝酸盐限制条件有反应的微小核糖核酸检测时,结果在叶片中发现了9 个miRNA 家 族(miR164、miR169、miR172、miR397、miR398、miR399、miR408、miR528 和miR827),同时在根中也发现了9 个(miR160、miR167、miR168、miR169、miR319、miR395、miR399、miR408 和miR528)。采用实时茎环逆转录聚合酶链式反应进行鉴定,结果发现微小核糖核酸显示出对短暂硝酸盐限制的重叠或独特反应以及组织特异性。
植物对环境条件变化的一个最显著的例子是根系结构对硝酸盐供应的调节。Gifford 等[68]报道,植物对硝酸盐的反应时,中柱鞘细胞中的miR167 介导侧根起始和生长。通过对已知微小核糖核酸的初级转录本分析,发现了拟南芥中的几种非响应性微小核糖核酸,它们的丰度强烈依赖于油菜籽韧皮部汁液中的磷或氮状态,表明这些miRNAs 可能作为系统信号[69]。miR169 受到氮饥饿时表达量急剧减少,过量表达miR169a 的转基因拟南芥比野生型积累的氮也更少[70]。在高浓度氮源条件下,超表达miR444可以增加NO3-的积累,并提高NRTs基因的表达,然而降低了植物从老叶到新叶运输NO3-的能力,最终影响植物对氮素缺乏的适应能力[71]。
4 问题与展望
近年来人们对植物氮素的吸收、转运、同化、分配及其调控的生理与分子方面进行了不断的探索,取得了许多进展,然而氮素的吸收利用是一个十分复杂的生理和分子过程,其中涉及许多基因的表达,包括多个代谢步骤和网络信号的调控。植物对NO3-的吸收机制已经证明转运蛋白的存在,然而目前鉴定出的硝酸盐转运蛋白主要负责根部氮素的吸收同化,关于植物地上部分的氮素分配运输的相关转运蛋白却了解不多,而地上部分是影响其经济学产量和发挥生物学功能极其重要的场所。因此,加强植物地上部分硝酸盐转运蛋白转运机理的研究,并对其相关功能基因进行挖掘、筛选、鉴定和表达,这对于农作物氮高效品种的遗传改良是十分重要的。此外,对植物铵转运蛋白基因的研究大多集中在拟南芥等模式植物,其结构功能和蛋白水平上的调控研究应推广到其他植物上。与无机态氮相比,人们对植物如何感知、吸收和转运同化有机态氮研究不够深入。植物对有机态氮的吸收与无机态氮是否存在相互调控关系?其吸收转运的分子机制究竟如何?这些问题还有待进一步研究。
在基因组学技术的推动下,植物氮素信号通路中的转录因子、miRNA 和下游基因等正逐步得到解析,但是全方位的氮素响应信号网络还存在大量空白。如目前已经鉴定出如 SPL9、TGA1/4 和bZIP1 等转录因子,但针对这些转录因子调控的下游基因、氮源应答模式以及对植物生长发育的影响仍然未知。与此同时,与氮素相关的大多数miRNA 基本都是经过高通量测序分析之后的结果,对于 miRNA 具体如何调节氮素吸收和响应的生理分子机制仍需进一步研究分析。
随着多学科的不断延伸与融合,人们对植物氮素吸收、转运和同化的分子机理的研究将会不断深入,探明提高植物氮素利用效率的方法势在必行。此外,整合利用转录组、蛋白质组、代谢组等多组学技术对植物氮素高效利用基因进行筛选和鉴定,并利用基因工程技术对目标基因进行改造以获取优质氮高效利用基因,培育新的品种,这也是今后发展的方向。总之,植物氮素吸收同化的分子调控过程极其复杂,需要科研工作者的长期努力。
