硝酸盐对小麦幼苗根系早期生长和抗氧化特性的影响
2018-03-01顾泽玮单友田陈小雁蔡冬梅陈艳蝶景红娟
顾泽玮 单友田 陈小雁 蔡冬梅 陈艳蝶 景红娟


摘要:以小麦(Triticum aestivum L.)秋乐2122作为供试材料,以不含硝酸盐的Hoagland溶液为对照,研究不同浓度硝酸盐对小麦根系发育的影响。利用分光光度计和组化染色法检测根尖细胞中O2-·和H2O2含量,并测定细胞内相关氧化还原酶活性与还原型谷胱甘肽(GSH)含量。结果表明,硝酸盐能够显著增加小麦根尖细胞中O2-·而不是H2O2含量;高浓度硝酸盐(60 mmol/L)处理O2-·含量显著高于低浓度硝酸盐(10 mmol/L)处理。低浓度硝酸盐显著降低SOD酶活性和GSH含量,提高POD、谷胱甘肽还原酶(GR)和GSH-PX酶活性,使根部细胞具有良好的抗氧化能力,促进小麦根系生长。高浓度硝酸盐抑制小麦幼苗根系生长,是由于降低SOD与GSH-PX酶活性;虽然增加POD和GR酶活性,但是仍无法缓解根部细胞O2-·过量积累而造成的氧化损伤。所以不同浓度硝酸盐通过调节胞内O2-·含量,实现对小麦根系生长的调控。
关键词:硝酸盐;活性氧;小麦(Triticum aestivum L.);GSH;根系
中图分类号:S512.1 文献标识码:A
文章编号:0439-8114(2018)23-0061-04
DOI:10.14088/j.cnki.issn0439-8114.2018.23.014 开放科学(资源服务)标识码(OSID):
硝酸盐是植物利用的主要氮源,正常情况下土壤中其浓度小于1 mmol/L,但是随着氮肥的大量使用,其浓度可高达70 mmol/L[1]。小麦(Triticum aestivum L.)作为一种典型的单子叶须根系作物,根多、根深、根壮是其高产的基础。小麦根系发育不仅受遗传物质控制,而且生长环境因素也会极大地影响根发育[2]。研究表明,过量硝酸盐会抑制根系生长发育[3],而缺氮条件在抑制小麦幼苗生长的同时可以刺激根生长[4]。此外,硝酸盐还作为信号分子,通过生长素信号通路调节初生根生长与侧根起始发育[5]。因此,硝酸盐对根系生长发育起关键作用。
植物吸收的硝酸盐在内体还原同化生成游离氨,其通过抑制线粒体内呼吸链的电子传递[5],诱导生成过量的超氧阴离子(O2-·)[6],而且O2-·通过超氧化物歧化酶(Superoxide dismutase,SOD)酶促歧化生成半衰期更长的过氧化氢(H2O2)[7]。生成的H2O2可在过氧化氢酶(Catalase,CAT)和过氧化物酶(Peroxidase,POD)作用下生成水分子。O2-·与H2O2作为植物体中主要的两种活性氧(Reactive oxygen species,ROS),低浓度时作为重要信号分子调节根系生长发育[8-11]。还原型谷胱甘肽(Glutathione,GSH)和谷胱甘肽还原酶(Glutathione reductase,GR)通过维持根尖细胞氧化还原平衡,在根尖生长中起关键作用[8]。
硝酸盐通过硝酸转运体进入植物细胞调控根系生长发育[1,4]。但是,硝酸盐调控根系发育是否与ROS有关,鲜见报道。因此,研究不同浓度硝酸盐对O2-·、H2O2含量水平与胞内氧化还原酶活性和谷胱甘肽含量的影响,对阐明硝酸盐作用于小麦根系生长发育的机理有重要意义,也为农业生产中合理施加硝酸盐提供理论依据。
1 材料与方法
1.1 材料与培养
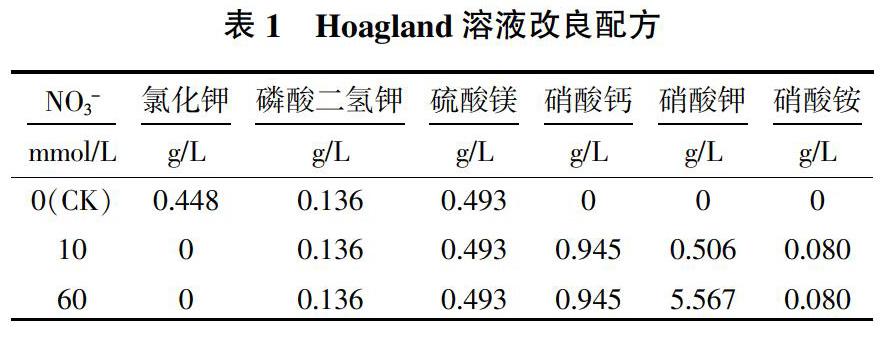
材料为冬小麦秋乐2122,购自河南秋乐种业科技股份有限公司。选取子粒饱满,大小均匀,无病虫害的小麦种子,用0.5%次氯酸钠消毒15 min,室温下黑暗萌发24 h,在铺有2层滤纸的培养皿中用去离子水培养1 d后备用。以不含有硝酸盐的改良Hoagland溶液为0 mmmol/L对照,含有10、60 mmmol/L硝酸盐的改良Hoagland溶液为处理继续培养6 d,用于形态和生理指标测定。Hoagland溶液改良配方见表1,在0 mmol/L溶液中为维持渗透和电荷平衡,用Cl-代替处理液的硝酸盐。培养条件为25~20 ℃,光照度4 000~4 500 lx,14 h光照/10 h黑暗。
1.2 测定指标与方法
测定上述培养6 d小麦幼苗的苗长、根长和根数。根部O2-·含量测定采用羟胺氧化法[11],H2O2含量测定采用钼酸铵法[12],根尖细胞O2-·与H2O2原位检测分别采用氮蓝四唑(NBT)[13]与3-3′-二氨基联苯胺(DAB)[14]染色法。SOD活性采用NBT光还原法测定,CAT活性采用紫外吸收法测定[15],POD活性采用愈创木酚法[15]测定。GSH和氧化型谷胱甘肽(GSSG)含量采用A061-1试剂盒测定,GR活力采用A062试剂盒测定,谷胱甘肽过氧化物酶(GSH-PX)活力采用A005试剂盒测定。上述指标测定均设3组平行,重复3次。
1.3 数据处理
利用Photoshop软件进行图片编辑;利用Origin 8.0软件进行数据计算、统计分析及绘图;采用t检验分析数据的差异显著性。
2 結果与分析
2.1 不同浓度硝酸盐对小麦苗期生长的影响
利用一系列浓度的硝酸盐连续处理小麦幼苗6 d,检测小麦幼苗根长、苗长等形态指标。根据前期试验结果,分别选取10、60 mmol/L硝酸盐进行后续试验。由表2可知,10 mmol/L硝酸盐显著促进小麦幼苗根的生长,其根系长度比对照增加了21%。60 mmol/L硝酸盐对小麦幼苗根的生长有抑制作用,其根长与对照相比降低了8.1%,且苗长也降低了7.9%。但是硝酸盐对根的数量没有显著影响。因此,10 mmol/L硝酸盐显著促进小麦幼苗根系生长,而60 mmol/L硝酸盐则抑制根系生长。
2.2 不同濃度硝酸盐对小麦幼苗O2-·与H2O2含量的影响
适量的ROS作为信号分子,在植物根系的生长发育过程中起关键作用[8-11]。为了探讨不同浓度硝酸盐促进和抑制小麦根系发育的机理,检测了小麦根尖细胞中O2-·和H2O2含量。由图1A可知,O2-·主要位于小麦根尖分生区和伸长区,10、60 mmol/L硝酸盐处理显著增加O2-·含量。图1B结果表明,H2O2含量均匀分布在根尖的各个区域,而硝酸盐处理能够增加小麦根尖分生区细胞H2O2含量。图1C的结果表明,10、60 mmol/L硝酸盐处理的O2-·含量分别比对照提高13.5%和101.7%,即60 mmol/L硝酸盐处理的小麦根尖细胞中O2-·含量比10 mmol/L硝酸盐高。图1B和图1D结果均表明,硝酸盐处理对小麦根尖细胞H2O2含量影响不显著。因此,硝酸盐处理能够显著增加小麦根尖细胞中O2-·含量,而对H2O2含量影响不大。
2.3 不同浓度硝酸盐对小麦幼苗根系氧化还原酶系活性及GSH含量的影响
为了探讨小麦根尖细胞中O2-·含量升高的原因,进一步检测了一系列与ROS代谢相关酶的活性。如图2A所示,与对照相比,10 mmol/L硝酸盐显著降低SOD活性,降低了21.0%。相反,硝酸盐处理能够显著提高POD活性,10、60 mmol/L硝酸盐处理分别提高POD活性11.8%和147.5%(图2B)。由图2C可知,硝酸盐处理对分解H2O2的酶CAT活性影响不大。因此,硝酸盐能够显著提高POD活性,而只有低浓度硝酸盐能够降低SOD酶活性。
谷胱甘肽(GSH)是细胞内重要的氧化还原物质,在维持细胞内氧化还原平衡即内稳态过程中起关键作用[8]。10 mmol/L硝酸盐处理显著降低小麦根尖细胞中GSH含量,而60 mmol/L硝酸盐则显著增加GSH含量,其含量分别为对照的82.2%和131.7%(图3A)。而GSH的氧化形式GSSG在不同浓度硝酸盐处理条件下无显著差异(图3B)。GR是还原性GSH再生的一种关键酶,10 mmol/L硝酸盐和60 mmol/L硝酸盐处理GR活性分别是对照的11.1倍和15.8倍(图3C)。GSH-PX是一种通过氧化GSH降解H2O2的酶,从图3D中可知,10 mmol/L硝酸盐提高GSH-PX酶活性11.2%,而60 mmol/L硝酸盐降低GSH-PX酶活性23.6%。
3 小结与讨论
研究发现,低浓度硝酸盐(10 mmol/L)能够促进小麦根系伸长生长,而高浓度硝酸盐(60 mmol/L)反而会抑制小麦根系生长,再次证明了硝酸盐对根系生长发育的双重作用[3,4]。低浓度硝酸盐能够诱导根部O2-·浓度升高,而一定浓度ROS能够促进细胞壁松弛,有利于细胞伸长生长[14]。高浓度硝酸盐诱导小麦产生大量O2-·,使得细胞内氧化还原动态平衡改变,同时也会引起细胞内物质与结构损伤,最终表现为抑制小麦幼苗生长。
细胞内参与ROS代谢的酶类主要是SOD、POD和CAT[15]。硝酸盐能够显著提高POD活性,却对CAT活性影响不显著,而只有低浓度硝酸盐降低SOD酶活性。SOD可以将O2-·转化为H2O2[7],其活性降低是硝酸盐诱导O2-·升高的原因之一。硝酸盐诱导O2-·升高势必造成细胞内过氧化物浓度升高,而POD活性升高能够及时消除由于O2-·升高对细胞造成的损伤;同时,POD也是催化H2O2分解的酶,其活性升高也是细胞H2O2含量不变的原因。因此,硝酸盐诱导生成的H2O2主要依赖于POD降解而非CAT。这可能与CAT活性并非仅仅受到底物与产物影响,还受到NADPH氧化酶活性及转录水平调控有关[7]。所以,植物体可能更倾向于维持低H2O2含量状态,以此来保持细胞对H2O2这种信号分子类似于Ca2+的敏感性[16],使得生长能够对环境的变化快速作出应答。
除了上述参与ROS代谢的抗氧化酶以外,GSH也是调控细胞内氧化还原平衡的重要物质[8]。高浓度硝酸盐可以诱导根部细胞内GSH升高,而低浓度硝酸盐则降低GSH含量,但其氧化型GSSG的含量与对照无差异。因此,高浓度硝酸盐通过上调GSH来维持氧化还原动态平衡,而低浓度硝酸盐则不需要,反而降低了GSH含量。因此,高浓度硝酸盐为了维持较高的GSH含量,通过提高GR活性来实现。进一步证明了GR和GSH通过调节细胞氧化还原平衡,从而调节根的生长[8]。但是,随着细胞内O2-·持续升高,高浓度硝酸盐GSH-PX活性降低,而低浓度硝酸盐GSH-PX活性较高。另外,高浓度硝酸盐增加POD活性,说明除了GSH-PX以外,其他POD是清除升高ROS的主力军。
综上所述,高浓度硝酸盐处理下O2-·大量积累,由于已经超出了细胞内氧化还原体系所能调节的能力,最终表现为抑制生长;而低浓度硝酸盐O2-·适量积累,则是作为信号分子促进了根伸长生长[17,18]。
参考文献:
[1] KRAPP A,DAVID LC,CHARDIN C,et al. Nitrate transport and signalling in Arabidopsis[J].Journal of Experimental Botany,2014, 65(3):789-798.
[2] TIAN H Y,SMET I D,DING Z J,et al. Shaping a root system:Regulating lateral versus primary root growth[J].Trends Plant in Science,2014,19(7):426-431.
[3] REP■?魣K M,PALOVE-BALANG P,DU■AIOV?魣 Z K,et al. High nitrogen supply affects the metabolism of Matricaria chamomilla leaves[J].Plant Growth Regulation,2014,73(2):147-153.
[4] GUO T,XUAN H,YANG Y,et al. Transcription analysis of genes encoding the wheat root transporter NRT1 and NRT2 families during nitrogen starvation[J].Journal of Plant Growth Regulation,2014,33:837-848.
[5] BOUGUYON E,PERRINE-WALKER F,PERVENT M,et al. Nitrate controls root development through post-transcriptional regulation of the NRT1.1/NPF6.3 transporter/sensor[J].Plant Physiology,2016,172(2):1237-1248.
[6] 景紅娟,李翠香,王俊峰,等.NOXs生成的活性氧对根生长和发育调控的研究进展[J].植物生理学报,2013,49(5):417-424.
[7] MITTLER R,BLUMWALD E. The roles of ROS and ABA in systemic acquired acclimation[J].The Plant Cell,2015,27(1):64-70.
[8] YU X,PASTERNAK T,EIBLMEIER M,et al. Plastid-localized glutathione reductase2-regulated glutathione redox status is essential for Arabidopsis root apical meristem maintenance[J].Plant Cell,2013,25(11):4451-4468.
[9] FOREMAN J,DEMIDCHIK V,BOTHWELL J H,et al. Reactive oxygen species produced by NADPH oxidase regulate plant cell growth[J].Nature,2003,422:442-446.
[10] MONSHAUSEN G B,BIBIKOVA T N,MESSERLI M A,et al. Oscillations in extracellular pH and reactive oxygen species modulate tip growth of Arabidopsis root hairs[J].PNAS,2007, 104(52):20996-21001.
[11] DUNAND C,CREVECOEUR M,PENEL C. Distribution of superoxide and hydrogen peroxide in Arabidopsis root and their influence on root development:Possible interaction with peroxidases[J].New Phytologist,2007,174(2):332-341.
[12] TEWARI R K,KIM S,HAHAN E J,et al. Involvement of nitric oxide-induced NADPH oxidase in adventitious root growth and antioxidant defense in Panax ginseng[J].Plant Biotechnology Reports,2008,2(2):113-122.
[13] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[14] GILL S S,TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].Plant Physiology and Biochemistry,2010,48(12):909-930.
[15] EVANS M J,CHOI W,GILROY S,et al. A ROS-assisted calcium wave dependent on the AtRBOHD NADPH oxidase and TPC1 cation channel propagates the systemic response to salt stress[J].Plant Physiology,2016,171(3):1771-1784.
[16] MORGAN M J,LEHMANN M,SCHWARZL?魧NDER M,et al. Decrease in manganese superoxide dismutase leads to reduced root growth and affects tricarboxylic acid cycle flux and mitochondrial redox homeostasis[J].Plant Physiology,2008,147:101-114.
[17] ZHANG M,WANG C,LIN Q,et al. A tetratricopeptide repeat domain-containing protein SSR1 located in mitochondria is involved in root development and auxin polar transport in Arabidopsis[J]. Plant Journal,2015,83(4):582-99.
[18] WEI J,ZHENG Y,FENG H,et al. OsNRT2.4 encodes a dual-affinity nitrate transporter and functions in nitrate-regulated root growth and nitrate distribution in rice[J].Journal of Experimental Botany,2018,69(5):1095-1107.
