生理浓度二苯酮-3暴露对小鼠卵母细胞体外成熟及其质量的影响
2022-06-21尹锦雯朱海瑛肖国宏
尹锦雯 朱海瑛 肖国宏
1广州医科大学附属第三医院妇产科,广东省产科重大疾病重点实验室(广州 510150);2广东省妇幼保健院生殖健康与不孕症科(广州 511442);3广州医科大学附属第二医院妇科(广州 510260)
随着社会经济和工业化的发展,环境污染如大气污染、水环境污染、噪音污染、辐射等严重影响了女性生殖系统的功能,导致卵巢早衰甚至造成不孕不育,使得越来越多人的生育力降低[1-3]。先前有研究证明,环境污染物与生殖系统健康关系密切,例如:双酚A[4-5]、百草枯[6-7]、赭曲霉毒素A 等[8-9]环境污染物影响斑马鱼、小鼠、牛和羊等卵子成熟,导致早期胚胎发育异常等。二苯酮-3(benzophenone-3,BP-3)是防晒霜的主要成分,能有效减少紫外线对人体的伤害,同时广泛应用于洗发露、化妆品等个人护理用品中[10]。随着人们防晒意识的加强,BP-3使用越来越多,已成为环境污染物,研究发现[11],BP-3 在游泳池、湖泊、海水等水环境中都被检测到,且在人体的尿液、血液、乳汁、胎盘中也检测到BP-3。也有研究已经证明[12-13],BP-3 会影响哺乳动物神经系统的正常发育和功能,25 μmol/L BP-3会降低小鼠新皮质细胞类视黄醇受体的表达,说明BP-3 具有神经毒性。美国食品和药物管理局(FDA)建议的阈值为2.2 nmol/L[14],而BP-3 在人体血浆中的生理浓度为0.7 ~0.9 μmol/L。目前,BP-3对哺乳动物生殖系统的影响的报道较少。因此,探究生理浓度范围内BP-3 暴露对小鼠卵母细胞减数分裂成熟及其质量的影响是有必要的,旨在为环境污染物对女性生殖系统的危害提供参考。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 本实验所用小鼠为ICR品系,6 ~10周龄的雌性小鼠。本研究所用小鼠均购自广东省动物实验中心,所有实验均获得广州医科大学第三附属医院医学伦理委员会批准。医院伦理批件号:医伦会审[2020]第021号,审批时间2020-04-09。
1.1.2 主要试剂和仪器 主要试剂PMSG、HCG购自宁波第二激素厂,M2 培养液、M16 培养液、二甲基亚砜(DMSO)购自美国Sigma 公司,BP-3 购自Selleck Chemicals 公 司,Annexin-V-FITC 购 自Life Technologies 公 司,一抗γ-H2AX 购于CST 公司,二抗购于Abcam 公司,RNA 提取试剂盒购自Qiagen 公司,荧光定量检测试剂盒购自TaKaRa 公司。主要仪器包括尼康倒置荧光显微镜、Applied Biosystems ABI-7900 SDS 实时荧光定量PCR 仪。
1.2 实验方法
1.2.1 卵母细胞的收集和成熟培养 选取6~10周龄的雌性ICR 小鼠,每只小鼠腹腔注射5 IU 的PMSG 进行超排处理,48 h 后颈椎脱臼处死小鼠,取出GV 期卵子放入平衡后的M16 培养液中,放入37 ℃、5%CO2饱和湿度的培养箱中培养,17 h 后统计第一极体(PB1)排出情况。
1.2.2 卵母细胞的试验处理 将BP-3 溶解于DMSO,以50 mmol/L的浓度分装,-80 ℃保存。使用前用M16 培养液将BP-3 的浓度稀释成2 nmol/L、25 nmol/L、0.25 μmol/L、0.8 μmol/L、1.5 μmol/L,简称BP-3 培养液。将采集的小鼠GV 期卵子,分别放入M16 培养液(对照组)及BP-3 培养液中,体外培养17 h 后统计PB1 排出情况。GV 期卵子体外培养结果显示,BP-3 浓度为25 nmol/L、0.25 μmol/L、0.8 μmol/L、1.5 μmol/L 处理后的卵子PB1 排出率低于对照组(P<0.05),见表1。BP-3浓度为2 nmol/L 时,卵子成熟率与对照组差异无统计学意义(P>0.05),BP-3 使用浓度越高卵子成熟率越低,说明小鼠卵子成熟与BP-3 呈剂量依赖性,见图1。近期研究表明BP-3 在血浆中的生理浓度在0.7~0.9 μmol/L 之间[10,13],因此本实验BP-3 组采用的BP-3 处理浓度为0.8 μmol/L。
表1 不同浓度BP-3 处理对卵子体外成熟的影响Tab.1 Effects of different BP-3 concentrations on in vitro oocyte maturation ±s
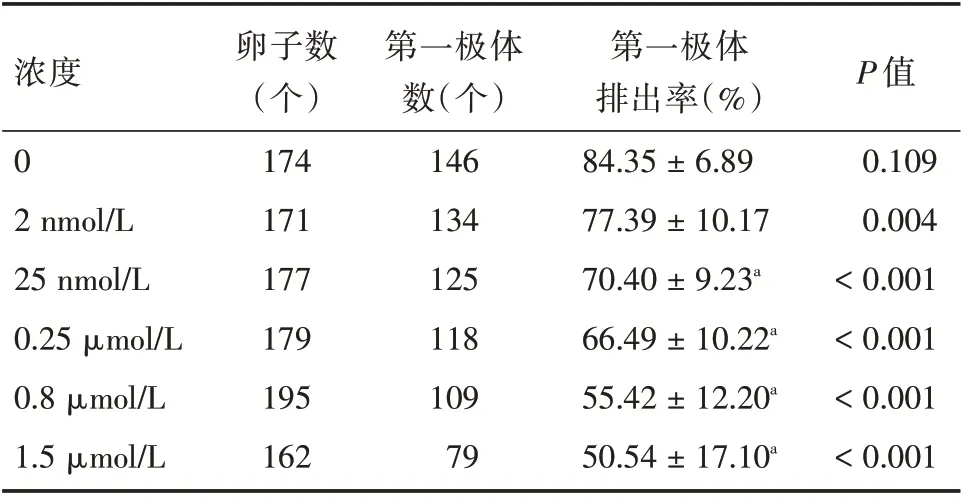
表1 不同浓度BP-3 处理对卵子体外成熟的影响Tab.1 Effects of different BP-3 concentrations on in vitro oocyte maturation ±s
注:与对照组相比,aP <0.05
浓度0 2 nmol/L 25 nmol/L 0.25 μmol/L 0.8 μmol/L 1.5 μmol/L卵子数(个)174 171 177 179 195 162第一极体数(个)146 134 125 118 109 79第一极体排出率(%)84.35±6.89 77.39±10.17 70.40±9.23a 66.49±10.22a 55.42±12.20a 50.54±17.10a P 值0.109 0.004<0.001<0.001<0.001<0.001

图1 BP-3 暴露影响小鼠卵母细胞体外成熟率Fig.1 BP-3 exposure affects in vitro maturation rate of mouse oocytes
1.2.3 卵母细胞的ROS、DNA 损伤和早期凋亡的测定 以DCHFDA为标记探针检测卵子ROS含量,将100 μmol/L DCHFDA染料加入卵子中,37 ℃、5%CO2培养箱中孵育30 min,再用PBS 洗涤3 次,通过荧光显微镜观察。使用ImageJ 软件分析卵母细胞的荧光强度,荧光越强代表ROS 水平越高。
γ-H2AX 免疫荧光染色检测DNA 损伤,用4%多聚甲醛固定成熟卵子30 min,1%Triton-X 透膜20 min,0.5%BSA 室温封闭3 h,加入一抗γ-H2AX(1∶400)4 ℃孵育过夜,PBS 洗涤3 次,加入二抗IgG(1∶500)孵育1 h,PBS 洗涤3 次,加入DAPI(1∶800)孵育4 min 后,压片后用荧光显微镜观察。
采用Annexin-V-FITC 试剂盒检测卵子凋亡,卵子加入Binding Buffer 洗涤5 min,然后加入490 μL 1×Binding Buffer 以及5 μL Annexin V-FITC,轻轻混匀,室温避光孵育15 min,用PBS 洗涤3 次后移至载玻片上,立即在荧光显微镜下观察荧光信号。
1.2.4 qRT-PCR 检测mRNA 的表达 采用Qiagen RNeasy Mini Kit RNA 提取试剂盒提取总RNA,测定浓度后使用逆转录试剂盒进行逆转录,按说明书配置好20 μL qRT-PCR 反应体系。预变性95 ℃30 s;变性95 ℃5 s;退火60 ℃30 s;延伸72 ℃1 min,循环40 次。引物序列如下:GAPDH:正 向5′-CAGGTTGTCTCCTGCGACTTCA-3′,反 向5′-GTGGGTGGTCCAGGGTTTCTTA-3′,产物长度为190 bp;Gpx1:正向5′-CCAGGAGAATGGCAAGAATGAA-3′,反 向5′-AGGAAGGTAAAGAGCGGGTGAG-3′,产物长度为138 bp;Sod1:正向5′-CACTCTCAGGAGAGCATTCCA-3′,反向5′- CCCAGCATTTCCAGTCTTTG-3′,产物长度为110 bp;Bax:正向5′-TTTGCTTCAGGGTTTCATCC-3′,反向5′-ATCCTCTGCAGCTCCATGTT-3′,产物长度为162 bp;Bcl2:正 向5′-TCGCTACCGTCGTGACTTCGC-3′ ,反 向5′-GCATCCCAGCCTCCGTTATCC-3′,产物长度为273 bp。按照2-ΔΔCt计算目的基因的相对表达量。
1.3 统计学方法 采用SPSS 17.0 进行数据分析。所有数据均以均数±标准差表示,两组间比较采用独立样本t检验;多组间比较采用方差分析。每个统计至少3 个生物学重复,每个重复是由一个独立的试验在不同的时间完成。P<0.05 为差异有统计学意义。
2 结果
2.1 BP-3 对卵子ROS、DNA 损伤和早期凋亡的影响 免疫荧光结果显示,BP-3 处理后的卵子ROS 水平升高,与对照组相比差异有统计学意义(P<0.05),见图2;BP-3 暴露的小鼠卵子γ-H2AX信号明显强于对照组,组间差异有统计学意义(P<0.05),见图3A、C,说明BP-3 暴露的卵子中DNA 双链断裂(DSBs)数量显著提高。此外,通过Annexin-V 法检测了卵子中早期凋亡情况,与对照组相比,BP-3 暴露组的小鼠卵子早期凋亡比例显著增加(P<0.05),见图3A、B。
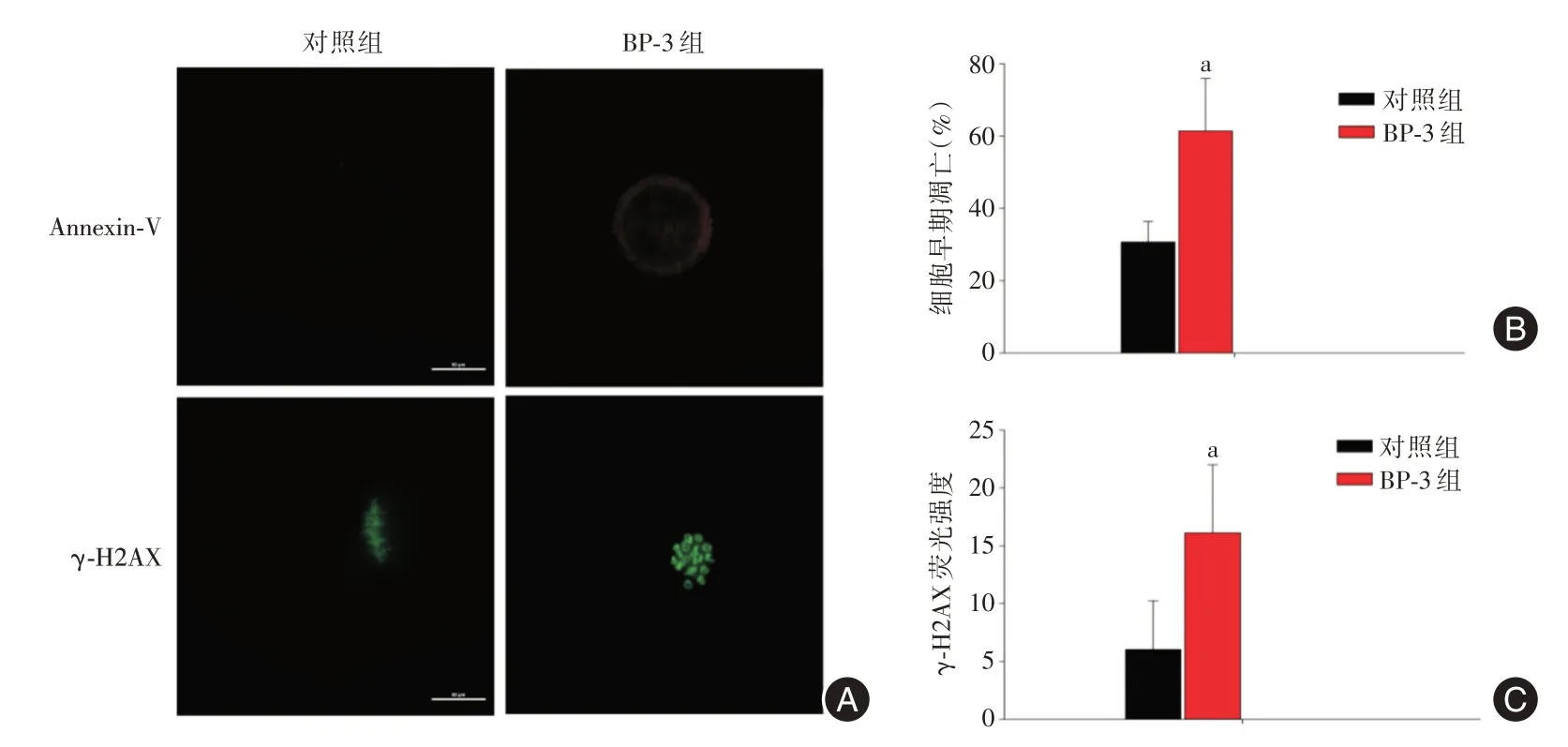
图3 BP-3 暴露引起小鼠卵子早期凋亡和DNA 损伤Fig.3 BP-3 exposure induces early apoptosis and DNA damageof mouse oocytes
2.2 卵子中Gpx1、Sod1、Bax、Bcl2基因的转录水平 qRT-PCR 结果显示,BP-3 暴露的卵子中Gpx1的表达显著下调(P<0.05),对Sod1基因的表达没有明显变化(P>0.05)。此外,与对照组相比,BP-3组明显提高了Bax的表达水平,抑制了Bcl2的转录(P<0.05),见图4。
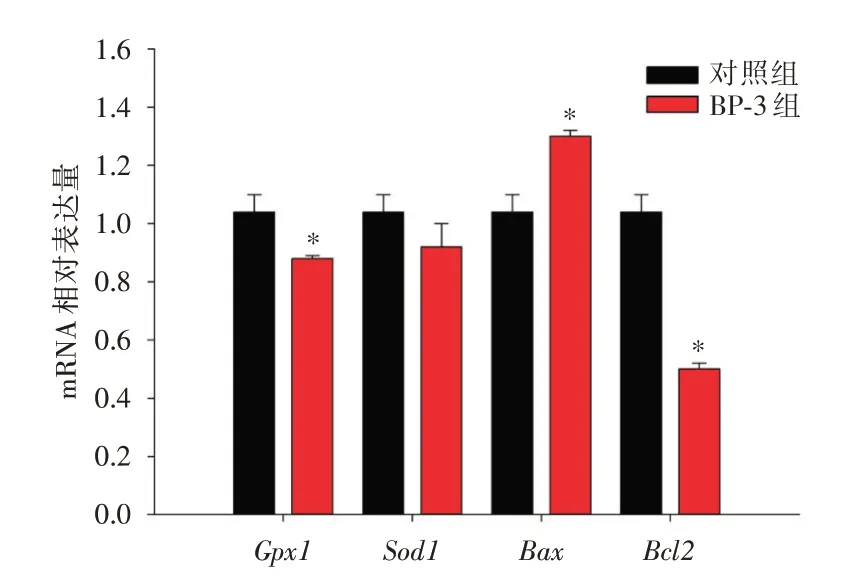
图4 成熟卵子中氧化应激与凋亡相关基因的表达水平Fig.4 Expression levels of oxidative stress and apoptosisrelated genes in matured mouse oocytes
3 讨论
随着皮肤癌的发病率不断提高,人们对皮肤癌的防护意识也越来越强,防晒霜的使用也随之增加[15-16]。BP-3是一种紫外线吸收剂,常用于防晒霜中,可以有效保护皮肤免受紫外线伤害,同时也是一种新型的环境污染物,在许多水环境中被检测出来,会影响鱼类的孵化率和繁殖率、影响海胆骨架系统的发育、导致珊瑚白化、变形,甚至死亡[17-19]。研究发现,BP-3 能穿透角质层直接接触皮肤,被人体吸收,容易引起光过敏,甚至还会影响内分泌和雌激素水平[2]。但目前,BP-3 对哺乳动物卵子成熟和胚胎发育的影响的研究较少。因此,本研究选择小鼠作为研究对象,探讨BP-3 的生理浓度是否会对卵子成熟及质量造成影响是本次实验的目的。
PB1 的排出标志着第一次减数分裂的完成,是卵子成熟的重要标志物。本次研究通过将小鼠卵子暴露在不同浓度的BP-3 中,观察不同浓度的BP-3 对小鼠卵子成熟的影响。实验结果表明,2 nmol/L BP-3 处理组的卵子PB1 排出率与对照组相比没有显著差异,说明在FDA 的安全建议量范围内BP-3对卵子的成熟发育无影响。但是,与对照组卵子相比,25 nmol/L、0.25、0.8、1.5 μmol/L BP-3处理均降低了卵子体外成熟水平,且BP-3的浓度与PB1排出率呈负相关(P<0.05)。BP-3 在血浆中的生理浓度为0.7 ~0.9 μmol/L,说明生理浓度BP-3暴露会导致小鼠卵子成熟率下降。
卵子体外培养因暴露在光和高浓度氧的环境中,容易产生大量的ROS,发生氧化应激,有研究发现,氧化应激会损伤线粒体蛋白质和DNA,从而介导细胞凋亡[20-21]。研究结果证明,0.8 μmol/L BP-3 暴露明显提高了卵子的ROS 水平且抗氧化基因Gpx1的表达下调(P<0.05),这与黄倩倩[20]、MOMTAHAN 等[21]的研究结果相似。
Bcl2和Bax是重要的凋亡相关基因,Bcl2 表达过量能够阻止细胞色素C 从线粒体释放到细胞质中,从而抑制细胞凋亡[22]。而Bax过表达时则会拮抗Bcl2的保护作用,促进细胞凋亡[23]。γ-H2AX是DNA 双链断裂的标志物,当DSBs 发生时H2AX会被磷酸化形成γ-H2AX[24]。本研究发现,BP-3 处理降低了卵子中Bcl2基因表达,上调了Bax 基因转录,提高了γ-H2AX 的表达水平(P<0.05),说明BP-3 处理会引起小鼠卵子发生早期凋亡,加剧DNA 损伤,这与先前的研究结果一致[24-26]。以上结果表明生理浓度BP-3 暴露可能会导致卵子早期凋亡及其质量下降。
综上所述,BP-3 是常见的环境污染物,生理浓度范围内BP-3 暴露会破坏卵子胞内氧化还原平衡,引起DNA 损伤和早期凋亡,最终导致卵子体外成熟水平显著降低。同时本研究仍存在一些局限性:体外实验初步证明了BP-3 对小鼠卵子发育的影响,但体内环境与体外存在差异,需结合体内实验作进一步评估;有关减数分裂过程中染色体的排列、纺锤体的形态以及对卵母细胞线粒体质量的影响也有待进一步的研究。然而,BP-3 在生活用品中的广泛使用是否会对人类卵子和胚胎发育造成影响目前尚未清楚,在今后的研究中需要结合临床试验,以全面评估BP-3 的生物安全性及其可能带来的生殖危害。本研究为BP-3 对女性生殖系统存在的潜在危害提供了初步的实验依据。
