AMD3100干预CXCR4对哮喘小鼠气道黏蛋白MUC5ac蛋白表达的影响
2022-06-21王莉刘小静张建勇
王莉 刘小静 张建勇
贵州省遵义医科大学附属医院呼吸与危重症医学科(贵州遵义 563000)
支气管哮喘(简称哮喘),是一种慢性气道疾病,主要特征有气道慢性炎症、气道高反应性及气道黏液高分泌[1]。其中,气道黏液高分泌是在多种致病因素的刺激下,导致气道杯状细胞肥大和增生所致的分泌高反应现象,其产生的大量黏液可引起气流受限、气道阻塞,甚至窒息导致哮喘患者死亡[2],其中,黏蛋白MUC5ac 被认为是气道黏液最主要的成分之一,气道上皮杯状细胞增生及高分泌可引起其过度表达[3-4],因此气道MUC5ac表达被作为气道黏液高分泌的强度的一个重要指标。同时,多种细胞因子在哮喘中发生发展发挥作用,如IL-4、IL-5 促进嗜酸性粒细胞增多、黏液分泌增加。CXC 趋化因子受体4(CXC chemotactic rese-ptor4,CXCR4)是一种G 蛋白偶联受体,其配体是CXCL12,又称基质细胞衍生因子1(stromal cell-derived factor-1,SDF-1),两者共同作用可趋化炎症细胞、调节其他细胞因子的表达及促进血管新生、重建等。AMD3100 是一种CXCR4 拮抗剂,与CXCR4 有效的结合可阻断SDF-1 与CXCR4 之间的信号转导发挥作用[5]。WANG 等[6]发现CXCR4可能在哮喘气道炎症和气道重塑中起作用,表现为CXCR4 在哮喘8 周模型组支气管壁面积、支气管平滑肌面积和气道壁平滑肌细胞数量较哮喘4 周模型组表达增加,但是否参与气道黏液高分泌,目前尚未明确。本研究通过卵清白蛋白致敏和激发构建小鼠哮喘模型,观察AMD3100 干预CXCR4 蛋白表达对哮喘小鼠气道黏蛋白MUC5ac的影响,探讨其抑制哮喘气道黏液高分泌的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级6~8 周龄,BALB/C 小鼠24 只,体质量(18.06 ± 1.24)g ,雌性,由湖南斯莱克实验动物有限公司[SCXK(湘)2019-0004]。伦理审查编号:KLLY(A)-2019-101。
1.1.2 实验试剂 AMD3100(美国Sigma 公司)、卵清蛋白(OVA)(Ⅱ和Ⅴ级)、氢氧化铝凝胶(英国invivogen 公司),小鼠IL-4、IL-5 试剂盒(北京四正柏生物技术有限公司),小鼠CXCR4 试剂盒(上海江莱生物技术有限公司),AB-PAS 染色(北京索来宝生物技术有限公司),兔抗小鼠-MUC5ac 单克隆抗体(北京博奥森生物技术有限公司),兔抗小鼠-CXCR4 多克隆抗体(Proteintech 中国公司),免疫组化检测(二步法)、二氨基联苯胺(DAB)显色试剂盒(北京中杉生物技术有限公司),RNAiso Reagent、逆转录试剂盒、SYBR®GREEN PCR Master Mix(大连TaKaRa 公司),CXCR4、β-actin 实时荧光定量PCR 引物(上海捷瑞生物工程有限公司)。实验仪器:标准雾化箱(27 cm × 24 cm × 11 cm,自制),压缩式雾化器NE-C900(大连欧姆龙有限公司),-80 ℃冰箱及Multiskan spectrum 酶标仪(美国Thermo 公司),离心机、核酸蛋白测量仪、荧光定量PCR 仪分别来自德国Eppe-ndorf公司、美国Nanodrop公司及BIO-RAD公司,电子天平(BS210S)。
1.2 方法
1.2.1 动物模型制备 随机将小鼠分为正常组、哮喘组、CXCR4 阻滞剂AMD3100 组,每组8 只。参照KIM 等[7]和CASARO 等[8]方法,结合本课题多年哮喘小鼠模型制作方法并综合改进,将单独腹腔注射或腹腔注射联合单个部位皮下注射OVA致敏,改进为腹腔注射联合多个部位皮下注射OVA 致敏。哮喘组、CXCR4 阻滞剂AMD3100 组分别在第1、13 天腹腔注射等剂量40 μg OVA+1 mg氢氧化铝,共0.2 mL,同时颈部皮下注射20 μg 0.1 mL OVA+1 mg 0.1 mL 氢氧化铝及双侧大腿根部皮下分别注射10 μg 0.1 mL OVA+1 mg 0.1 mL氢氧化铝注射致敏。第19 ~23 天,通过自制雾化箱对小鼠进行雾化治疗,10% OVA(Ⅱ级)通过生理盐水稀释形成气溶胶雾化激发,每天30 分钟,共1 次;共计16 只小鼠成功构建哮喘模型,无小鼠死亡。正常组于第1 天和第13 天腹腔注射PBS 0.2 mL 联合颈部、双侧大腿根部皮下注射0.9%氯化钠注射液0.1 mL 致敏,第19 ~23 天,小鼠置于密闭雾化箱中雾化,生理盐水气溶胶雾化激发,每天1 次,每次30 min,至第24 天,无小鼠死亡。
1.2.2 给药方法 CXCR4 阻滞剂AMD3100 组第19 ~23 天,于每次激发前30 min 腹腔注射10 mg/kg AMD3100[9](配制方法:予磷酸盐缓冲液5 mL 加入5 mg AMD3100 固体粉末中使其溶解,此刻浓度为1 mg/mL,每只小鼠腹腔注射0.2 mL);正常组和哮喘组采用等剂量PBS 代替OVA 腹腔注射。
1.2.3 标本采集 末次激发24 h 后麻醉处死各组小鼠,打开胸腔剪取分别取右肺上中叶、右肺下叶,置于EP 管中-80 ℃冰箱保存及4% 多聚甲醛中常温固定,分别予备mRNA 提取及制备石蜡标本、切片,右肺下叶用于HE、AB-PAS 染色及免疫组化测定放。右肺下叶置于4% 多聚甲醛中室温固定,沿颈部正中切开,充分暴露颈部气管并行“V”型切口,留置针于切口处插入气管,生理盐水0.3 mL 缓慢注入肺内,回抽灌洗液置于EP 管,共3次,回收80%以上,4 ℃离心,上清液保存于-80 ℃冰箱,沉淀涂片行细胞分类及计数。
1.2.4 肺组织病理学检查及图像分析 根据试剂盒说明书对肺组织切片行HE、AB-PAS 染色。在普通光学显微镜下观察。参照HENDERSON 等[10]方法对HE 染色进行支气管周围炎症细胞浸润评分,炎症细胞浸润有5 个评分标准,分别为无、少许、较多分布不均匀、大量均匀不成团、大量均匀并成团,分数为0 ~4 分;两位病理科医生进行盲法评价。AB-PAS 染色:有酸性、中性及混合黏液物质及细胞表达,分别呈现为蓝色、红色及紫红色,根据图像分析软件测量气道黏液物质表达情况。
1.2.5 各组小鼠BALF 中CXCR4、IL-4、IL-5 含量 使用ELISA 法根据试剂盒说明书进行操作并计算BALF 中各检测指标的浓度。
1.2.6 免疫组化(immunohistochemical,IHC)检测肺组织MUC5ac 及CXCR4 蛋白含量 常规脱蜡至水、微波抗原修复,3%过氧化氢去酶,其余操作严格按说明书进行。阳性对照:MUC5ac 黏蛋白单克隆抗体及兔抗小鼠CXCR4 多克隆抗体的稀释浓度均为1∶100;空白对照用:PBS 代替一抗。MUC5ac 蛋白阳性染色为细胞浆、细胞膜,CXCR4蛋白阳性染色位于细胞膜和细胞质之中,光学显微镜下观察阳性细胞为棕黄色。
1.2.7 RT-PCR 检测小鼠肺组织CXCR4 mRNA水平根据说明书提取小鼠肺组织中的RNA,将mRNA 逆转录成cDNA,以此为模板行RT-PCR 扩增。设置CXCR4 mRNA 引物序列:上游引物:5′-ACTGGCATAGTCGGCAA-3,下游引物:5′-TGACAAAGAGGAGGTCAGC-3;βactin 上游引物:5′-GGGAAATCGTGCGTGAC-3,下游引物:5′-AGGCTGGAAAAGAGCCT-3′。由计算机自动计算并读出每个样本定量结果Ct值(threshold cycle)。采用2-△△Ct法计算CXCR4 mRNA(△Ct=Ctβ-actin-Ct CXCR4)的相对表达量。
1.3 统计学方法 采用SPSS 18.0 进行数据分析,实验统计结果以均数±标准差表示,组间比较采用单因素方差分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 各组小鼠支气管周围炎症细胞浸润病理评分比较 正常组、哮喘组和AMD3100 组小鼠炎症浸润评分分别为(0.50 ± 0.54)、(3.66 ± 0.52)、(2.67± 0.82)分,AMD3100 组小鼠支气管周围炎症病理评分较哮喘组降低,但仍高于正常组(P<0.05,表1)。
表1 各组小鼠支气管周围炎症细胞浸润病理评分比较Tab.1 Comparison of pathological scores of peribronchial inflammatory cell infiltration in each group ±s
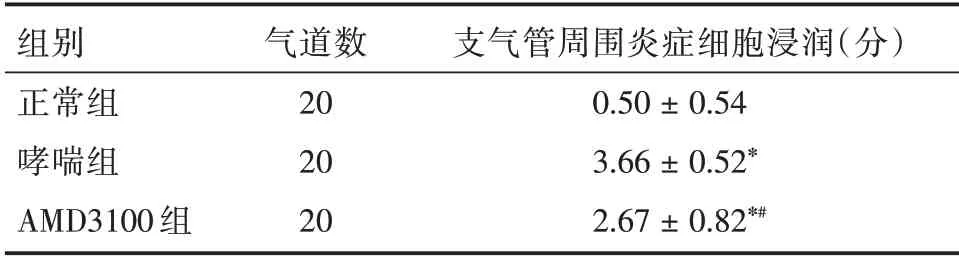
表1 各组小鼠支气管周围炎症细胞浸润病理评分比较Tab.1 Comparison of pathological scores of peribronchial inflammatory cell infiltration in each group ±s
注:*表示与正常组比较,P <0.01;#表示与哮喘组比较,P <0.05
组别正常组哮喘组AMD3100 组气道数20 20 20支气管周围炎症细胞浸润(分)0.50±0.54 3.66±0.52*2.67±0.82*#
2.2 HE 染色 见图1。
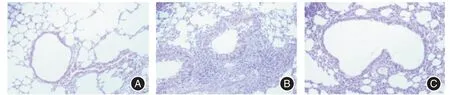
图1 肺组织病理学变化Fig.1 Pathological changes of lung tissue
2.3 各组小鼠气道上皮AB-PAS 染色结果 正常组小鼠气道组织中极少观察到杯状细胞,黏液分泌少;哮喘组小鼠染色后气道组织中出现大量杯状细胞,管腔狭窄,黏液分泌增多,黏液物质相对着色面积较正常组升高(P<0.01);AMD3100 组气道上皮杯状细胞和黏液物质相对着色面积较哮喘组降低(P<0.01)。见表2、图2。
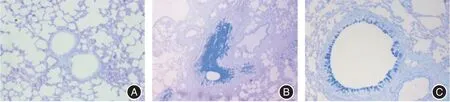
图2 各组小鼠肺组织AB-PAS 染色Fig.2 AB-PAS staining of lung tissue in each group of mice
表2 各组小鼠气道上皮AB-PAS 的变化Tab.2 AB-PAS staining of lung in airway epithelium of mice in each group ±s

表2 各组小鼠气道上皮AB-PAS 的变化Tab.2 AB-PAS staining of lung in airway epithelium of mice in each group ±s
注:*表示与正常组比较,P <0.01;#表示与哮喘组比较,P <0.01
组别正常组哮喘组AMD3100 组气道组织黏液物质阳性相对着色面积(%)2.31±0.62 32.14±2.13*22.81±2.05*#
2.4 各组小鼠BALF 中炎症因子水平比较 AMD 3100 组小鼠BALF 中IL-4、IL-5、CXCR4 水平较哮喘组降低,但仍然高于正常组(P<0.01),见表3。
表3 各组小鼠BALF 的CXCR4、IL-4、IL-5 的含量变化Tab.3 The contents of CXCR4,IL-4 and IL-5 in BALF of each group were changed ±s
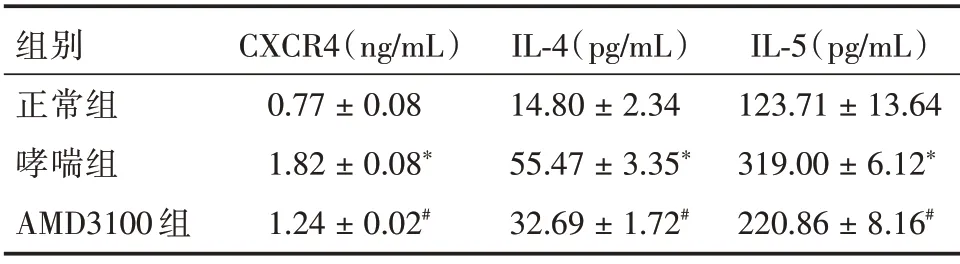
表3 各组小鼠BALF 的CXCR4、IL-4、IL-5 的含量变化Tab.3 The contents of CXCR4,IL-4 and IL-5 in BALF of each group were changed ±s
注:*表示与正常组比较,P <0.01;#表示与哮喘组比较,P <0.01
组别正常组哮喘组AMD3100 组CXCR4(ng/mL)0.77±0.08 1.82±0.08*1.24±0.02#IL-4(pg/mL)14.80±2.34 55.47±3.35*32.69±1.72#IL-5(pg/mL)123.71±13.64 319.00±6.12*220.86±8.16#
2.5 各组小鼠肺组织MUC5ac 蛋白、CXCR4 蛋白和CXCR4mRNA含量比较 IHC染色显示MUC5ac蛋白阳性表达主要在气道上皮杯状细胞及管腔内;AMD3100 组小鼠肺组织MUC5ac 蛋白、CXCR4蛋白和CXCR4mRNA 含量较哮喘组降低,但仍高于正常组(P<0.01)。见表4、5 和图3、4。
表4 各组小鼠肺组织MUC5ac、CXCR4 蛋白水平Tab.4 Protein levels MUC5ac and CXCR4 in kung tissue of mice in each group ±s
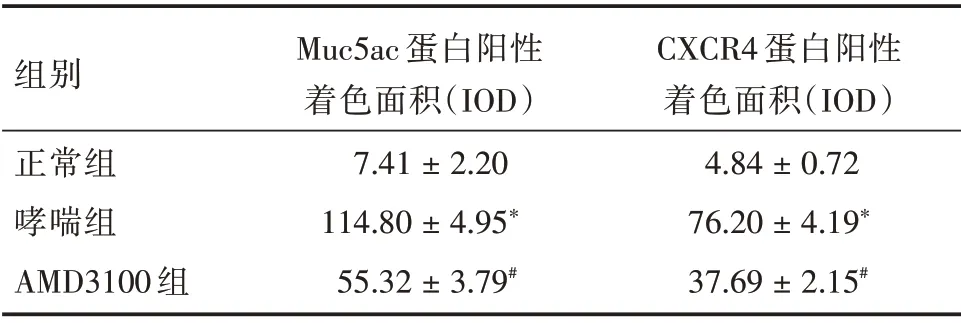
表4 各组小鼠肺组织MUC5ac、CXCR4 蛋白水平Tab.4 Protein levels MUC5ac and CXCR4 in kung tissue of mice in each group ±s
注:*表示与正常组比较,P <0.01;#表示与哮喘组比较,P <0.01
组别正常组哮喘组AMD3100 组Muc5ac 蛋白阳性着色面积(IOD)7.41±2.20 114.80±4.95*55.32±3.79#CXCR4 蛋白阳性着色面积(IOD)4.84±0.72 76.20±4.19*37.69±2.15#
表5 各组小鼠肺组织CXCR4 mRNA 相对表达量Tab.5 The relative expression of XCXR4 mRNA in lung tissue of mice in each group ±s

表5 各组小鼠肺组织CXCR4 mRNA 相对表达量Tab.5 The relative expression of XCXR4 mRNA in lung tissue of mice in each group ±s
注:*表示与正常组比较,P <0.01;#表示与哮喘组比较,P <0.01
组别正常组哮喘组AMD3100 组CXCR4(ΔCT)0.386±0.022 1.530±0.060*1.061±0.027#

图3 各组小鼠肺组织MAU5ac 表达Fig.3 MAU5ac Expression in lung tissue in each group mice

图4 各组小鼠肺组织CXCR4 表达Fig.4 CXCR4 expression in lung tissue in each group of mice
3 讨论
哮喘是一种以反复发作性喘息、咳嗽、气促及胸闷为主要临床表现,肺组织病理学变化为发生、发展的病理学基础[11]的一种慢性气道炎症疾病。小鼠的哮喘症状以烦躁不安、呼吸急促、抓耳挠腮、弓背直立、腹肌收缩等异常行为为主[12]。本课题组既往以OVA 腹腔注射致敏改进为腹腔注射联合多个部位皮下注射OVA 致敏后激发制备哮喘模型;小鼠临床表现为呼吸急促、焦躁不安、弓背直立、抓耳挠腮、二便失禁等。在OVA 激发前给予小鼠AMD3100 腹腔注射,可观察到哮喘小鼠焦躁不安、呼吸急促等临床症状减轻。肺组织病理学结果显示,AMD3100 组小鼠支气管周围炎症病理评分较哮喘组降低,炎症细胞浸润减轻,杯状细胞增殖及气道分泌物减少,但仍高于正常组。提示AMD3100 干预可改善哮喘BALB/c 小鼠的临床症状及肺组织病理学情况。哮喘的发病机制尚未完全阐明,多种细胞及细胞组分共同参与及相互作用形成气道炎症仍是其主要机制之一,其中,T 淋巴细胞和嗜酸性粒细胞(eosinophilegranulocyte,EOS)在气道炎症的发生发展过程中发挥重要作用。正常情况下,Th1/Th2 免疫应答处于平衡状态,当发生免疫应答失衡如以Th2 型辅助T 细胞发挥作用时,会导致哮喘患者炎症因子IL-4、IL-5等细胞因子的过度产生[13-14]。IL-4 主要参与机体免疫应答,可引起EOS 激活、黏液分泌、IgE 表型转变等而诱发超敏反应[15];且可直接作用于气道上皮细胞,诱导黏液蛋白基因表达[16]。IL-5 作为哮喘发作的一个关键细胞因子,通过依赖和非依赖途径共同作用,不仅能调节EOS 的增殖、分化,同时可在IL-13 的参与下诱导EOS 向肺部聚集及对气道上皮起作用[17]。研究发现变应原刺激哮喘患者后出现IL-5 水平升高及EOS 大量浸润,同时吸入重组人IL-5 后,可发生气道高反应及痰EOS 细胞增加,证实IL-5 在哮喘发病中发挥重要作用,可作为反映哮喘发作的重要指标。本实验发现哮喘组小鼠BALF 中IL-4、IL-5 水平均高于正常组,说明两个细胞因子在哮喘急性发作中均发挥一定的作用。气道黏液高分泌现已成为如慢阻肺、哮喘、肺囊性纤维化发病过程中主要临床特征之一,不仅是一种“临床症状”,更是一种高危因素,炎症刺激下气道上皮细胞可引起黏液大量分泌,细菌滋生,加重气流受限及气道阻塞,炎症反复,形成恶性循环[3],成为了慢性气道炎症性疾病的高危发病因素、加速疾病进展的重要组成部分及影响患者预后的制约因素,MUC5ac 是气道黏液的主要组成部分,是杯状细胞增生及高分泌的标志。本实验证实哮喘组小鼠肺组织中MUC5ac 表达水平显著高于正常组,与既往研究一致,表明小鼠肺组织中MUC5ac 表达水平上调在气道黏液高分泌中发挥重要作用。CXCR4是一种G 蛋白偶联受体,也属于CXC 趋化因子家族,参与造血和免疫系统的归巢和趋化。SDF-1 是CXCR4 的配体,与CXCR4 结合启动不同了的信号传导途径,可引起多种反应,如细胞存活、增殖、细胞内钙增加和基因转录等。CXCR4 已与HIV感染、癌症、肺动脉高压和肺损伤[18]等多种疾病相关。莫碧文等[19]研究表明CXCR4 可能在哮喘气道炎症和气道重塑中起作用。CHEN 等[20]研究指出CXCR4 可能通过Th17 细胞通路在哮喘气道炎症及气道高反应性中发挥作用。已有研究证实支气管哮喘患儿外周血SDF-1、CXCR4 水平显著高于对照组[21]。本实验中AMD3100 组BALF 中CXCR4 含量减少、肺组织中CXCR4 蛋白水平及CXCR4 的mRNA 相对表达量较哮喘组显著降低,说明AMD3100 可以阻滞CXCR4。哮喘组BALF 中CXCR4 含量、肺组织中CXCR4 蛋白水平及CXCR4的mRNA 相对表达量较正常组明显升高,可以说明CXCR4 表达增高与哮喘气道炎症、气道重塑相关,而气道黏液高分泌和气道炎症、气道重塑密切相关,因此有理由相信CXCR4 是哮喘气道炎症、气道重塑及气道黏液高分泌发病机制的重要因子。
AMD3100 是CXCR4 拮抗剂,通过抑制SDF-1/CXCR4 轴而发挥作用。在小鼠模型上,通过减少嗜酸性粒细胞及免疫细胞向气道聚集,随后减少炎性细胞因子的释放而控制哮喘气道炎症[22]。本实验通过AMD3100 干预哮喘小鼠后IL-4、IL-5、CXCR4、肺组织HE 染色气道周围炎症细胞浸润评分较哮喘组明显减低,可以说明AMD3100 可减轻哮喘气道炎症及气道重塑;HIROYUKI 等[23]研究发现CXCR4 在嗜酸性粒细胞浸润性肺疾病BALF中表达明显增高,通过抗体阻断CXCR4 时嗜酸性粒细胞向炎症部位转移则减弱。滕捷明等[24]研究表明CXCR4 蛋白在支气管上皮细胞表面表达受IL-4 的调控,当Th2 细胞因子IL-4 的表达下降时,细胞表面CXCR4 表达减少影响嗜酸性粒细胞向炎症部位的迁移及在炎症部位的分布,减轻气道炎症反应。该实验中,AMD3100组BALF中CXCR4含量减少、肺组织中CXCR4 蛋白水平及CXCR4 的mRNA 相对表达量较哮喘组显著降低,AMD3100干预可减轻哮喘小鼠气道炎症、气道重塑及气道MUC5ac 分泌。
综上所述,AMD3100 干预可降低CXCR4 蛋白的表达,抑制哮喘小鼠气道炎症反应,通过下调气道黏蛋白MUC5ac 的表达水平,减轻气道黏液高分泌。
