水稻种子携带稻瘟病菌LAMP检测方法的建立与应用
2022-06-07陈星MAZNANNurAtiqahBinti李志强胡茂林岳鑫璐李健强罗来鑫
陈星 MAZNAN Nur Atiqah Binti 李志强 胡茂林 岳鑫璐 李健强 罗来鑫

摘要 稻瘟病菌Magnaporthe oryzae可通过种子带菌实现远距离传播,导致病害发生并造成严重经济损失。建立灵敏高效且便于操作的水稻种子携带稻瘟病菌的检测方法,是确保种子健康和控制病害发生的先决条件。本研究选取稻瘟病菌的3-磷酸甘油酰基转移酶基因MoSPC3设计合成3对特异性引物,并对反应体系进行优化,建立了环介导等温扩增(loop-mediated isothermal amplification, LAMP)方法。该方法可特异性地检测稻瘟病菌,对稻瘟病菌DNA样品的检测灵敏度可达到0.24拷贝/μL,远高于普通PCR的检测灵敏度。将该方法用于从中国和马来西亚不同水稻种植区收集的92份水稻种子样品携带稻瘟病菌的检测,结果显示,LAMP方法共检测到89份阳性样品,而普通PCR仅显示有2份样品为阳性。综上,本研究建立了一种适用于水稻种子携带稻瘟病菌的LAMP檢测方法,具有简便快捷、灵敏度高等特点,丰富了稻瘟病菌的检测体系,可用于大批量水稻种子样品的健康检测。
关键词 稻瘟病菌;环介导等温扩增;灵敏度;特异性;种子健康
中图分类号: S435.111.41
文献标识码: A
DOI: 10.16688/j.zwbh.2021212
Abstract The fungus Magnaporthe oryzae, as the causal agent of rice blast disease, can be transmitted by rice seeds for a long distance and caused serious economic losses in rice production. To establish a sensitive, effective and convenient method for detection of M.oryzae from seeds is a precondition for rice seed health and control of rice blast disease. In this study, three primer pairs were designed based on glycerol-3-phosphate acyltransferase gene (MoSPC3) sequence of M.oryzae, and the loop-mediated isothermal amplification (LAMP) reaction system was developed. The results showed that the LAMP method was specific for detection of M.oryzae, and the sensitivity was about 0.24 copies/μL DNA, which was much more sensitive than PCR method. A total of 92 rice seed samples collected from different production areas of China and Malaysia were examined by the LAMP detection system. The results showed that 89 samples were M.oryzae positive by LAMP detection, while only two samples were detected positive by ordinary PCR. In conclusion, a LAMP system for detection of M.oryzae from rice seeds was developed, which was more convenient and more sensitive than ordinary PCR. It broadened the detection strategies for M.oryzae and could be applied for large-scale seeds health test.
Key words Magnaporthe oryzae;loop-mediated isothermal amplification;sensitivity;specificity;seed health
水稻Oryza sativa是世界上重要的粮食作物之一,是全球约半数人口的主食[1]。稻瘟病(rice blast disease)是世界性的真菌病害,也是水稻生产中最具毁灭性的病害之一,在全球水稻种植区普遍发生,可造成水稻产量损失10%~30%,严重威胁着水稻生产和粮食安全[2]。
稻瘟病的病原菌有性态为子囊菌稻间座壳菌Magnaporthe oryzae,无性态为稻梨孢菌Pyricularia oryzae [3]。稻瘟菌在水稻生长的各个阶段均可侵染发病,危害叶片、茎秆、穗颈、籽粒等部位。穗部发病严重时,可造成白穗或粒瘪,严重影响水稻产量[4]。稻瘟菌可以通过孢子或菌丝等形式随种子远距离传播,成为田间病害的初侵染来源。在合适的温度和湿度条件下,稻瘟菌分生孢子萌发形成芽管,芽管延伸形成附着胞,附着胞产生巨大膨压形成侵染钉侵染宿主细胞,菌丝随后沿着胞间连丝向周围细胞扩展,造成稻瘟病的扩散蔓延[5-7]。稻瘟菌不仅侵染水稻,还可侵染小麦和大麦等禾本科作物[8]。
目前我国关于稻瘟病的防治,主要是以选育抗病品种为主,不同的抗病品种对稻瘟病的抗性有巨大的差异,但由于稻瘟菌生理小种较多,田间病菌变异性强,新培育的水稻抗病品种在种植几年后会出现抗性降低或丧失的情况[9-10]。对稻瘟病的化学防治主要是采用多菌灵、三环唑等内吸性药剂进行防治,但这类药剂残效期较长,会造成严重的环境污染[4]。因此,对水稻种子进行健康检测并使用无病菌的种子,是稻瘟病综合防控中的重要环节。对稻瘟病菌的检测主要包括传统的培养法、血清学检测、PCR方法等,但这些方法多耗时较多或操作较为复杂,在种子带菌检测中需要建立一种快速灵敏、可满足大量样品检测的方法[11]。B96C7615-2BEB-4A0D-B320-767E4BD38D00
环介导等温扩增技术(loop-mediated isothermal amplification,简称LAMP)是2000年研发的一种DNA扩增技术[12]。该方法主要是依赖于嗜热脂肪芽胞杆菌Bacillus stearothermophilus产生的Bst DNA聚合酶的链置换反应活性,在扩增过程中,将外引物合成的链在内引物引导作用下置换下来,使反应能够在恒温条件下短时间大量扩增靶标片段DNA,而省略了常规PCR反应中的变性和退火阶段,具有扩增效率高、灵敏度高且易于操作等优点[13]。LAMP方法目前不仅被广泛应用于医学领域,还应用于食品工业、环境样品检测等[12]。在农业领域,LAMP方法被广泛用于多种植物病原菌的检测,如禾谷镰刀菌Fusarium graminearum、梨火疫病菌Erwinia amylovora、柑橘溃疡病菌Xanthomonas citri subsp. citri、番茄细菌性溃疡病菌Clavibacter michiganensis等[13-16],但鲜有使用LAMP方法对稻瘟病菌进行检测的报道。基于此,本研究建立了基于LAMP技术的稻瘟病菌快速检测方法,并将该方法应用于水稻种子携带稻瘟病菌的检测,丰富了现有的检测体系。
1 材料与方法
1.1 供试材料
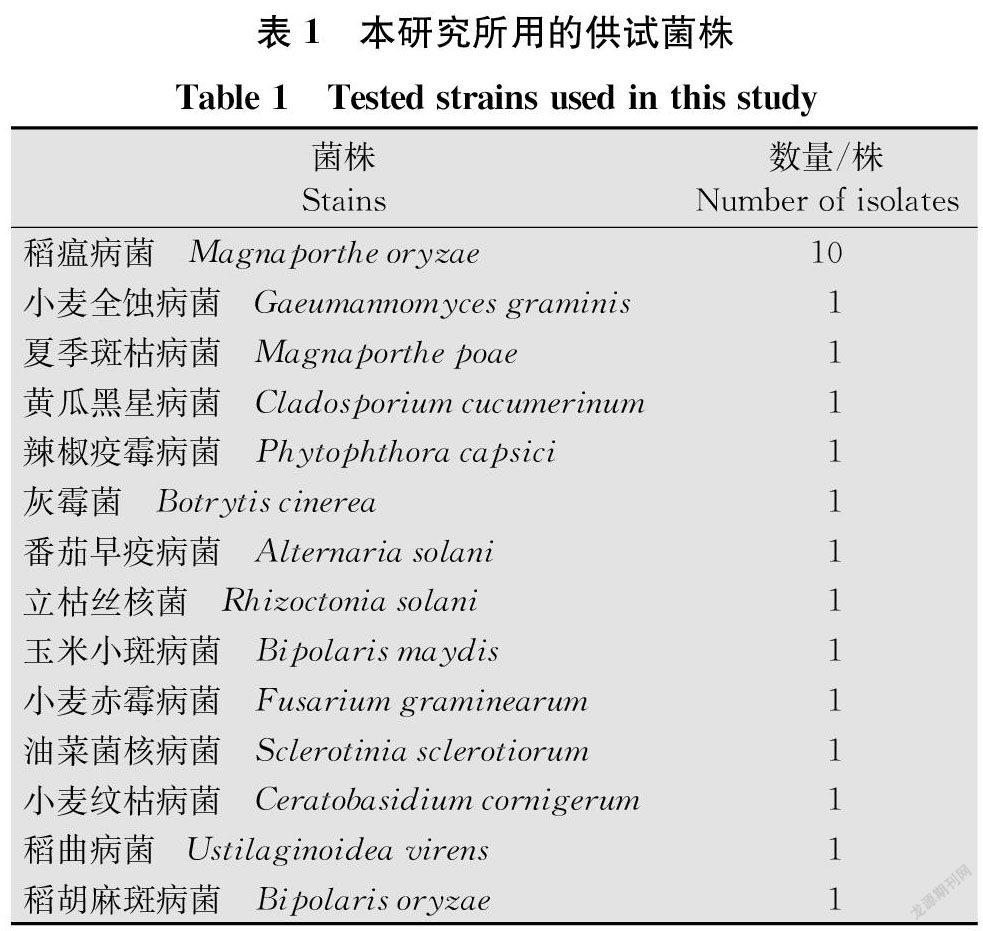
本研究中所用的菌株包括10株稻瘟病菌M.oryzae,主要来自福建、广西、云南等地,另有13株对照菌株(表1)。菌株的活化培养采用PDA培养基(马铃薯200 g/L,葡萄糖18 g/L,琼脂16 g/L)。供试的水稻种子来自我国和马来西亚不同的水稻种植省份,共采集了92个批次水稻种子样品,其中马来西亚水稻种子样品4份。
1.2 真菌DNA的提取及水稻种子样品总DNA的提取
稻瘟病菌在贴有玻璃纸的PDA培养基上培养至菌丝长满培养皿的2/3,刮取菌丝至2.0 mL的离心管中,液氮速冻后于全自动组织研磨仪研磨60 s,使用基因组DNA提取试剂盒(DL-117-01,北京博迈德生物技术有限公司)提取真菌基因组DNA。
每样品称取10 g水稻种子,按1∶4比例加入PBS缓冲液(NaCl 137 mmol/L,KCl 2.7 mmol/L,Na2HPO4·12H2O 10 mmol/L,KH2PO4 2 mmol/L),28℃、200 r/min过夜培养,富集后取1 mL使用上述基因组DNA提取试剂盒进行DNA的提取。
1.3 LAMP引物设计
根据NCBI中报道的稻瘟病菌基因组序列,依靠基因序列比对分析,选取编码3-磷酸甘油酰基转移酶的基因MoSPC3(MGG_08194)使用在线引物设计软件PrimerExplorer V5(http:∥primerexplorer.jp/e/)进行引物设计(表2)。同时,基于该基因序列,使用NCBI中Primer-BLAST设计普通PCR引物作为对照(表2)。
1.4 LAMP反应体系和条件的优化
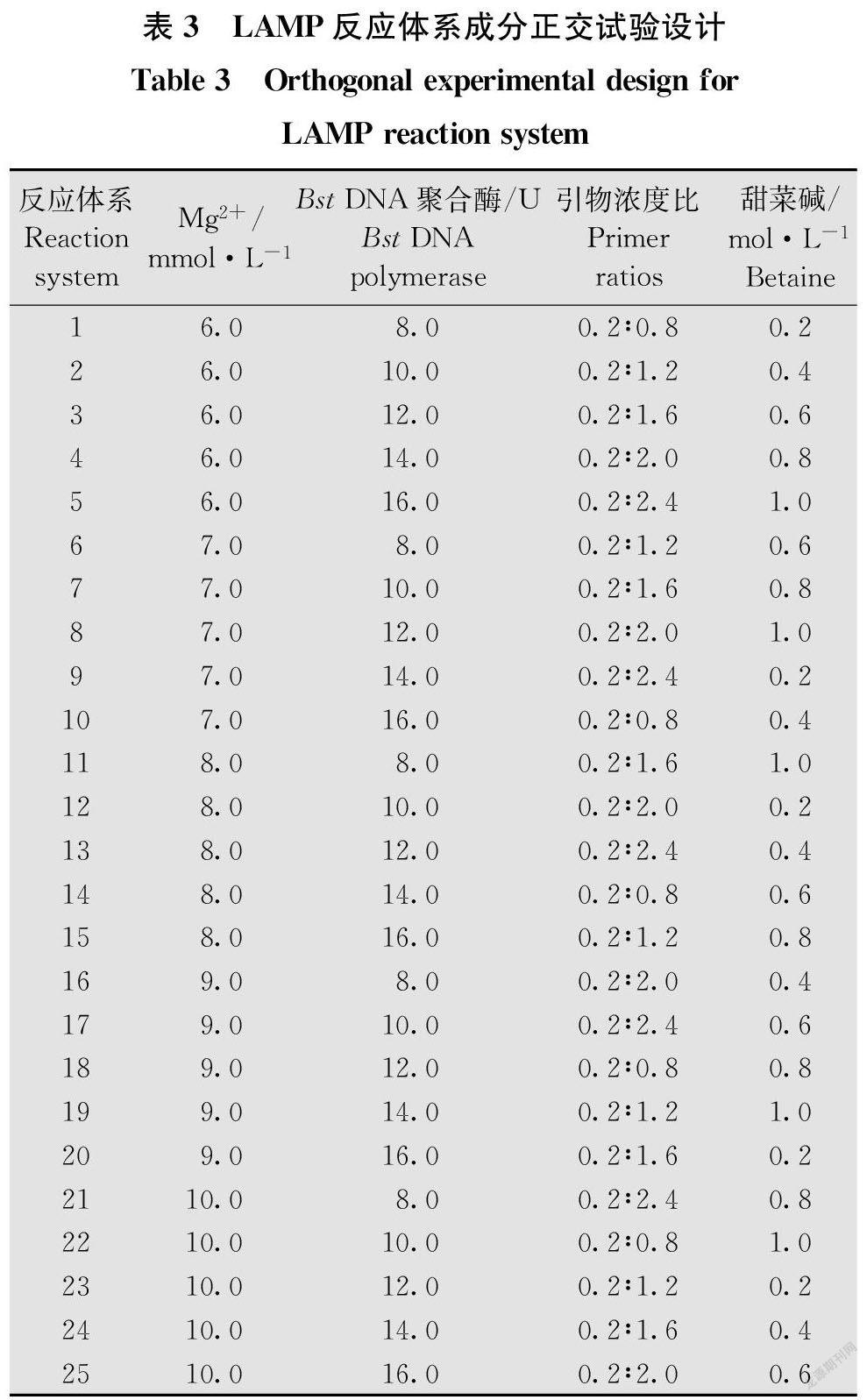
所采用的LAMP反应体系为25 μL。调整LAMP反应体系中各组分的浓度,首先进行单因素条件优化,并进行正交试验设计,按照成分正交表L25(54)设计不同浓度组合的试验(表3),根据琼脂糖凝胶电泳结果条带的亮度和清晰度,选取最优的反应体系。其中Mg2+ 6~10 mmol/L,Bst DNA聚合酶8~16 U,F3/B3∶FIP/BIP引物浓度比0.2∶0.8~0.2∶2.4,甜菜碱0.2~1.0 mol/L,DNA模板1 μL,条件设置为65℃,10~70 min。
1.5 LAMP引物特异性验证和灵敏度测试
利用优化好的反应体系和条件,使用10株分离自不同地区的稻瘟病菌以及13株其他病原真菌,对LAMP引物的反应体系的特异性进行检测,同时使用基于同一基因设计的稻瘟菌特异性引物MoSPC3_FP/MoSPC3_RP进行普通PCR扩增,作为LAMP方法的对照。
对提取的稻瘟病菌基因组DNA,进行10倍梯度稀释,得到10 fg/μL~10 ng/μL的DNA,进行LAMP引物的灵敏度试验,同样以上述普通PCR作为对照。
1.6 LAMP与普通PCR方法在水稻种子样品携带稻瘟病菌检测中的应用
为了验证LAMP方法在应用中的可靠性,对供试的92份水稻种子样品提取总DNA,使用本研究建立的LAMP体系和上述普通PCR方法进行稻瘟病菌的检测,并基于检测结果进行比较分析。
2 结果与分析
2.1 LAMP反应体系的优化
为获得最适的LAMP反应条件,对反应体系进行优化。首先是进行单因素条件优化,结果显示,Mg2+浓度在6.0~10.0 mmol/L范围内时,都有相应的扩增,但在8.0 mmol/L浓度下,条带的亮度更为明显(图1a),因此Mg2+最适浓度为8.0 mmol/L。
当Bst DNA聚合酶浓度为8.0~12.0 U时,随着浓度的升高,LAMP扩增得到的条带亮度逐渐升高,但聚合酶浓度再升高,条带亮度没有明显变化,且条带有弥散,因此Bst DNA聚合酶最适浓度为12.0 U(图1b)。当外引物浓度∶内引物浓度为0.2∶0.8时,条带清晰明亮,而随着内引物浓度的增加,条带成弥散状,因此外引物和内引物的最适浓度比值为0.2∶0.8(图1c)。甜菜碱的浓度为0.6 mol/L时扩增条带亮度明显强于0.4 mol/L,但随着甜菜碱浓度的增加,虽然条带亮度增加,但弥散不清晰,因此甜菜碱的最适浓度为0.6 mol/L(图1d)。
为了得到最优化的LAMP反应体系,考虑到各反应成分之间的互相影响,按照表3组合进行各条件的正交试验,以观察各试剂成分的组合效果。如图2所示,在不同组合条件下,组合5,9,13,17和21条带清晰,并且条带较亮,并且这些组合的引物浓度比均为0.2∶2.4,由此表明引物浓度在LAMP反应体系中发挥较为关键的作用。在组合5,9,13,17和21中,組合21所产生的扩增条带最为清晰,且条带亮度最大,因此,25 μL的LAMP最优反应体系中各组分的含量为:10.0 mmol/L Mg2+,8.0 U的Bst DNA聚合酶,引物浓度比为0.2∶2.4,0.8 mol/L的甜菜碱。B96C7615-2BEB-4A0D-B320-767E4BD38D00
基于优化后的LAMP反应体系,进行反应条件的优化。在65℃,10~70 min的不同反应时间条件下,30~70 min均能扩增得到清晰的条带,且条带亮度没有明显差异(图3)。基于反应时间的最短化,最终选定30 min作为最适反应时间。
2.2 LAMP引物检测稻瘟病菌具有特异性
为了验证LAMP反应引物的特异性,对供试的10株稻瘟病菌菌株和13株对照菌株进行LAMP检测。基于优化好的LAMP反应体系和反应条件,10株稻瘟病菌的检测结果均为阳性,检出率达到100%,而13株对照菌株的检测结果均为阴性,没有出现特异性扩增(图4a)。同时,使用普通PCR进行特异性验证,结果与LAMP结果一致(图4b)。
2.3 LAMP体系检测稻瘟病菌的灵敏度
以提取的稻瘟病菌基因组DNA为模板,LAMP反应能检测到浓度为10 fg/μL(0.24拷贝/μL)的DNA,而普通PCR的检测灵敏度仅为10 ng/μL(2.4×105拷贝/μL),在此条件下,LAMP检测的灵敏度是普通PCR的106倍(图5),明显优于普通PCR。
2.4 LAMP方法与普通PCR在水稻种子样品携带稻瘟病菌检测中的应用
对92批次不同来源的水稻种子样品提取总DNA,分别使用LAMP与普通PCR进行种子携带稻瘟病菌的检测,使用稻瘟病菌基因组DNA作为阳性对照。结果显示,92批次的水稻种子样品中通过普通PCR检测到2批次样品为稻瘟病菌阳性,而LAMP检测到89批次的水稻种子样品为阳性(表4),且普通PCR检出的2个阳性批次在LAMP方法检测中均为阳性。
3 讨论
近年来,环介导等温扩增技术(LAMP)已被广泛应用于微生物病原菌的快速检测,与传统的检测方法相比,其具有较高特异性,能達到快速、高效、简便地检测病原菌的效果。稻瘟病菌作为最具危害性的十大植物病原菌之一,严重威胁着世界上水稻种植区的粮食安全。基于此,本研究建立了一个高效快速检测水稻样品中是否携带稻瘟病菌的LAMP方法,该方法具有反应时间短、操作简单、灵敏度高、不需要PCR仪等昂贵仪器的优点,对稻瘟病菌的检测具有一定的应用价值。
LAMP技术的高灵敏度也容易带来由于污染而造成的假阳性的问题。为避免这一问题,本研究在操作过程中设计不同的试验区,进行空间隔离,即反应体系的配制、琼脂糖凝胶电泳试验操作避免在同一试验区。同时在反应过程中,对各反应管进行封口膜封口,或在体系上方滴加少量的灭菌液体石蜡进行封口,可有效避免气溶胶污染,降低假阳性出现的概率。也有报道指出可在反应体系中添加显色染料代替琼脂糖凝胶电泳,利用不开盖的方式避免污染,包括SYBRGreen I、EvaGreen Dye、钙黄绿素染料等[17]。但上述染料在本研究结果中未能达到理想结果,后续可考虑尝试其他染料。
在LAMP反应体系中,外引物和内引物与靶标基因序列互补,是反应所必需的,而环引物可提高反应效率。基于此,在反应条件优化过程中,保持外引物浓度不变的情况下,优化内引物(FIP/BIP)浓度,结果发现在正交优化试验中,条带亮度较亮且清晰的处理条件均为外引物浓度∶内引物浓度为0.2∶2.4,表明内外引物浓度比在反应过程中发挥了重要作用,但与单因素优化结果不一致,由此表明反应体系中的各成分之间会相互影响。同样的结果也表现在Bst DNA聚合酶的添加浓度上。由于Bst DNA聚合酶与Mg2+相互作用发挥活性,在单因素优化试验中,当Mg2+浓度保持不变,增加Bst DNA聚合酶的浓度,并不能显著提高条带亮度。因此,在对各体系条件进行优化过程中,要进行正交试验,基于正交试验的结果选择合适的浓度,以降低各反应成分之间的交互影响。在LAMP优化的反应体系中,每反应Bst DNA聚合酶的用量达到8 U,其价格昂贵,所以应考虑在确保反应结果稳定的情况下尽可能减少Bst DNA聚合酶的使用量,降低检测成本。牛血清白蛋白(BSA)可提高反应的灵敏度,后续可考虑在确保扩增结果的情况下,添加BSA是否可降低Bst DNA聚合酶的使用量。
为了进一步验证LAMP方法的高灵敏性,我们除了利用MoSPC3基因序列设计引物进行普通PCR验证比较外,同时还用了分别靶向于稻瘟病菌侵染过程的特异性基因mif23、pfh2的两对引物作为普通PCR引物对照[18-19],但其检测灵敏度与检测特异性和基于MoSPC3序列设计的引物无差异,由此说明LAMP方法的灵敏度普遍优于普通PCR。
对于92份水稻种子样品,通过LAMP方法检测到89份样品为阳性,而传统PCR方法仅从来自江西和云南的种子样品中各检测出1份阳性结果,说明LAMP方法相较于普通PCR,具有灵敏度更高的优点,同时也表明了稻瘟病菌在中国和马来西亚水稻种子中携带较为普遍,但多数种子样品携带的菌量较低,因此常规PCR检测呈阴性的样品较多。稻瘟病菌以菌丝体和分生孢子随病残体越冬,成为翌年发病的初侵染源,播种带菌种子也会造成苗瘟和叶瘟,进而影响水稻的产量和品质。因此要做好水稻种子健康检测,而采用灵敏度高的检测方法是十分必要的。
参考文献
[1] YU Jun, HU Songnian, WANF Jun, et al. A draft sequence of the rice genome (Oryza sativa L.ssp. indica) [J]. Science, 2002, 296(5565): 79-92.
[2] FERNANDEZ J, WILSON R A. Cells in cells: morphogenetic and metabolic strategies conditioning rice infection by the blast fungus Magnaporthe oryzae [J]. Protoplasma, 2014, 251(1): 37-47.B96C7615-2BEB-4A0D-B320-767E4BD38D00
[3] EBBOLE D J. Magnaporthe as a model for understanding host-pathogen interactions [J]. Annual Review of Phytopathology, 2007, 45(1): 437-456.
[4] 刘国权, 孟昭河, 任艳军, 等. 水稻抗稻瘟病研究进展与对策[J]. 中国农学通报, 2004, 20(1): 211-214.
[5] HAMER J E, HOWARD R J, CHUMLEY F G, et al. A mechanism for surface attachment in spores of a plant pathogenic fungus [J]. Science, 1988, 239(4837): 288-290.
[6] FOSTER A J, RYDER L S, KERSHAW M J, et al. The role of glycerol in the pathogenic lifestyle of the rice blast fungus Magnaporthe oryzae [J]. Environmental Microbiology, 2017, 19(3): 1008-1016.
[7] TALBOT N J. On the trail of a cereal killer: Exploring the biology of Magnaporthe grisea [J]. Annual Review of Microbiology, 2003, 57: 177-202.
[8] WILSON B A, TALBOT N J. Under pressure: investigating the biology of plant infection by Magnaporthe orycae [J]. Nafure Review of Microbiology, 2009, 7: 185-195.
[9] JIA Y, BRYAN G T, FARRALL L, et al. Natural variation at the Pi-ta rice blast resistance locus [J]. Phytopathology, 2003, 93(11): 1452-1459.
[10]徐鑫, 姜伟高, 梁华兵, 等. 稻瘟病抗性基因Pita2的克隆及其介导的防御相关基因表达分析[J]. 中南民族大学学报(自然科学版), 2021, 40(1): 26-31.
[11]SUN Geng, LIU Jinliang, LI Guihua, et al. Quick and accurate detection and quantification of Magnaporthe oryzae in rice using real-time quantitative polymerase chain reaction [J]. Plant Disease, 2015, 99(2): 219-224.
[12]NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediated isothermal amplification of DNA [J/OL]. Nucleic Acids Research, 2000, 28(12): e63. DOI:10.1093/nar/28.12.e63.
[13]吕青阳, 蒋娜, 韩思宁, 等. 基于致病基因序列的LAMP方法检测番茄种子携带的溃疡病菌[J]. 植物病理学报, 2017, 47(5): 630-637.
[14]NIESSEN L, VOGEL R F. Detection of Fusarium graminearum DNA using a loop-mediated isothermal amplification (LAMP) assay [J]. International Journal of Food Microbiology, 2010, 140(2/3): 183-191.
[15]MORADI A, NASIRI J, ABDOLLAHI H, et al. Development and evaluation of a loop-mediated isothermal amplification assay for detection of Erwinia amylovora based on chromosomal DNA [J]. European Journal of Plant Pathology, 2012, 133(3): 609-620.
[16]RIGANO L A, MARANO M R, CASTAGNARO A P, et al. Rapid and sensitive detection of citrus bacterial canker by loop-mediated isothermal amplification combined with simple visual evaluation methods [J/OL]. BMC Microbiology, 2010, 10: 176. DOI: 10.1186/1471-2180/10-176.
[17]XIONG Qin, ZHANG Linlin, ZHENG Xinyue, et al. Rapid and specific detection of the poplar black spot disease caused by Marssonina brunnea using loop-mediated isothermal amplification assay [J/OL]. Plants (Basel), 2021, 10(2), 253. DOI: 10.3390/plants10020253.
[18]CHADHA S, GOPALAKRISHNA T. Detection of Magnaporthe grisea in infested rice seeds using polymerase chain reaction [J]. Journal of Applied Microbiology, 2006, 100(5): 1147-1153.
[19]HARMON P F, DUNKLE L D, LATIN R. A rapid PCR-based method for the detection of Magnaporthe oryzae from infected perennial ryegrass [J]. Plant Disease, 2003, 87(9): 1072-1076.
(責任编辑:田 喆)B96C7615-2BEB-4A0D-B320-767E4BD38D00
