可溶性大豆多糖与果胶对酸化乳饮料的稳定机制对比
2022-06-06何志勇王召君曾茂茂
田 浩,何志勇,王召君,秦 昉,曾茂茂,陈 洁
(食品科学与技术国家重点实验室,江南大学,江苏 无锡214122)
酸性乳饮料是以鲜乳或复原乳为原料,添加白砂糖、甜味剂、香精等,经乳酸发酵或直接添加食品酸调配,最终pH在3.8~4.6的含乳蛋白饮料[1-2]。酸性乳饮料按照其加工方式可分为调配型酸性乳饮料和发酵型酸性乳饮料[3]。近年来,酸性乳饮料由于其独特的风味、口感和丰富的营养受到广大消费者的喜爱[4-5]。牛乳蛋白由酪蛋白(质量分数80%)和乳清蛋白(质量分数20%)组成,具有极高的营养价值,但酸性条件下乳蛋白沉淀和乳清析出问题始终是这类饮料新产品开发的挑战[6]。工业上常通过添加稳定剂提高酸性乳饮料的稳定性,目前可用于酸性条件下稳定蛋白质的稳定剂主要有果胶、羧甲基纤维素钠、SSPS和藻酸丙二醇等[7-8]。
近年来,SSPS由于其黏度低、溶解性好、口感清爽而逐渐受到重视。SSPS是一种从豆渣中提取的阴离子多糖,结构与果胶类似[8-9],主链由聚鼠李糖半乳糖醛酸和聚半乳糖醛酸组成,中性糖侧链由阿拉伯糖和半乳糖侧链组成[10-11]。与果胶相比,SSPS的主链较短、侧链较长,结构近似于球状[12-13]。果胶在酸性条件下稳定乳蛋白的机制非常清晰,即果胶主要基于3种能力使其能够长期稳定乳蛋白:静电排斥、空间位阻以及游离果胶提升溶液黏度并形成弱凝胶体系[14-16]。迄今为止,SSPS稳定酸性乳饮料的机制研究相对很少。一般认为,SSPS稳定酸性乳饮料的机制可能是通过静电作用吸附在蛋白质表面形成复合物,通过中性糖侧链的空间位阻稳定蛋白质[17-18]。
为此,以脱脂乳为主要原料的调酸型和发酵型两类常见的不同加工体系为研究对象,通过LUMiSizer不稳定指数、SEC-HPLC复合物形成量、粒径、ζ电位及贮藏稳定性等指标,对比研究SSPS与果胶对于酸化脱脂乳的稳定机制,并将2种稳定剂对于酪蛋白和乳清蛋白这2种脱脂乳中主要成分的稳定效应进行对照,以期阐明SSPS的稳定机制,为推进SSPS的应用提供基础。
1 材料与方法
1.1 材料与试剂
SSPS:河南平顶山金晶生物科技有限公司产品;果胶:美国嘉吉公司产品;脱脂乳粉(蛋白质质量分数32%)、酪蛋白(蛋白质质量分数80%)、乳清浓缩蛋白(蛋白质质量分数80%):新西兰恒天然集团产品。
1.2 仪器与设备
Nano-ZS激光粒度分析仪:英国马尔文仪器有限公司产品;LUMiSizer稳定性分析仪:德国LUMi公司产品;Waters 2695液相系统、Waters 2487紫外检测器:美国Waters公司产品;Protein KW-804(7 μm,1.5×10-7mÅ,8.0 mm×300 mm)尺寸排阻色谱柱:日本SHODEX株式会社产品。
1.3 实验方法
1.3.1 样品制备 直接酸化的脱脂乳或者乳蛋白样品制备:准确称取一定量的脱脂乳粉、酪蛋白、乳清浓缩蛋白和去离子水,在室温下搅拌并维持pH 7.0至其充分溶解,溶液蛋白质质量浓度为20 g/L。准确称取一定量的稳定剂(SSPS、果胶),溶解于70℃的去离子水中,于磁力搅拌器上搅拌至完全溶解。待两者均冷却至室温后混合搅拌,使用质量分数30%的柠檬酸溶液调节体系至pH 4.0。最终酸化后的样品中的蛋白质为10 g/L,果胶或SSPS的最终质量浓度为2~6 g/L。
发酵酸化的脱脂乳或乳蛋白样品的制备:分别准确称取一定量的脱脂乳粉、酪蛋白、乳清浓缩蛋白和去离子水,在室温下搅拌并维持pH 7.0至其充分溶解,溶液蛋白质为40 g/L。将样品溶液在65℃杀菌30 min,冷却至42℃,添加发酵菌种(丹尼克斯505型)至0.05 g/L,42℃恒温发酵5 h得到发酵乳基。准确称取一定量的稳定剂(SSPS、果胶),溶解于70℃的去离子水中,于磁力搅拌器上搅拌至完全溶解。将发酵乳基在20 MPa下均质一次,并与稳定剂溶液混合搅拌,使用质量分数30%的柠檬酸溶液调节体系至pH 4.0。最终发酵样品中的蛋白质为10 g/L,果胶或SSPS的最终质量浓度为2~6 g/L。
1.3.2 LUMiSizer稳定性测定 通过LUMiSizer预测酸性乳清蛋白饮料的长期稳定性。参照Cai等[21]的检测方法并稍做修改:4 000 r/min离心,轮廓线560张,截图时间间隔为15 s,光因子1.0,测试温度25℃,测试光源470 nm,测试时间为140 min。
在明确微课在教学中的优势后,需要加深对现阶段微课教学产生的问题的理论探究,从而更好地解决微课发展中产生的问题,使微课更加有效地应用于日常教学。
1.3.3 复合物形成量测定 通过SEC-HPLC测定复合物形成量[23],检测条件:检测波长220 nm,Protein KW-804尺寸排阻色谱柱,以含有0.1 mol/L氯化钠的0.05 mol/L磷酸缓冲液(pH 4.0)为流动相,1 mL/min的流量等度洗脱,通过复合物在220 nm的紫外吸收信号峰面积表示其形成量。
1.3.4 平均粒径、ζ电位测定 参考文献[24]的方法,使用Nano-ZS激光粒度分析仪测定蛋白质溶液的平均粒径。为避免多种光散射,采用pH 4.0的0.02 mol/L柠檬酸盐缓冲液对蛋白质溶液进行体积比为1∶10的稀释。测定参数:样品折射率为1.590,水的折光率为1.330,测试温度为25℃。
1.3.5 贮藏稳定性 将制备的样品于4℃贮藏14 d后拍照观察。
1.3.6 统计分析 每组实验至少重复3次,结果通过平均值和标准偏差进行评估。数据统计分析采用SPSS 2.0软件在P<0.05水平上进行显著性分析。
2 结果与讨论
2.1 LUMiSizer不稳定指数对比
LUMiSizer稳定性分析仪是依据朗伯特-比尔定律和Stoke’s定律,通过离心加速技术评估产品稳定性的一种仪器。该仪器是通过低转速长时间离心来模拟自然条件下多糖与蛋白质复合物的聚集情况,缩短了测试时间,提高了研究效率。澄清指数是指离心结束后样品对光的透过量占原始透光量的百分比。澄清指数越高,表明样品离心后透光量较初始状态变化越大,样品的稳定性越差[25]。直接酸化和发酵酸化体系中不同乳蛋白的LUMiSizer不稳定指数见图1。
乳清蛋白样品发酵酸化体系的稳定性低于直接酸化体系,见图1(a)。在添加量为2 g/L时,果胶稳定乳清蛋白的能力远不如SSPS;但当稳定剂质量浓度提高到4 g/L或者6 g/L时,果胶的稳定能力大幅度提高,其中直接酸化乳的不稳定指数可以降低到0.27;而SSPS的稳定效应尽管也比2 g/L时提升了,但最终稳定效应不如果胶,不稳定指数仅为0.75。
酪蛋白样品发酵酸化体系的稳定性也低于直接酸化体系,但差异远小于脱脂乳蛋白和乳清蛋白,见图1(b)。在添加量为2 g/L时,SSPS和果胶的稳定效果均很差;随着质量浓度提高到4 g/L或者6 g/L,果胶的稳定效应提升能力也大于SSPS。
从图1(c)可以看出,脱脂乳蛋白样品发酵酸化体系的稳定性普遍低于直接酸化体系。对比果胶和SSPS稳定效应可以看出,对于10 g/L乳蛋白饮料体系,无论是发酵酸化乳还是直接调酸的酸化乳,在添加量为2 g/L时,SSPS和果胶稳定效果均很差。2种稳定剂对直接酸化乳蛋白样品的稳定性均随着稳定剂添加量的提高而提高,其中果胶的稳定效应大于SSPS;而对于发酵酸化乳蛋白样品,两者的效果均不显著。
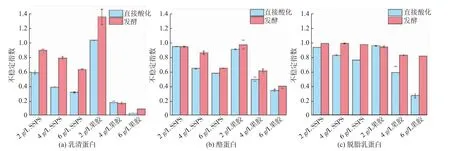
图1 直接酸化和发酵酸化体系中乳蛋白的LUMiSizer不稳定指数Fig.1 LUMiSizer instability index of milk proteins in formulated and fermented acidified systems
进一步对比乳清蛋白、酪蛋白和脱脂乳蛋白的差异可以看出,果胶和SSPS对于酸化脱脂乳蛋白的稳定效应要远低于酸化酪蛋白和酸化乳清蛋白。文献显示,酪蛋白胶束平均粒径为120 nm,在50~600 nm波动[26];而乳清蛋白一般粒径为60 nm[27]。该结果表明,蛋白质酸化时的聚集体粒径可能会影响多糖的稳定效果。
值得注意的是,6 g/L的果胶对于直接酸化脱脂乳蛋白与发酵酸化脱脂乳蛋白的稳定性差异巨大。发酵酸化乳的制作过程是酸化后再加多糖,而直接酸化乳制作时是加多糖后直接酸化,这种制作程序上的差异,会导致在多糖与蛋白质结合时,蛋白质聚集体在溶液中的尺寸不同。一般而言,发酵酸化的蛋白质尺寸要远远大于直接酸化的。该结果表明,多糖对于酸化乳蛋白的稳定能力可能与多糖和蛋白质的结合能力以及多糖-蛋白质结合物或者蛋白质聚集体本身在溶液中的稳定性有关。
2.2 复合物形成量对比
为了探究果胶和SSPS两种多糖与乳蛋白在酸性条件下的结合能力,对乳清蛋白、酪蛋白和脱脂乳蛋白分别在直接酸化和发酵酸化体系中和两种多糖产生的复合物进行定量研究。Zhao等研究显示,基于静电吸附的多糖-蛋白质复合物可以采用SEC-HPLC进行定量检测[23]。因此,通过SEC-HPLC测定复合物形成量,以直观表示2种多糖与3种乳蛋白在不同酸化模式下的复合物形成量,结果见图2。
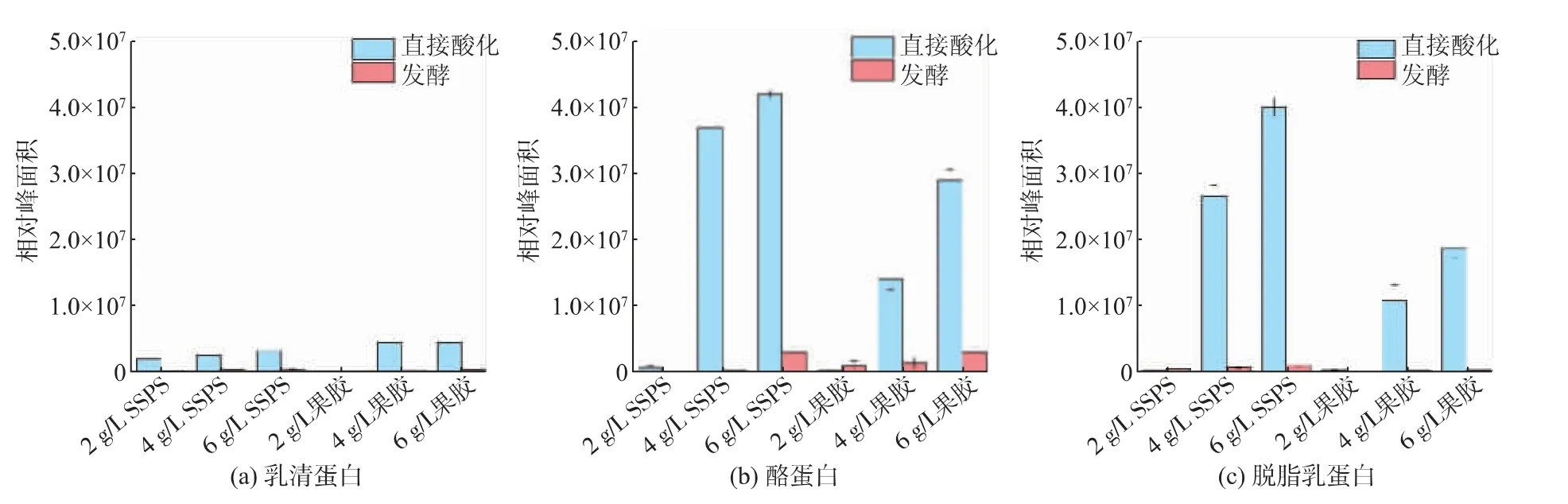
图2 直接酸化和发酵酸化体系中乳蛋白的复合物形成量Fig.2 Milk proteins complex content in formulated and fermented acidified systems
对于脱脂乳蛋白体系,2 g/L的果胶和SSPS均难以与酸化脱脂乳蛋白有效形成复合物;随着多糖质量浓度的提升,SSPS和果胶与直接酸化体系中的脱脂乳蛋白形成的复合物增加,且SSPS形成的复合物数量远高于果胶。但2种多糖均难以与发酵酸化脱脂乳蛋白形成有效复合物。酪蛋白体系与脱脂乳蛋白的结果很类似。
但对于乳清蛋白体系,结果则完全不同。尽管乳清蛋白与2种多糖形成的复合物比脱脂乳蛋白以及酪蛋白要少得多,但对比两种多糖可以发现:2 g/L的SSPS也可以与直接酸化的乳清蛋白形成较多复合物,且随着质量浓度的增加,SSPS与乳清蛋白复合物形成量增加;而2 g/L的果胶则几乎不与直接酸化的乳清蛋白形成复合物,但4 g/L和6 g/L的果胶与乳清蛋白复合物形成量比SSPS与乳清蛋白复合物形成量要多。
果胶或者SSPS与各种乳蛋白形成复合物的能力与LUMiSizer稳定性分析仪测定不稳定指数的结果并不完全一致。对于直接酸化的乳清蛋白,复合物形成量与LUMiSizer不稳定指数的情况是一致的;而对于直接酸化的酪蛋白和脱脂乳蛋白,SSPS的复合物形成能力均强于果胶,但SSPS的LUMiSizer稳定性均低于果胶。然而对于发酵酸化乳蛋白,尽管复合物形成量不足,LUMiSizer不稳定指数高。总体而言,复合物形成量与LUMiSizer不稳定指数相关性很弱。
上述结果表明,酸性条件下多糖与乳蛋白形成复合物的能力可能仅仅是稳定乳蛋白的必要条件而非充分条件,还有其他因素影响乳蛋白在酸性条件下的稳定性。同时,直接酸化体系和发酵酸化体系的巨大差异以及乳清蛋白、酪蛋白和脱脂乳蛋白3种复合物形成量的不一致也表明,酸化后蛋白质聚集体结构尺寸可能会导致多糖-蛋白质复合物形成量有所差异,并导致LUMiSizer不稳定指数也有差异。
2.3 平均粒径对比
为了探究酸化前后多糖的添加顺序对2类蛋白质体系酸化后的多糖-蛋白质复合物的形成能力以及蛋白质本身的聚集体粒径大小和分布的影响,采用粒径分布仪测定了直接酸化和发酵酸化体系中不同乳蛋白的平均粒径,结果见表1。
可以看出,在直接酸化体系中,无论哪一种蛋白质,其粒径都要远小于发酵酸化体系。
对于SSPS,随着添加量的增加,直接酸化的3种乳蛋白体系的平均粒径都显著下降;而对于发酵酸化乳,随着添加量的增加,SSPS也可以有效降低乳清蛋白和酪蛋白的平均粒径,但难以降低脱脂乳蛋白的平均粒径。该结果部分印证了图1~2的结果,发酵脱脂乳蛋白粒径巨大,这可能是其复合物生成量相对小于其他2种蛋白质,且稳定性也不如其他2种蛋白质的缘故。发酵乳清蛋白粒径比脱脂乳小但比酪蛋白大,其复合物形成量不足,但稳定性比酪蛋白和脱脂乳蛋白好,说明复合物本身稳定性也是影响整个酸化乳体系稳定性的重要因素。
2 g/L的果胶添加量无法有效稳定体系,这与图1~2结果一致,既无法有效形成复合物,稳定性也不佳。4 g/L和6 g/L的果胶添加量,对脱脂乳粒径变化影响很小,但对其稳定性影响很大。果胶黏度比较大,随着添加量的增加,体系黏度显著增加。
表1和图1~2的结果说明,酸化乳蛋白的粒径是影响多糖-复合物形成的要素之一,在复合物有效生成的前提下,体系黏度可能也是影响体系稳定性的重要因素;在复合物无法有效形成的前提下,体系黏度的作用可能更大。
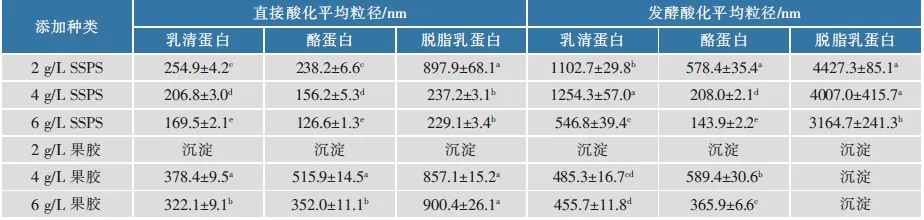
表1 直接酸化与发酵酸化体系中乳蛋白的平均粒径Table 1 Average size of formulated and fermented acidified milk proteins
2.4 电位对比
直接酸化和发酵酸化体系中不同乳蛋白的电位见表2。在直接酸化体系中,添加SSPS的蛋白质溶液电位绝对值较小,而果胶稳定蛋白质溶液的电位绝对值远大于SSPS,这与果胶主链上含有更多的半乳糖醛酸有关。当SSPS作为稳定剂时,由于其所带电荷较少,直接酸化体系与发酵酸化体系中蛋白质溶液的电位并无明显区别。而添加4 g/L和6 g/L果胶时,发酵酸化体系的蛋白质溶液电位比直接酸化体系的更低,这可能是由于发酵后乳蛋白存在大量聚集物,很难与果胶形成有效吸附,此时溶液存在大量游离的果胶,果胶所带的负电荷较多。但发酵后的脱脂乳蛋白在添加2 g/L果胶时,电位为5.12 mV,明显不同于直接酸化时的-11.45 mV,这可能是由于此时溶液中果胶含量较少,因此溶液整体的电位与脱脂乳蛋白自身的电位相似。
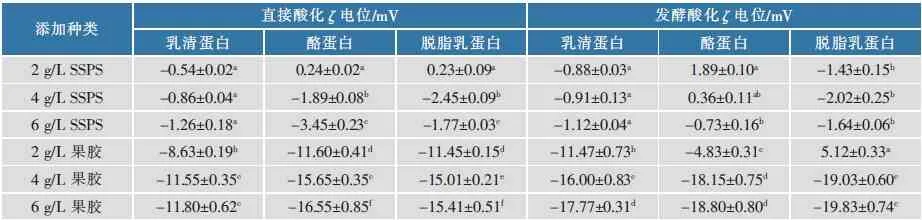
表2直接酸化和发酵酸化体系中乳蛋白的ζ电位Table 2 ζ-zeta potential of formulated and fermented acidified milk proteins
2.5 贮藏稳定性对比
不同乳蛋白在4℃下贮藏14 d后的稳定性结果见图3。2 g/L的SSPS对直接酸化的乳清蛋白具有良好的稳定效果,整体澄清透明。而添加2 g/L果胶的乳清蛋白几乎完全沉淀;4 g/L和6 g/L的果胶对乳清蛋白也具有良好的稳定效果,但整体透明度较低,这可能与果胶与乳清蛋白形成复合物的粒径较大有关。SSPS对发酵酸化的乳清蛋白稳定能力较弱,在3种添加量下均有明显沉淀。但4 g/L和6 g/L的果胶对发酵酸化的乳清蛋白有较好的稳定能力,这可能是由于果胶的高黏度起到了稳定效应。
图3中添加果胶的乳清蛋白贮藏稳定性结果与图1是一致的,这说明果胶要稳定酸性条件下的乳清蛋白,不仅需要有效形成复合物,同时需要复合物有高度稳定性。图3添加SSPS的乳清蛋白的贮藏稳定性结果与图1并不一致,说明在SSPS稳定酸性条件下的乳清蛋白时,离心稳定性不能表征长期存放稳定性,复合物和平均粒径可能对于该种多糖更有意义。

图3 直接酸化和发酵酸化体系中乳蛋白贮藏14 d后稳定性Fig.3 Stability of formulated and fermented acidified milk proteins after 14-day storage
对于直接酸化的酪蛋白,添加2 g/L的SSPS时有少量沉淀生成,添加4 g/L和6 g/L的SSPS时整体澄清透明,具有良好的稳定性。 2 g/L果胶直接酸化酪蛋白时,酪蛋白完全沉淀;添加4 g/L和6 g/L时果胶,酪蛋白整体均一,但透光率较低;发酵酸化的酪蛋白体系结果类似。该结果结合图2结果进一步说明,如果混合体系不能很好地形成复合物,那么未来酸化乳体系的稳定性也欠佳。另外,该结果结合图1说明离心稳定性不能表征长期存放稳定性,可能对于酸化酪蛋白体系而言,复合物和平均粒径更有意义。
对于直接酸化的脱脂乳蛋白,在SSPS作为稳定剂时,3个添加量均呈现均一的体系,无明显沉淀,但透光率比乳清蛋白和酪蛋白低。当添加果胶作为稳定剂时,2 g/L的添加量不能稳定直接酸化的脱脂乳蛋白;当添加4 g/L和6 g/L果胶时,脱脂乳整体均匀,稳定性良好。对于发酵酸化的脱脂乳蛋白,SSPS在各个添加量下均无法有效稳定其体系,而果胶在2 g/L和4 g/L添加量下也无法有效稳定,只有在6 g/L条件下才能有效稳定。上述结果综合图1~2以及表1说明,在复合物有效生成的前提下,体系黏度可能也是影响体系稳定性的重要因素。
3 结 语
以脱脂乳为主要原料的调酸型和发酵型两类常见不同加工体系为研究对象,对比研究SSPS与果胶对于酸化脱脂乳、酪蛋白和乳清蛋白3种蛋白质体系稳定性的影响。结果显示,在直接酸化体系中,对于3种乳蛋白,除了2 g/L SSPS无法与酪蛋白形成有效复合物并无法稳定体系外,2~4 g/L的SSPS均能与10 g/L的蛋白质形成复合物,并具有良好稳定效果;而2 g/L果胶对3种乳蛋白均无法有效形成复合物,也不能良好稳定体系,只有在高添加量时(4 g/L和6 g/L)才具有较好的稳定效果。在发酵酸化体系中,SSPS只有在4 g/L和6 g/L添加量时才能有效稳定酪蛋白,对于乳清蛋白和脱脂乳蛋白,所有添加量都无效;而对果胶而言,4 g/L和6 g/L添加量对发酵酸化的乳清蛋白和酪蛋白有较好的稳定能力,但对于发酵脱脂乳,只有6 g/L添加量才能有效稳定。上述结果结合LUMiSizer不稳定指数、SEC-HPLC复合物含量、粒径以及ζ-电位结果说明,不同多糖对于不同酸化工艺和不同蛋白质形成的酸化乳饮料的稳定机制不同,酸化乳蛋白的粒径是影响多糖-蛋白质复合物形成的要素之一。在复合物有效生成的前提下,体系黏度可能也是影响体系稳定性的重要因素。离心稳定性不能表征长期存放稳定性,对于直接酸化乳蛋白体系,复合物形成量和平均粒径可能对预测长期存放稳定性更有意义;对于发酵酸化乳蛋白体系,平均粒径和黏度可能对预测长期存放稳定性更有价值。
