一株耐盐土壤微藻的筛选及其耐盐特性研究
2022-05-27喻先伟刘文建李婉怡郭军康
张 超, 喻先伟, 刘文建, 李婉怡, 郭军康
(陕西科技大学 环境科学与工程学院, 陕西 西安 710021)
0 引言
盐碱地是指土壤中含有大量钠、钾、钙、镁等的硫酸盐和碳酸盐成分.在自然环境或人为因素协同作用下,该类土壤会富集大量盐分[1].我国盐碱化土壤分布范围广,主要分布于干旱、半干旱的东北、西北和华北等地区,其总面积超过3 000万hm2[2].
盐胁迫是影响微藻正常生长发育的非生物胁迫因子之一[3].目前盐胁迫对微藻所造成的影响主要表现在渗透压、光合作用与呼吸作用、细胞结构和酶活性四方面.杨蕾等[4]发现,当土壤溶液中存在大量Na+、K+、Ca2+、Mg2+等离子时,蓝藻细胞外会形成高渗环境,细胞失水,影响细胞与外部环境正常的水盐交换;盐胁迫下,斜生栅藻细胞PSⅡ活性会受到抑制,光合色素对光的吸收转化能力下降[5].另外,因胞内外水盐不平衡,有氧呼吸消耗糖类释放ATP的多个过程受到干扰;黄开耀等[6]发现,盐胁迫导致株胞鱼腥藻细胞表面结构皱缩、体积变小,细胞膜和类囊体紧紧贴合在一起,部分细胞膜结构受损;细胞结构损坏与失水情况下,莱茵衣藻相关特定酶合成受到抑制,影响细胞正常的新陈代谢[7].
研究表明,藻类在盐胁迫下会积累活性自由基(ROS),过量的ROS会引起细胞中DNA、蛋白质及脂质等分子的损伤[8].耐盐微藻能抵御盐胁迫对其生长发育所带来的危害,其耐盐机理也引起了研究者的兴趣.本研究利用在关中平原某中轻度盐碱化土地中筛选得到的一株土著微藻,通过分析不同浓度盐胁迫下微藻的抗氧化体系、脂质过氧化、可溶性蛋白、胞外多糖分泌等生理指标,试图解释其耐盐机制,以期为规模化利用藻类改良盐碱化土地提供部分理论支持.
1 实验部分
1.1 土壤微藻的筛选与鉴定
采集关中平原某中轻度盐碱化(34 °49 ′31 ″N,108 °38 ′9 ″E;土壤可溶性盐含量1.02~3.82 g/kg)土地中长有微藻的表层土(0~1 cm),将土壤样品快速封装于灭菌培养皿,带回实验室进行微藻的筛选.微藻筛选参照苏杭[9]的方法,略有改进.具体操作为:将土壤样品置于灭菌后的250 mL透明锥形瓶中,加入BG-11液体培养基至样品大部分浸没而不完全淹没,然后置于24 ℃、光照强度为8 000 Lux、光/暗比为16/8 h的光照培养箱中富集培养.待土壤样品表面明显变绿后,挑取少许样品转移至新的BG-11液体培养基,再次富集培养,之后用平板涂布法将藻液稀释涂布至固体BG-11培养基上进行分离、纯化,得到单个藻细胞菌落.继续用液体培养基扩大培养,用显微镜观察藻细胞形态,直至得到单一纯净的藻体为止.最后将纯化后的微藻送样至北京六合华大基因科技有限公司检测鉴定.
1.2 实验方法
1.2.1 NaCl梯度设置
取对数生长期的藻液5 mL,离心(5 000 r/min,10 min)收集藻体,使用无菌水重悬在含有不同浓度NaCl(0 g/L(对照)、5 g/L、10 g/L、15 g/L、20 g/L)的100 mL BG-11液体培养基中.连续光照培养15天,每个NaCl浓度处理三个重复,每隔3天取样进行相关生理指标的分析测定.每天定时将BG-11液体培养基摇匀3次.
1.2.2 测定方法
叶绿素a(Chla)、叶绿素b(Chlb)和总叶绿素含量采用紫外分光光度法测定[10],丙二醛(MDA)含量采用硫代巴比妥酸法测定[11],超氧化物歧化酶(SOD)活性采用氮蓝四唑法测定[12],可溶性蛋白含量采用考马斯亮蓝G-250染色法测定[13],胞外多糖(EPS)含量采用苯酚-硫酸法测定[14].藻细胞梯度脱水后通过扫描电镜(SEM),并结合光学显微镜对藻细胞表面形态进行观察.
1.3 数据处理
利用Excel 2010和SPSS 24.0 软件对数据进行处理分析,Origin 2018进行数据作图.采用 Duncan′s法进行多重比较分析,P<0.05表示不同处理间具有显著性差异.
2 结果与讨论
2.1 微藻的鉴定
从盐碱化表层土壤中初步筛选得到一株微藻,将其命名为GA-2.将测序数据利用MAGE-X软件中的邻近法neighbor-joining进行分析,并基于1 000次重复的bootstrap analysis可信度分析校正来构建系统发育树(如图1所示).分离纯化后的微藻经18S rRNA测序,并与美国国家生物技术信息中心(NCBI)数据库对比,鉴定结果其为栅藻(Scenedesmussp.).

图1 GA-2的18S rRNA序列系统发育树
2.2 盐胁迫对栅藻叶绿素的影响
光合藻类依靠其类囊体薄膜上的光合色素吸收转化太阳光,合成有机质储存于细胞内.叶绿素含量不仅直接关系着植物光合同化能力,也是衡量植物耐盐性的重要生理指标之一[15].不同浓度盐胁迫下,栅藻Chla、Chlb和总叶绿素含量变化如图2(a)、(b)、(c)所示.同一培养时间下,Chla、Chlb和总叶绿素含量均随着盐浓度的升高而逐渐降低,且与对照组相比呈现显著性差异(P<0.05).同一盐浓度下,随着培养时间的延长,Chla、Chlb和总叶绿素含量均表现出增加的趋势.叶绿体是对盐胁迫最敏感的细胞器之一,当藻细胞受到盐胁迫时,细胞内积累过量的ROS,其强氧化性会导致部分叶绿素的分解或合成受阻[16-19].本研究中,长时间的盐胁迫对栅藻叶绿素的合成有明显的抑制作用,且盐浓度越高,抑制程度越明显.高盐浓度下(≥15 g/L),溶液中形成大量颜色偏黄且肉眼可见的团聚体,原因可能是叶绿素的分解造成藻细胞颜色偏黄,以及由钠离子形成的高渗环境造成细胞结构改变(皱缩、膜结构损坏等)而形成团聚体.
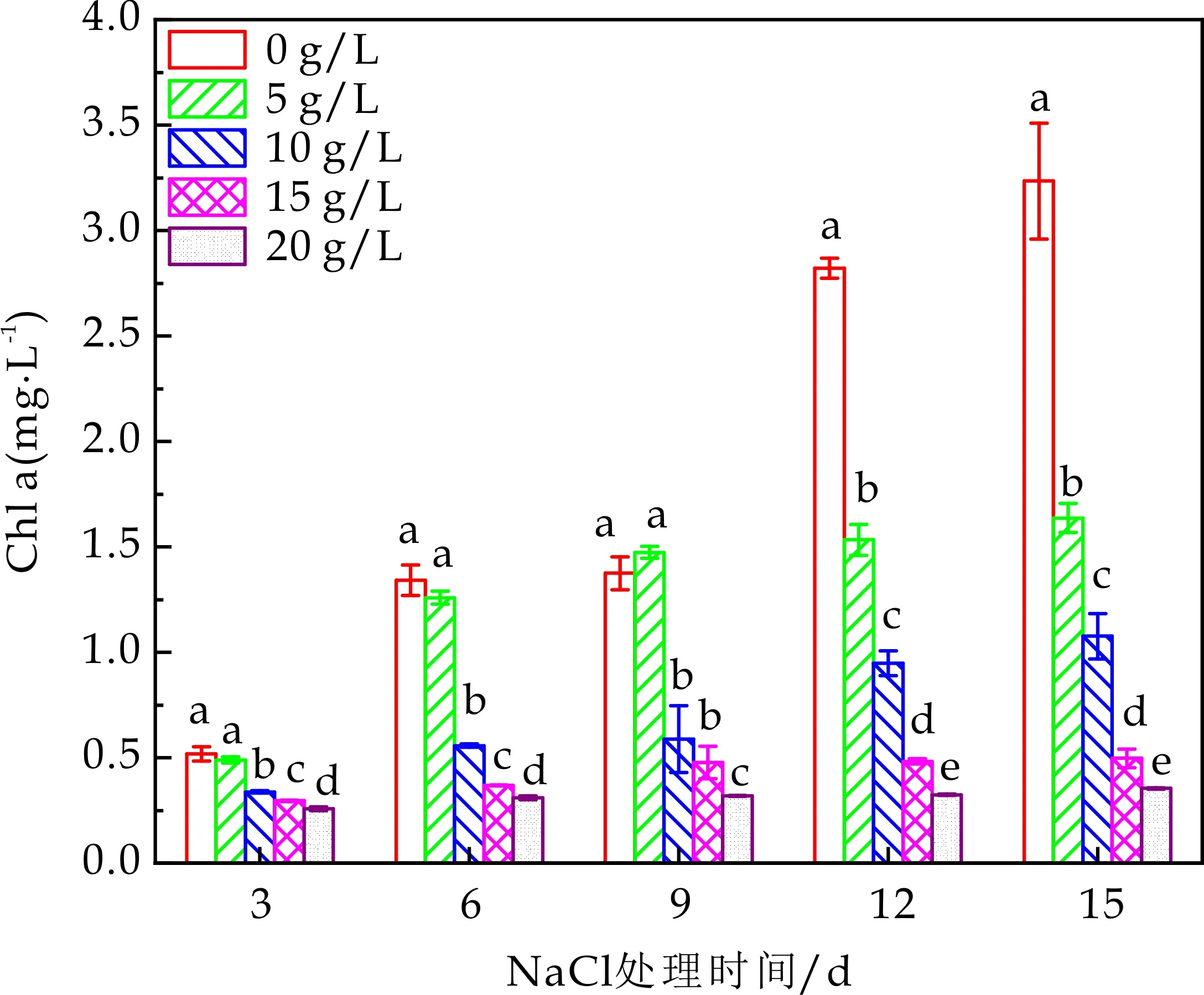
(a)藻细胞叶绿素a含量(不同小写字母表示同一培养时间下不同盐浓度处理间差异显著(P<0.05),下同)
2.3 盐胁迫对栅藻抗氧化酶活性与脂质过氧化的影响
盐胁迫刺激下,藻体会发生快速ROS猝发,短期内造成ROS积累,产生脂质过氧化产物,同时会刺激藻体抗氧化酶系统,产生抗氧化酶(SOD、POD、CAT等)来缓解盐胁迫造成的细胞损伤[20-23].其作用机理为,SOD能够催化植物细胞内的超氧化物发生歧化反应,产生O2和H2O2[24].MDA是最重要的脂质过氧化产物之一,可以表示藻细胞膜的受损程度[25,26].研究表明,MDA积累越多,植物组织的保护能力越弱[27].
如图3(a)和3(b)所示,同一培养时间下,栅藻SOD活性和MDA含量与盐浓度均呈现正相关关系,盐胁迫越大,SOD活性和MDA含量也越大,说明高盐胁迫对SOD和MDA的合成有刺激作用.同一盐浓度下,随着培养时间的延长,SOD活性和MDA含量也均呈现出先增加后减少的趋势,原因可能是盐胁迫初期,藻细胞为消除过量的ROS而产生大量的SOD,随着胁迫时间的增加,ROS积累量的减少,细胞膜脂质过氧化减轻以及对抗氧化酶系统刺激变弱,导致MDA含量和SOD活性降低.整体来看,SOD在第9 d能保持最高活性,而MDA含量在第6 d达到最大值,之后逐渐降低.
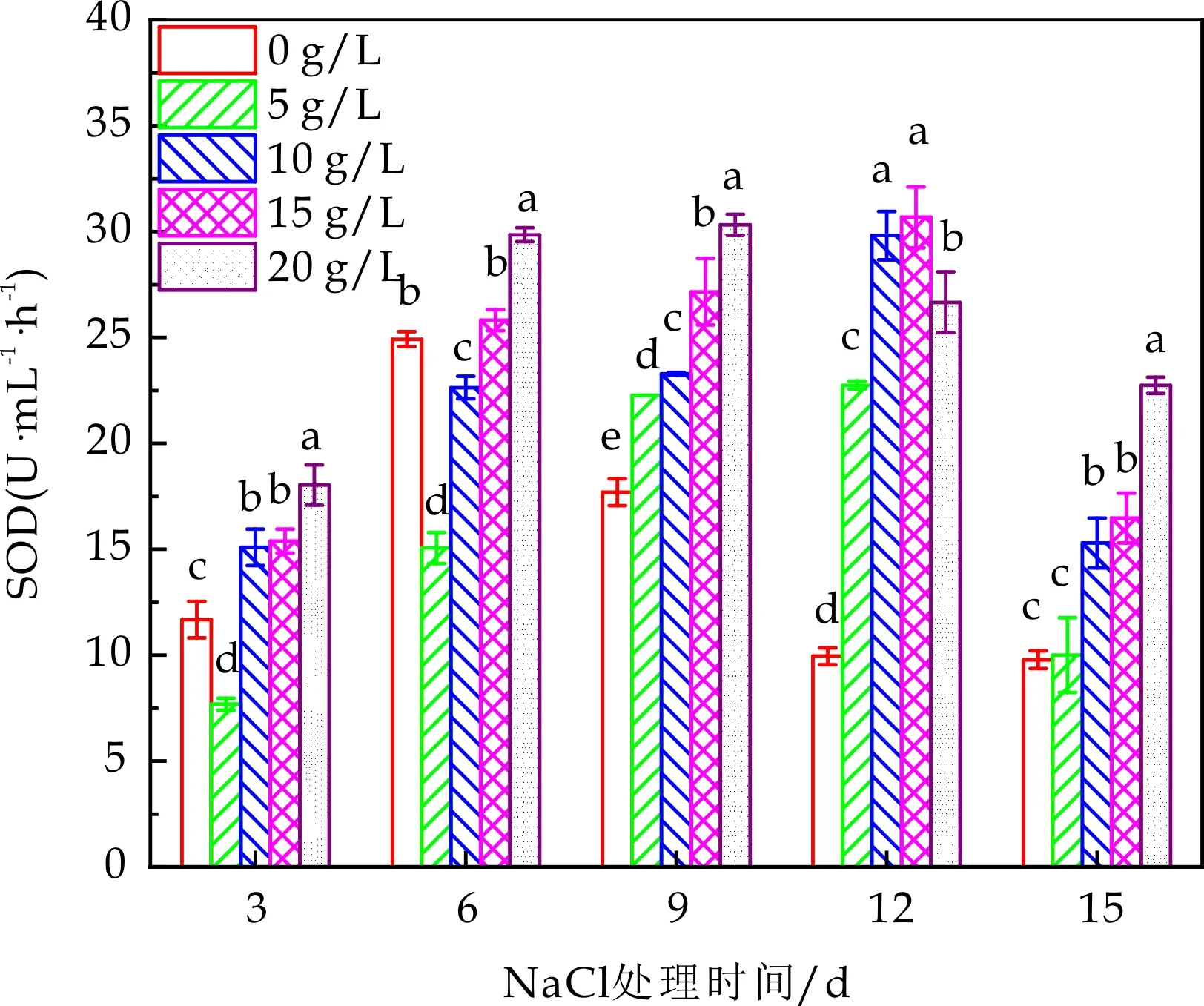
(a)藻细胞SOD活性
2.4 盐胁迫对栅藻可溶性蛋白和EPS含量的影响
植物体内可溶性蛋白的增加有利于其对水分的固定,达到调节胞内外渗透压,维持细胞膜完整性的目的[28].当藻体处于长期盐胁迫环境中时,细胞失水,体内Na+的过量积累会导致脂膜蛋白合成受阻,可溶性蛋白减少,对盐胁迫的调节能力减弱[29].如图4(a)所示,同一培养时间,高盐浓度下栅藻可溶性蛋白含量显著高于低盐浓度,说明盐胁迫能刺激栅藻细胞产生可溶性蛋白,缓解盐胁迫所带来的细胞损伤,这与SOD活性和MDA含量的变化趋势一致.宫庆友等[30]也发现蓝藻Anabaenavariabilis会合成一种耐盐蛋白SSP以应对盐胁迫对其的损害.同一盐浓度下,随着培养时间的增加,可溶性蛋白含量呈现先增加后降低趋势,在第9 d达到最大值,其原因可能是栅藻在长期盐胁迫下,细胞膜和合成蛋白质相关的细胞器遭到破坏,可溶性蛋白含量合成减少.王晓庆等[31]在研究盐藻耐盐特异性表达蛋白也发现长时间盐胁迫会导致相关耐盐蛋白含量下降.
大量研究证明,盐胁迫下植物细胞积累的EPS,一方面作为渗透保护物质,构成细胞与外界高渗环境之间的扩散缓冲屏障;另一方面,这类多糖物质具有的特定官能团,能清除ROS,从而有效缓解盐胁迫带来的膜脂过氧化损伤[32,33].如图4(b)所示,与可溶性蛋白不同,盐胁迫下栅藻细胞分泌的EPS含量随培养时间持续增加.在培养前9 d,各盐胁迫处理下EPS含量均已显著高于对照,可能是因为栅藻细胞在盐胁迫下会分泌大量EPS,调节渗透压和清除部分ROS,保持细胞膜通透性,减轻细胞脂质过氧化程度.多糖类物质和可溶性蛋白、抗氧化酶等协同组成栅藻细胞自我防御系统,可缓解栅藻细胞受盐胁迫造成的机能失常.

(a)藻细胞可溶性蛋白含量
2.5 盐胁迫下栅藻各生理指标间相关性分析
将培养9 d的栅藻各生理指标进行相关性分析.如表1所示,总叶绿素与SOD、MDA、可溶性蛋白之间均呈现负相关,与EPS呈现显著负相关.SOD、MDA、可溶性蛋白和EPS两两之间均呈现正相关关系.

表1 不同盐胁迫处理下各指标间的相关性分析
2.6 不同浓度盐胁迫对栅藻细胞形态的影响
藻体受到一定程度外部胁迫时,会出现明显的物理性损伤.如图5和6所示,分别利用光学显微镜和SEM观察盐胁迫前后栅藻细胞表面形态的变化.对照处理下(如图5(a)和6(a)所示),栅藻细胞通常是2、4或8个相互叠加的形式,在平面上呈现栅栏状或四角状排列,细胞壁光滑,具刺、齿或隆起线.随着盐胁迫程度的增加,栅藻细胞体积变大,细胞由栅栏状或四角状变成圆球状,细胞之间不再平行连接,藻体分布更加聚集紧密(如图5(e)所示),栅藻细胞刺、齿或隆起线消失,细胞表面出现褶皱和破损现象(如图6(b)所示).
李哲等[34]通过研究黑磷纳米片来对斜生栅藻的毒性进行研究,发现在100 mg/L黑磷纳米片的胁迫下,斜生栅藻细胞形态发生明显变化,细胞边缘不再完整、细胞破裂等.华栋等[35]也观察到在盐胁迫下,杯状叶绿体逐渐离解为多个相互连结或分离的部分,叶绿体内的类囊体片层系统解体.微藻细胞破损会导致其内容物流出,使其失去正常的生理代谢功能,可能是栅藻细胞受到盐胁迫累积的ROS量过多,超出可清除的阈值,导致细胞膜和细胞器遭到氧化性破坏.此外,高盐环境下,盐离子在扩散作用下会由胞外浓度高的地方向胞内浓度低的地方渗透,相反水分子在渗透作用下会由胞内浓度低的一边向胞外浓度高的一边流动,导致胞内大量水分流出,细胞出现皱缩,表面正常结构难以维持.

(a)~(e)分别为0 g/L、5 g/L、10 g/L、15 g/L和20 g/L NaCl图5 光学显微镜下栅藻细胞表面结构随盐胁迫的变化

(a)、(b)分别为0 g/L和20 g/L NaCl图6 SEM下栅藻细胞表面结构随盐胁迫的变化
3 结论
本研究成功地在原生盐碱地筛选得到一株耐盐微藻,经过分离、纯化和分子生物学鉴定,确定其为栅藻(Scenedesmussp.).
盐胁迫下,随着培养时间的延长,栅藻叶绿素合成受到抑制,SOD活性、MDA和可溶性蛋白含量均呈现先上升后下降趋势,EPS含量持续积累.
通过光学显微镜和SEM观察,高盐胁迫下栅藻细胞难以维持正常的表面结构,细胞出现明显的聚集、皱缩、破裂等现象,造成不可逆的细胞损伤.
