卡介苗活性快速检测方法的建立及验证
2022-05-19黄岳吴宇杰朱克骏江秋虹张健卢荣江韦芬陶立峰蒲江
黄岳,吴宇杰,朱克骏,江秋虹,张健,卢荣江,韦芬,陶立峰,蒲江
安徽智飞龙科马生物制药有限公司,安徽 合肥 230088
卡介苗(Bacille Calmette-Guérin vaccine,BCG)是世界卫生组织唯一推荐用于预防结核病的疫苗,是采用牛分枝杆菌减毒株经培养处理后获取。BCG 在生产和保存过程中需对其质量进行监控,其中活菌含量是影响BCG 效力的重要因素,根据《中国药典》三部(2020 版)[1]规定,现行BCG 活菌数测定方法为活菌计数法,活菌数应不低于1.0 × 106CFU / mg。BCG 活菌培养需4 ~5 周,检测周期较长[2]。因此,亟需寻求一种快速、简单、重复性好的检测方法来替代常规方法。
目前,对BCG 活性的快速检测方法主要有四唑鎓盐(tetrazolium salt,XTT)法和生物荧光法。其中,生物荧光法是一种通过检测菌体内ATP 的含量来判定菌体活性的方法[3-4],该方法是基于萤火虫发光原理,通过测量ATP 与荧光素/荧光素酶反应产生的荧光来定量ATP 含量[5-6]。BCG 成品是一种冻干制品,不能直接检测ATP 含量以反映其活性,因此,本研究采用不同方法提取ATP,再通过生物荧光法检测ATP 含量,并进行重复性和中间精密度验证,同时与活菌计数法进行比较,分析ATP 含量与活菌数的相关性,以期建立一种快速、简便和准确的BCG 活力检测方法。
1 材料与方法
1.1 供试品 15 批冻干BCG 由安徽智飞龙科马生物制药有限公司制备,其中低剂量共9 批[0.25 mg/mL(批号:201807004、201808005、201809006),0.375mg/mL(批号:201703001、201808004、201810005、201812007、201812008),0.5 mg / mL(批号201901001)],高剂量(60mg/mL)共6 批(批号:201812001-1、201812001-2、201901001-1、201901001-2、201901002-1、201901002-2,编码1 ~6)。
1.2 主要试剂及仪器 ATP 标准品和ATP 检测工作液购自美国普洛麦格公司;Dubos 培养基和Tris-EDTA 缓冲液由安徽智飞龙科马生物制药有限公司制备;96 孔板购自美国柯仕达公司;SpectraMax M5型酶标仪购自美国美谷分子仪器公司。
1.3 标准曲线的建立 用灭菌注射用水将ATP 标准品稀释为2 × 10-8、1 × 10-8、5 × 10-9、2.5 × 10-9、1.25×10-9、6.25×10-10mol/L,分别加至96 孔板中,100 μL / 孔,每个浓度设3 个平行,加入ATP 检测工作液,100 μL / 孔,混匀,室温孵育5 min,用酶标仪检测相对荧光强度(relative light unit,RLU)。以ATP标准品浓度为横坐标,平均RLU 为纵坐标,建立标准曲线。
1.4 BCG 浓度与RLU 线性图的绘制 将批号为201808005 的高剂量BCG 用灭菌注射用水稀释至2、1、0.5、0.25、0.125 和0.062 5 mg / mL,共6 个稀释度,每个浓度设3 个平行检测,采用生物荧光法(同1.3 项)检测RLU。以BCG 浓度为横坐标,RLU平均值为纵坐标,绘制线性关系图。
1.5 BCG 中ATP 的提取
1.5.1 离心法 将冻干BCG 用Dubos 培养基复溶,37 ℃培养24 h;室温,18 800 × g 离心5 min,收集菌体,用等体积Dubos 培养基重悬;取100 μL 悬浮液,加入500 μL 预热的Tris-EDTA 缓冲液,进行热裂解提取,获得提取液,自然冷却至室温,即为待测样品。
1.5.2 本底法 将冻干BCG 用Dubos 培养基复溶,37 ℃孵育24 h;取复溶物悬浮液100 μL,直接加入500 μL 预热的Tris-EDTA 缓冲液,进行热裂解提取,获得提取液,自然冷却至室温,即为待测样品。以未进行BCG 热裂解的样品作为本底值,RLU 平均值减去本底值即BCG 中的ATP 含量。
1.5.3 ATP 酶法 将冻干BCG 用Dubos 培养基复溶,37 ℃培养24 h;取复溶物悬浮液500 μL,加入含5 U / mL ATP 酶,室温反应10 min;加入500 μL 预热的Tris-EDTA 缓冲液,进行热裂解提取,获得提取液,自然冷却至室温,即为待测样品。
1.6 检测方法的建立 取标准品和3 种方法提取的15 批BCG 待测样品各100 μL,分别加入96 孔板,每个样品设3 个平行,加入ATP 检测工作液,100 μL/孔,混匀,室温反应5 min,10 min 内用酶标仪检测RLU,根据标准曲线计算BCG 中的ATP 含量。同时采用活菌计数法[1]检测活菌数,比较RLU 与活菌数的相关性。
1.7 方法的验证
1.7.1 重复性 由同一位实验人员于3 个不同时间点,分别采用本底法和ATP 酶法提取6 批高剂量BCG 中的ATP,按1.6 项方法检测RLU。
1.7.2 中间精密性 由3 位分析人员(A、B、C)于同一个时间点,分别采用本底法和ATP 酶法提取6 批高剂量BCG 中的ATP,按1.6 项方法检测RLU。
1.8 统计学分析 生物荧光法测定的RLU 与活菌计数法检测的活菌数相关性的比较采用Pearson 相关系数法进行分析,Pearson 相关系数>0.8 为显著相关,以P <0.05 为差异有统计学意义。
2 结 果
2.1 标准曲线的建立 生物荧光检测标准曲线见图1。ATP 浓度在6.25×10-10~2×10-8mol/L 范围内,与RLU呈良好线性关系,回归方程为y=1680.4x-574.46,R2= 0.998 7。

图1 生物荧光检测的标准曲线Fig.1 Standard curve for bioluminescence assay
2.2 BCG 浓度与RLU 的关系 BCG 浓度与RLU 线性关系图见图2。BCG 浓度在0.062 5 ~2 mg / mL范围内,与RLU 呈良好的线性关系,回归方程为y = 11 295 x - 341.66,R2= 0.993 8。
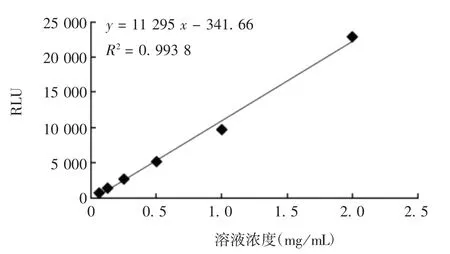
图2 BCG 浓度与RLU 的线性关系图Fig.2 Linear relationship between BCG concentration and RLU
2.3 不同ATP 提取方法的比较
2.3.1 离心法 15 批BCG 的ATP 含量与相应活菌数无显著相关性(Pearson 相关系数= 0.276,P =0.320);9 批低剂量BCG 的ATP 含量与相应活菌数无显著相关性(Pearson 相关系数= -0.098,P =0.802),6 批高剂量BCG 的ATP 含量与相应活菌数无显著相关(Pearson 相关系数= 0.712,P = 0.112)。见图3。

图3 离心法提取的15 批BCG ATP 含量与相应活菌数的相关性Fig.3 Relationship of ATP contents to the corresponding viable counts of 15 batches of BCG vaccine extracted by centrifugation
2.3.2 本底法 15 批BCG 的ATP 含量与相应活菌数无显著相关性(Pearson 相关系数= 0.169,P =0.546);9 批低剂量BCG 的ATP 含量与相应活菌数无显著相关性(Pearson 相关系数= 0.588,P =0.096),6 批高剂量BCG 的ATP 含量与活菌数具有显著相关性(Pearson 相关系数= 0.871,P = 0.024)。见图4。
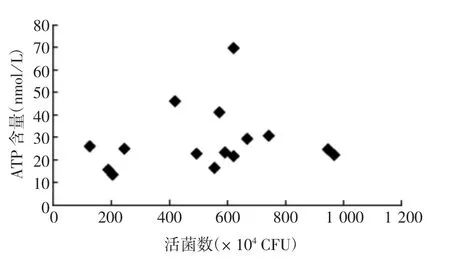
图4 本底法提取的15 批BCG ATP 含量与相应活菌数的相关性Fig.4 Relationship of ATP contents to the corresponding viable counts of 15 batches of BCG vaccine extracted by background method
2.3.3 ATP 酶法 15 批BCG 的ATP 含量与相应活菌数无显著相关性(Pearson 相关系数= 0.355,P =0.194);9 批低剂量BCG 的ATP 含量与相应活菌数无显著相关性(Pearson 相关系数=0.546,P=0.128),6批高剂量BCG 的ATP 含量与活菌数具有显著相关性(Pearson 相关系数= 0.908,P = 0.012)。见图5。
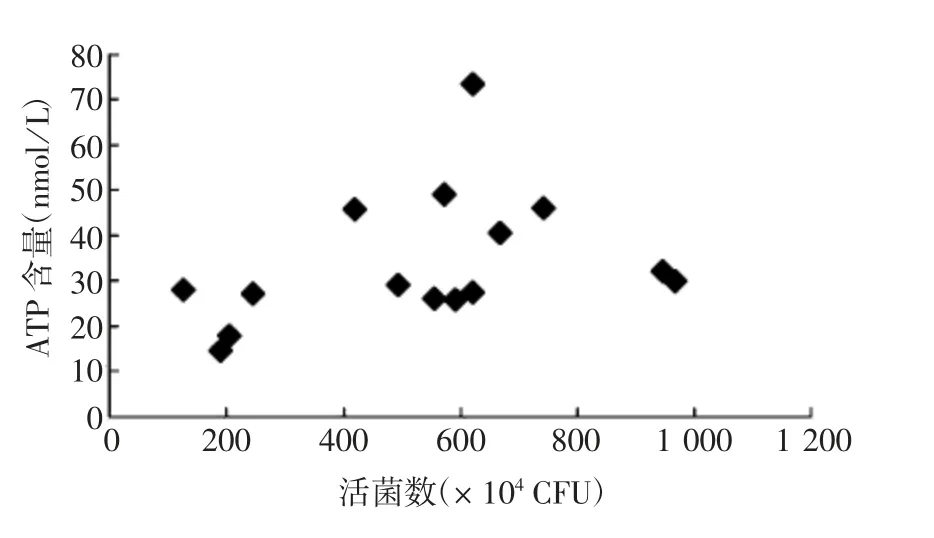
图5 ATP 酶法提取的15 批BCG ATP 含量与相应活菌数的相关性Fig.5 Relationship of ATP contents to the corresponding viable counts of 15 batches of BCG vaccine extracted by ATPase method
2.4 方法的验证
2.4.1 重复性 本底法提取6 批高剂量BCG 的ATP,3 次检测ATP 含量的RSD 分别为7.69%、5.84%、5.41%、6.58%、2.64%、4.38%;ATP 酶法提取6 批高剂量BCG 的ATP,3 次检测ATP 含量的RSD 分别为4.34%、2.33%、3.86%、2.78%、3.74%、1.98%。见表1。RSD 均<8%,表明该方法具有良好的重复性。

表1 重复性验证结果Tab.1 Verification for reproducibility
2.4.2 中间精密性 本底法提取6 批高剂量BCG的ATP,实验人员A、B、C 检测ATP 含量的RSD 分别为3.39%、2.36%、1.16%、3.79%、3.47%、0.60%;ATP酶法提取6 批高剂量BCG 的ATP,实验人员A、B、C检测ATP 含量的RSD 分别为6.24%、5.76%、1.82%、3.50%、2.24%、1.83%。见表2。RSD 均<8%,表明该方法具有良好的中间精密性。

表2 中间精密性验证结果Tab.2 Verification for intermediate precision
3 讨 论
BCG 的活力是其质量研究中的关键检测参数,常规检测方法是对活菌集落形成单位进行检测,即活菌计数法[7-8],该方法可反映冻干BCG 在固体生长培养基上的特性。冻干工艺可保存BCG 大量菌体的代谢活动,这些代谢活动将在固体介质上培养时丢失,只有具有足够代谢活性以支持在固体培养基上生长的细菌才能形成菌落[9-10]。活菌计数法虽是目前BCG 活力检测的金标准,但单次检测周期较长,约4 ~5 周,从而增加了BCG 的生产和检定周期,不利于生产工艺优化。目前,国内外均开展了BCG快速检测方法的研究,主要有XTT 法和生物荧光法等。其中,XTT 法主要用于BCG 半成品活力的定性检测,检测周期约1 d;有实验表明,生物荧光法可用于高剂量BCG 成品活力的定量检测,检测周期约1 d,具有操作简单、快速、灵敏度及准确度高等优点[11-12],已成为BCG 活力快速检测方法中的研究热点。
采用生物荧光法检测BCG 中的ATP 含量可准确反应BCG 活力[13-14],但BCG 中ATP 的提取需考虑3 个因素:①BCG 存在蜡质细胞壁,胞内ATP 不易释放[15];②冻干BCG 中的卡介菌长期处于休眠状态,需培养一定时间才可恢复至正常生长活性[16];③冻干工艺中超低温环境会使BCG 产生部分死菌,且存在游离的ATP,直接检测ATP 含量并不能代表活菌数量。因此,不能以检测冻干BCG 中的ATP 含量来反映BCG 活力。一般可通过90 ℃以上高温水浴即可裂解释放卡介菌胞内ATP,且加入Tris-EDTA缓冲体系能够有效保证ATP 的稳定性;冻干BCG复溶后用Dubos 培养基于37 ℃培养24 h 可有效恢复卡介菌活性。本实验通过离心法、本底法和ATP酶法去除游离ATP,再采用热裂解法释放卡介菌中的ATP,经生物荧光法检测其含量,结果表明,3 种方法提取低剂量BCG 中的ATP,生物荧光法检测其含量,与活菌计数法检测的活菌数无显著相关性(P >0.05);ATP 酶法和本底法提取高剂量BCG 的ATP 含量与相应活菌数具有显著相关性(P <0.05)。分析原因可能是相同的处理时间下,低剂量BCG 活菌数受影响较大,而高剂量BCG 中活菌浓度高,整体活菌数更为稳定,表明生物荧光法可作为高剂量BCG 活性快速检测方法,且该方法具有良好的重复性及中间精密性(RSD 均< 8%)。
综上所述,本研究初步建立了的一种快速、稳定的ATP 含量检测方法,可作为高剂量BCG 活力检测的辅助方法。
