重组假丝酵母尿酸氧化酶等电点毛细管等电聚焦检测方法的建立及验证
2022-05-19刘家鑫张婷婷杨丽华唐其凤靳征
刘家鑫,张婷婷,杨丽华,唐其凤,靳征
沈阳三生制药有限责任公司,辽宁 沈阳 121000
尿酸氧化酶是尿酸的特异性氧化酶,可有效催化溶解度极低的尿酸氧化为无活性、溶解度极高的尿囊素[1],通过肾脏途径快速排出体外,达到降低尿酸浓度的治疗功能。临床上多用于痛风和高尿酸血症的治疗和控制[2]。近年来,随着DNA 重组技术的飞速发展,重组尿酸氧化酶药物已成为生物医药行业研发的热点之一。重组假丝酵母尿酸酶与其他物种的尿酸酶相比,具有活性高、水溶性及热稳定性好等特点,具有良好的应用前景[3-4]。重组假丝酵母尿酸酶相对分子质量约为34 000,以同源四聚体结构发挥酶活性,其结构内部包埋着大量疏水性氨基酸残基,形成疏水性网络,维持稳定中空结构。C-末端亮氨酸位于蛋白四聚体表面,易形成八聚体或更高级别的聚合物。由于此类重组蛋白药物空间结构和基团修饰上较复杂,稳定性易受周围环境及工艺变化影响,产生聚合体或降解产物,导致免疫原性升高,影响其安全性和有效性,此类生物制品的质量控制尤为重要。
等电点(isoelectric point,pI)是蛋白质类生物药物的内在属性之一,多与氨基酸序列或翻译后修饰相关,如缺失肽、断裂肽、酰胺化/ 去酰胺化、氨基酸侧链的不完全脱保护[5]、多糖唾液酸化[6]。当生产工艺发生调整或存储、运输条件发生变化时,均会影响蛋白类药物的pI。因此,pI 检测通常作为鉴别项目来监测和控制蛋白类生物制品产品的质量。
pI 的测定方法主要有浊度-分光光度法、基于蛋白质与离子交换作用、等电聚焦法,前两种方法由于操作繁琐,且不能完整反应蛋白类药物电荷异质性的全面情况,不适用对药物进行质量控制;而等电聚焦法多作为多肽和蛋白类药物表征确证的常用方法[7-8],主要包括聚丙烯酰胺凝胶等电聚焦(平板等电聚焦)和毛细管等电聚焦(capillary isoelectrie focusing,cIEF),后者与前者相比,具有样品用量少、耗时短、分辨率高、易于自动化等特点。本研究旨在建立cIEF 法检测重组假丝酵母尿酸氧化酶pI,并进行验证,为产品的质量控制提供参考。
1 材料与方法
1.1 样品 重组假丝酵母尿酸氧化酶由沈阳三生制药有限责任公司生产,批号:NY180301、NY180302、NY160601、NY160602。
1.2 主要试剂及仪器 3-10 两性电解质载体购自美国GE Healthcare 公司;pI marker 10.0、9.5、5.5、4.1、cIEF 凝胶、毛细管电泳仪PA800 plus、毛细管柱N-CHO 涂层和UV 检测器均购自美国Beckman Coulter 公司;精氨酸购自美国Sigma 公司;尿素购自美国Sigma-Aldric 公司;冷冻离心机SORVALL LEGEND RT + Centrifuge 购自美国Thermo Scientific公司;实验用水为Cascada I PALL 系统制备。
1.3 方法的建立
1.3.1 操作步骤 样品脱盐:取样品适量(相当于蛋白250 μg)置于10 kD 超滤管中,8 000 × g 离心10 min,加入200 μL 20 mmol / L Tris-HCl,8 000 × g离心10 min,重复2 次,加入200 μL 20 mmol /L Tris-HCl,8 000×g 离心至25 μL,使终浓度为10 mg/mL。母液配制(单个样品体积):3 mol / L 尿素-cIEF 凝胶溶液200 μL,3-10 两性电解质载体12 μL,500 mmol/L左旋精氨酸(arginine,ARG)阴极稳定溶液60 μL,200 mmol / L 亚氨基二乙酸(iminodiacetic acid,IDA)阳极稳定溶液6 μL,pI marker 10.0、5.5、4.1 各1 μL。取脱盐样品10 μL,与母液混合,盖紧样品管并涡匀,转移200 μL 至进样小瓶中。
1.3.2 仪器条件 N-CHO 涂层,50 μm 内径的熔融石英毛细管柱温20 ℃,样品室温度10 ℃;UV 检测器波长280 nm,收集速率2 Hz。聚焦电压25 kV,15 min;分析电压30 kV,35 min。
1.3.3 方法的优化
1.3.3.1 稳定剂比例 母液配制过程中加入的ARG ∶IDA 量分别为40 μL ∶4 μL、60 μL ∶6 μL、80 μL ∶8 μL,其他溶液配制保持不变,考察稳定剂比例对试验结果的影响。
1.3.3.2 等点聚焦时间 将聚焦时间分别设为15、20、25 min,聚集电压和化学迁移条件不变。观察聚焦时间调整后试验结果的变化。
1.4 方法的验证
1.4.1 专属性 分别将重组假丝酵母尿酸氧化酶与重组假丝酵母尿酸氧化酶基质(20 mmol / L Tris-HCl)进样分析,观察基质在样品主峰出峰位置有无杂质峰干扰。
1.4.2 精密度
1.4.2.1 重复性 同一实验员平行制备3 个样品,比较3 个平行样品中的主峰等电点和峰型,考察方法的重复性。
1.4.2.2 中间精密度 同一实验员在不同时间,对同一批次重组假丝酵母尿酸氧化酶(NY180301)进行检测,每次平行制备3 个样品,考察方法的中间精密度。
1.4.2.3 批间精密度 对4 个批次的重组假丝酵母尿酸氧化酶进行检测,每个批次制备3 个平行样品,比较各批次样品的pI。
1.4.3 准确度 以pI marker 9.5 的回收率评价该方法的准确度。取不同批号的pI marker(M710176、M902109),每个批号平行制备3 个样品,利用同批号pI marker 所得标曲计算pI marker 9.5 的实测pI。通过计算pI marker 9.5 的实测pI 与理论值的比值,评价该方法的准确度。
1.4.4 耐用性
1.4.4.1 样品稳定性 将重组假丝酵母尿酸氧化酶样品在10 ℃下保存,分别在0、2、4、8、24 h 时进样,比较不同时间下样品主峰各pI,考察样品溶液24 h 内的稳定性。
1.4.4.2 物料批号变化考察 通过设计正交试验,考察实验中主要试剂和材料的批号的改变是否影响试验结果,主要试剂和材料见表1,每个正交组合平行测定3 次。

表1 主要试剂和材料Tab.1 Key reagents and materials
2 结 果
2.1 方法的优化
2.1.1 稳定剂比例 试验结果显示,ARG ∶IDA 为80 μL ∶8 μL 时,无样品峰和pI marker 峰;ARG ∶IDA为40 μL ∶4 μL、60 μL ∶6 μL 时,能观察到样品主峰和pI marker 峰,且ARG ∶IDA 为60 μL ∶6 μL 时异质峰较少,峰型较好,利于对样品进行质量控制。见图1。因此确定ARG ∶IDA 最适比例为60 μL ∶6 μL。

图1 不同ARG∶IDA比例重组假丝酵母尿酸氧化酶IEF图谱Fig.1 IEF profile of recombinant C.uricase at various ratios of ARG to IDA
2.1.2 等电聚焦时间 试验结果显示,改变聚焦时间对样品主峰个数及pI 均无明显影响,3 种聚焦时间均能呈现出较好的pH 梯度(R2>0.990),15 min条件下即可满足检测要求,且峰型较好。见图2 和图3。因此确定聚焦时间为15 min。

图2 不同聚焦时间重组假丝酵母尿酸氧化酶IEF 图谱Fig.2 IEF profile of recombinant C.uricase at different focusing times

图3 不同聚焦时间下pI marker 线性情况Fig.3 Linearity of pI marker at various focusing times
2.2 方法的优化
2.2.1 专属性 试验结果显示,基质溶液在样品主峰出峰位置无杂质峰干扰,不干扰样品测定,见图4。

图4 重组假丝酵母尿酸氧化酶溶液(A)与基质溶液(B)IEF 图谱Fig.4 IEF profile of recombinant C.uricase(A)and blank matrix(B)
2.2.2 精密度
2.2.2.1 重复性 试验结果显示,3 个平行样品各峰pI 和峰型基本一致,pI 相对标准偏差(relative standard deviation,RSD)在0.81% ~0.87%之间,见表2和图5。表明方法的重复性良好。

图5 重组假丝酵母尿酸氧化酶重复性验证IEF 图谱Fig.5 IEF profile for verification of reproducibility of recombinant C.uricase

表2 重复性验证结果(pI)Tab.2 Verification for reproducibility(pI)
2.2.2.2 中间精密度 同一实验员在不同时间,对同一批次样品进行检测,各峰pI 的RSD 在0.91% ~1.5%之间,见表3。表明方法的中间精密度良好。

表3 中间精密度验证结果(pI)Tab.3 Verification for intermediate precision(pI)
2.2.2.3 批间精密度 不同批次重组假丝酵母尿酸氧化酶各主峰的pI 波动幅度较小,各峰pI 的RSD在0% ~0.79%之间,见表4。表明该方法批间精密度良好。

表4 批间精密度验证结果(pI)Tab.4 Verification for inter-batch precision(pI)
2.2.3 准确度 两批pI marker 9.5 实测值均为9.7,回收率为102%。表明该方法准确度良好。
2.2.4 耐用性
2.2.4.1 溶液样品稳定性 在24 h 范围内,与0 h相比,pI 保持一致,见表5。表明样品溶液在10 ℃保存24 h 内稳定性良好。

表5 样品溶液10 ℃保存0 ~24 h 的稳定性(pI)Tab.5 Stability of sample solution after storage at 10 ℃for 0 ~24 h(pI)
2.2.4.2 物料批号变化考察 两性电解质、cIEF 凝胶和毛细管柱不同批号间的各主峰pI RSD 分别在2.6% ~3.4%、0.63% ~1.1%和0.47% ~0.65%之间,见表6 ~表8。表明主要试剂和材料不同批号间数据差异较小,可满足日常检测质量控制要求。
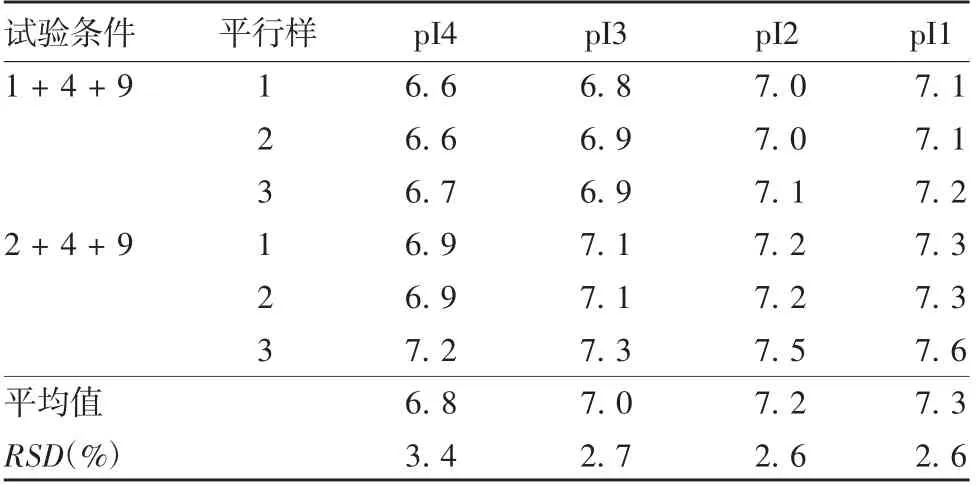
表6 不同批号两性电解质载体的pITab.6 The pI values of amphoteric electrolyte carriers of different batches

表7 不同批号cIEF 凝胶的pITab.7 The pI values of cIEF gel of various batches

表8 不同批号毛细管柱的pITab.8 The pI values of capillary column of various batches
3 讨 论
pI 是重组蛋白类药物质量控制的重要指征,其可反映生物技术合成的蛋白质类药物的纯度和空间构象的均一性。生产及储存过程中由于工艺变化或外界环境因素引起的蛋白结构修饰或产品降解,也可通过pI 的变化进行表征。此外,pI 也是生物制品电荷异质性的重要体现,可作为分析聚体形成或产品降解的辅助手段,对生物制品的质量控制起着重要作用。
cIEF 是基于pI 差异进行蛋白质分离的高分辨率分离技术,它其通过将带有两性基团的样品、载体两性电解质和添加剂的混合物注入毛细管内,在电场下形成一定范围的pH 梯度,当柱内pH 值与该组分的pI 相同时,该组分的净电荷为0,溶质分子便实现聚焦,形成明显的区带,使蛋白质样品中各组分得到分离[9]。主要用于蛋白类药物pI 及电荷异质性的检测[10-11]。在cIEF 分析过程中,两性电解质形成的稳定pH 梯度对聚焦过程有显著影响。本研究采用3-10 两性电解质载体可有效测定重组假丝酵母尿酸氧化酶的pI。为保证pH 梯度的稳定,通常添加额外的电解质,减少原始电解质的损失。ARG 的pI 为10.7,IDA 的pI 为2.2,是合适的额外电解质,可用作阴极稳定剂与阳极稳定剂[12]。添加高浓度的ARG 和低浓度的IDA 可阻止等速电泳对pH 梯度的影响,而不影响分离度[13]。本研究中考察了不同量的ARG 和IDA 对检测结果的影响,当ARG ∶IDA为60 μL ∶6 μL 时,峰型较好,4 个主峰可明显分辨。不同批次间的pI 保持稳定,重现性较好。对于聚焦时间,尝试比较了15、20、25 min,延长聚焦时间对最后的结果无明显影响。同时需要注意的是,聚焦时间必须足够,不能过短,避免聚焦尚未完成即开始迁移。又由于聚焦过程是在高电压条件下,过度延长聚焦时间将加大样品凝聚沉淀的可能性[14],因此选取15 min 作为最适聚焦时间。在满足检测要求的基础上,又可节省时间。对上述两个条件的调整均不影响pH 梯度(R2>0.990)。可满足重组假丝酵母尿酸氧化酶pI 的测定。
在分析方法验证中,pI 检测属于鉴别试验。参照ICHQ2[15]文件要求,典型验证项目为专属性,但为满足实际生产放行检测需求,更好地控制批间一致性,本研究将重复性、中间精密度和耐用性也纳入方法验证项目中,为分析方法的风险控制提供数据支持。
综上所述,本研究建立的cIEF 方法专属性、精密度、准确度、耐用性均良好,可用于重组假丝酵母尿酸氧化酶pI 的检测,同时也为尿酸酶类生物制品的质量控制提供了参考。
