胃癌及癌前病变与胃蛋白酶原、胃泌素-17表达水平的关系研究
2022-05-03郭玉峰
郭玉峰,吕 娴
(宁夏医科大学总医院消化内科,宁夏 银川 750001)
胃癌为胃黏膜上皮细胞发生恶性增生所致的一类高患病率、高致死率的恶性消化道肿瘤,位于我国恶性肿瘤死亡率的第三位,对人类生命、生活造成严重危害[1]。胃癌早期症状多无明显症状,随其进展逐渐表现出食欲减退、消瘦及腹痛等症状。有研究显示,胃癌的早期诊断是提高治疗成功率与降低死亡率的关键,因此,在癌变早期及时发现、确诊,并予以针对性治疗将大大提升治疗效果[2]。故加强胃癌早期诊断尤为重要,临床对于胃癌早期多通过内镜检查进行筛查和二级预防,但其花费较高,对胃部微小病变显示较差且具侵入性,无法进行普遍性早期筛查,故寻求简单、特异性的实验室筛查指标十分必要[3]。胃蛋白酶原和胃泌素-17均为胃部黏膜分泌的血清学指标,有学者指出,上述指标水平异常可能与胃癌与癌前病变的进展有关[4]。故本研究旨在探讨胃癌及癌前病变与患者胃泌素-17和不同类型胃蛋白酶原表达情况的关系,为临床延缓或逆转病变提供依据,现报道如下。
1 资料与方法
1.1 一般资料 选取2019年9月至2021年9月宁夏医科大学总医院收治的49例胃癌患者将其作为胃癌组,另选取104例胃癌癌前病变患者作为癌前病变组,同时选取40例同期健康体检者为健康组。其中胃癌组患者女性19例,男性30例;年龄31~62岁,平均(49.43±9.37)岁。癌前病变组患者女性41例,男性63例;年龄27~63岁,平均(48.41±10.39)岁。健康组研究对象中女性18例,男性22例;年龄25~65岁,平均(50.04±11.05)岁。3组研究对象一般资料比较,差异均无统计学意义(均P>0.05),可进行组间对比。纳入标准:胃癌组均符合《胃癌规范化诊疗指南(试行)》[5]中的相关诊断标准,且经内镜与病理组织学检查确诊者;癌前病变组患者均符合《胃癌癌前病变基础与临床》[6]中的相关诊断标准,且经内镜或病理检查确诊者;健康组研究对象近3个月未有胃病发病史者。排除标准:有放、化疗史者;近1个月内服用养胃、抑酸药物者;存在其他恶性肿瘤或自身免疫系统疾病者。本研究已经院内医学伦理委员会审核批准,且所有研究对象或其家属均已签署知情同意书。
1.2 研究方法 分别于入组时,采集各组研究对象清晨空腹静脉血5 mL,进行离心操作,以3 500 r/min的转速,离心5 min,取上血清,采用酶联免疫吸附实验法检测胃蛋白酶原Ⅰ、胃蛋白酶原Ⅱ、胃泌素-17,并计算胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ的比值(PGR)。根据内镜检查分化程度将癌前病变组分别分为慢性萎缩性胃炎组49例,伴肠化生组35例及伴异型增生组20例。
1.3 观察指标 ①对比健康组、癌前病变组和胃癌组3组研究对象胃蛋白酶原Ⅰ、胃蛋白酶原Ⅱ、PGR、胃泌素-17表达水平。②对比萎缩性胃炎组、伴肠化生组及伴异型增生组患者胃蛋白酶原Ⅰ、胃蛋白酶原Ⅱ、PGR、胃泌素-17表达水平。③采用Logistic回归分析对各类型胃蛋白酶原和胃泌素-17表达与胃癌和癌前不同程度病变的关系进行分析。④采用受试者工作特征(ROC)曲线对各指标对胃癌癌前病变诊断效能进行分析。
1.4 统计学方法 采用SPSS 24.0统计软件进行数据分析,计量资料以(±s)表示,采用t检验,多组间计量资料比较采用单因素方差分析;采用Logistic回归分析对胃泌素-17和胃蛋白酶原各类型表达与胃癌及癌前不同程度病变的关系进行分析;采用ROC曲线对各指标对胃癌癌前病变诊断效能进行分析。以P<0.05为差异有统计学意义。
2 结果
2.1 3组研究对象各类型胃蛋白酶原和胃泌素-17水平 健康组、癌前病变组、胃癌组3组研究对象胃蛋白酶原Ⅰ、PGR均呈逐渐降低趋势,且胃癌组显著低于癌前病变组与健康组,癌前病变组显著低于健康组;胃蛋白酶原Ⅱ、胃泌素-17均呈逐渐升高趋势,且胃癌组显著高于癌前病变组与健康组,癌前病变组显著高于健康组,差异均有统计学意义(均P<0.05),见表1。
表1 3组研究对象各类型胃蛋白酶原和胃泌素-17水平比较( ±s)

表1 3组研究对象各类型胃蛋白酶原和胃泌素-17水平比较( ±s)
注:与健康组比,*P<0.05;与癌前病变组比,#P<0.05。PGR:胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ。
组别 例数 胃蛋白酶原Ⅰ(μg/L) 胃蛋白酶原Ⅱ(μg/L) PGR 胃泌素-17(pmoL/L)健康组 40 117.20±23.20 8.79±2.32 13.33±1.40 8.79±1.15癌前病变组 104 80.66±10.77* 14.76±4.15* 5.46±2.64* 13.29±4.50*胃癌组 49 55.07±10.88*# 21.34±6.63*# 2.58±0.98*# 25.71±7.57*#F值 209.752 81.475 308.330 144.150 P值 <0.05 <0.05 <0.05 <0.05
2.2 不同癌前病变程度患者各类型胃蛋白酶原及胃泌素-17水平 慢性萎缩性胃炎组、伴肠化生组、伴异型增生组患者胃蛋白酶原Ⅰ、PGR均呈逐渐降低趋势,且伴异型增生组患者PGR水平均显著低于伴肠化生组、慢性萎缩性胃炎组,伴肠化生组显著低于慢性萎缩性胃炎组;胃蛋白酶原Ⅱ、胃泌素-17均呈逐渐升高趋势,且伴异型增生组患者均显著高于伴肠化生组、慢性萎缩性胃炎组,伴肠化生组显著高于慢性萎缩性胃炎组,差异均有统计学意义(均P<0.05),见表 2。
表2 不同癌前病变程度患者各类型胃蛋白酶原及胃泌素-17水平比较( ±s)
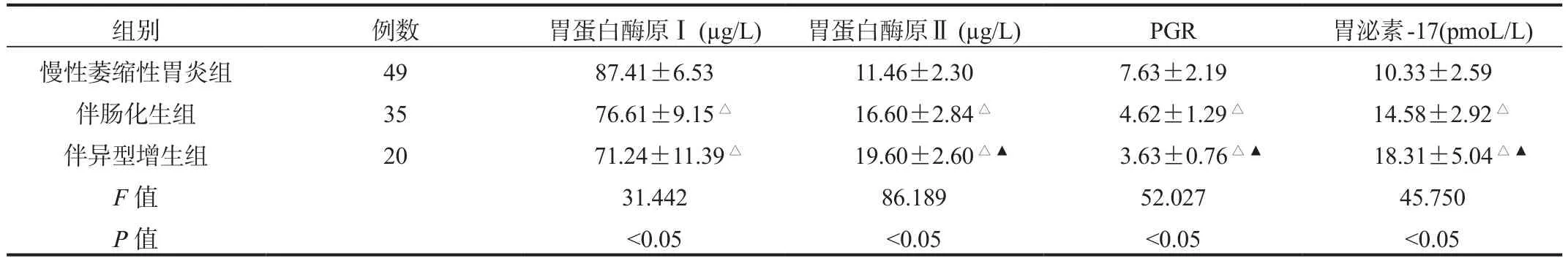
表2 不同癌前病变程度患者各类型胃蛋白酶原及胃泌素-17水平比较( ±s)
注:与慢性萎缩性胃炎组比,△P<0.05;与伴肠化生组比,▲P<0.05。
组别 例数 胃蛋白酶原Ⅰ(μg/L) 胃蛋白酶原Ⅱ(μg/L) PGR 胃泌素-17(pmoL/L)慢性萎缩性胃炎组 49 87.41±6.53 11.46±2.30 7.63±2.19 10.33±2.59伴肠化生组 35 76.61±9.15△ 16.60±2.84△ 4.62±1.29△ 14.58±2.92△伴异型增生组 20 71.24±11.39△ 19.60±2.60△▲ 3.63±0.76△▲ 18.31±5.04△▲F值 31.442 86.189 52.027 45.750 P值 <0.05 <0.05 <0.05 <0.05
2.3 各类型胃蛋白酶原和胃泌素-17与胃癌及癌前病变程度的相关性 以胃癌及癌前病变为因变量,各类型胃蛋白酶原和胃泌素-17为自变量,经Logistic回归分析显示,胃蛋白酶原Ⅰ、PGR高水平均是胃癌及癌前病变发生的危险因素,差异均有统计学意义(OR= 1.083、1.669,均P<0.05),胃蛋白酶原Ⅱ和胃泌素-17低水平均是胃癌及癌前病变的保护因素,差异均有统计学意义(OR= 0.823、0.744,均P<0.05),见表 3。
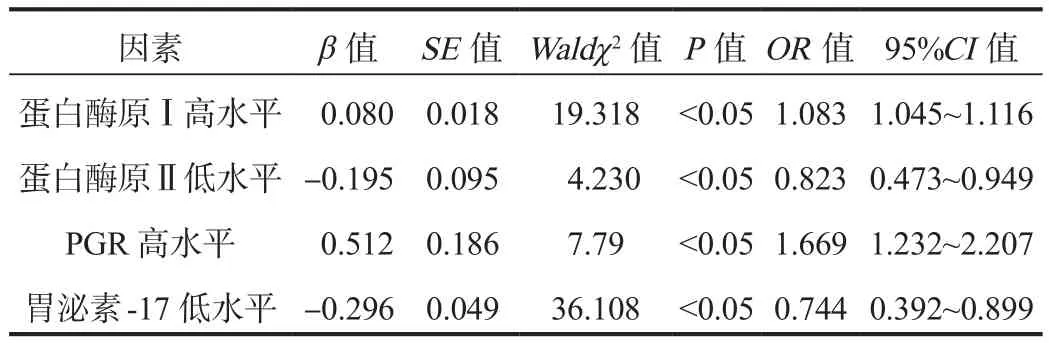
表3 胃癌及癌前病变程度与患者胃泌素-17和各类型胃蛋白酶原的关系
2.4 诊断效能 ROC曲线分析结果显示,胃蛋白酶原Ⅰ、胃蛋白酶原Ⅱ、PGR、胃泌素-17对胃癌癌前病变诊断的约登指数分别为 0.283、0.240、0.479、0.554,其中以胃泌素-17诊断价值最高,差异均有统计学意义(均P<0.05),见表4。
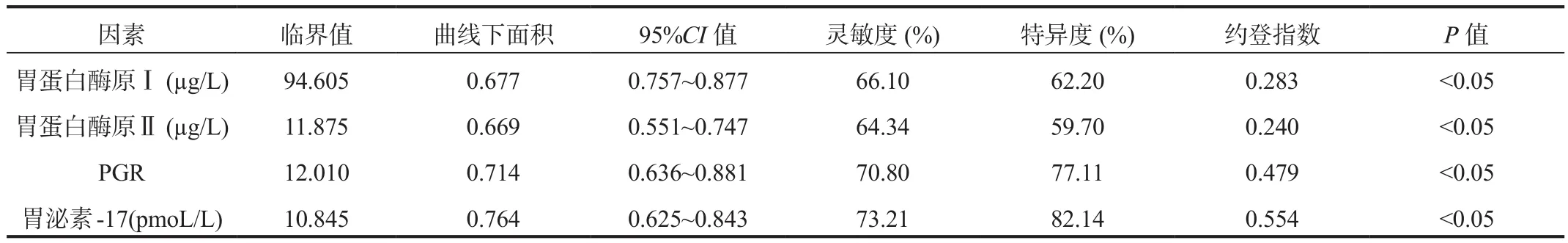
表4 胃泌素-17和各类型胃蛋白酶原对胃癌及癌前病变的诊断效能
3 讨论
胃癌发病多与幽门螺旋杆菌感染、遗传、饮食不洁、免疫低下及慢性胃部疾病等因素有关,胃癌发展的分子层面病理机制尚未明确的阐释,但临床多认为,其发展进程多由慢性胃炎发展为慢性萎缩性胃炎,再进展为肠上皮化生、异型增生,最后发展为黏膜内癌或浸润性癌[7]。有研究显示,部分异型增生患者和肠化生患者可表现为持续多年的不变状态,经过积极有效的治疗,甚至会逆转至正常或减轻,故及时发现异型增生或化生的胃癌癌前病变,并进行相应的干预对改善患者预后和转归意义重大[8]。
PG是胃蛋白酶前体,其主要由胃蛋白酶Ⅰ与胃蛋白酶Ⅱ构成,其中胃蛋白酶Ⅰ是由胃体和胃底的黏液颈部细胞产生;而胃蛋白酶Ⅱ是由全胃腺和近端十二指肠Brunner腺产生,在《中国早期胃癌筛查流程专家共识意见(草案)(2017年,上海)》[9]中提出,胃蛋白酶Ⅱ浓度和胃炎密切相关,随胃部黏膜肠化生、萎缩等病理样改变,假幽门腺化生,胃底腺萎缩,从而导致胃蛋白酶Ⅱ浓度上升,而泌酸腺减少,导致胃内呈现低酸状态,进而出现胃蛋白酶Ⅰ水平降低,胃蛋白酶Ⅰ与胃蛋白酶Ⅱ比值PGR水平相应下降的现象。胃泌素-17由胃窦G细胞分泌,可促进胃窦的分泌功能,增强胃肠道的运动,是反映胃窦分泌功能的敏感指标,常用于胃癌和萎缩性胃炎的诊断[10]。相关研究证实,胃泌素-17水平变化可提示胃窦黏膜萎缩状况或是否存在异常增殖等胃癌发生的风险[11]。本研究中,健康组、癌前病变组、胃癌组3组研究对象胃蛋白酶原Ⅰ、PGR均呈逐渐降低趋势,胃蛋白酶原Ⅱ、胃泌素-17均呈逐渐升高趋势,说明随着疾病的进展,胃癌癌前病变时期和癌变后患者机体胃蛋白酶原和胃泌素表达水平均有较大的改变,提示胃蛋白酶原和胃泌素表达水平可一定程度上反映疾病的严重程度和进展情况。
本研究进一步对癌前病变不同程度患者间各类胃蛋白酶原及胃泌素-17水平对比后发现,慢性萎缩性胃炎、伴肠化生和异型增生组患者各指标水平也具有显著差异,且随着病情的逐渐加重胃蛋白酶原Ⅰ、PGR均逐渐降低,胃蛋白酶原Ⅱ、胃泌素-17均逐渐升高,提示癌前病变不同阶段患者胃泌素和胃蛋白酶原各分型表达改变程度也不一样。其中伴异型增生组患者PGR水平均显著低于伴肠化生组、慢性萎缩性胃炎组,胃蛋白酶原Ⅱ、胃泌素-17均显著高于伴肠化生组、慢性萎缩性胃炎组,表明上述各项指标均对胃癌癌前病变的进程存在一定诊断价值。经Logistic回归分析结果可知,胃蛋白酶原Ⅰ、PGR高水平均是胃癌癌前病变发生的危险因素,胃蛋白酶原Ⅱ和胃泌素-17低水平均是癌前病变的保护因素,与陈卿奇等[12]研究中胃蛋白酶原Ⅰ和胃泌素-17为胃癌的独立危险因素的结果相似。本研究进一步进行ROC曲线分析,结果可见,胃蛋白酶原Ⅰ、胃蛋白酶原Ⅱ、PGR、胃泌素-17对胃癌癌前病变诊断的约登指数分别为0.283、0.240、0.479、0.554,其中以胃泌素-17最高,可能是因为胃蛋白酶原可反映胃整体黏膜情况,随着患者胃黏膜萎缩,患者胃部主细胞及腺细胞逐步减少,pH表现为低酸性,全胃分泌能力受到损坏,Ⅰ型酶原表达逐渐下降,而随着萎缩性慢性胃炎向肠化生和异型增生的进展,癌变后胃黏膜丧失胃蛋白酶原Ⅰ分泌能力,幽门腺取代胃主体细胞,Ⅱ型酶原表达大大增加,进而导致其比值也随之下降;而胃泌素-17主要由十二指肠G细胞及胃窦分泌,慢性萎缩性胃炎主要表现为胃窦和相关黏膜的萎缩,随着后期上皮内瘤变、肠上皮化生等病变的不断进展,可以导致癌细胞浸润破坏B淋巴细胞从而致使胃酸分泌减少,进而反馈性引起胃泌素-17升高[13]。对早期癌前病变患者进行胃蛋白酶原Ⅰ、胃蛋白酶原Ⅱ、PGR、胃泌素-17指标检测可以在一定程度上提高筛查准确率,但对于指标异常的患者仍需进一步检测更多的生物标志物以提升对疾病的诊断效能。
综上,胃癌癌前病变进程中,患者胃泌素和各类型胃蛋白酶原均会发生不同程度的改变,其中,胃蛋白酶原Ⅰ、PGR高水平均是胃癌癌前病变发生的危险因素,胃蛋白酶原Ⅱ和胃泌素-17低水平均是癌前病变的保护因素,临床可据其实验室水平指导癌前病变的筛查,并进行针对性干预,以延缓甚至逆转癌变进程,改善患者预后。但本研究受试者选取有限,且未对胃癌患者不同分型患者间相应指标水平进行对比,后期可扩大样本并细化胃癌患者分级分析,以期为临床胃癌实验室指标筛选提供更加准确的参考依据。
