低强度脉冲超声对食源性肥胖小鼠脂肪细胞肥大的作用及机制研究
2022-04-25徐天华舒环宇赵云晰孔祥清
李 禄,徐天华,舒环宇,赵云晰,孔祥清,孙 伟
南京医科大学第一附属医院心血管内科,江苏 南京 210029
食源性肥胖已经成为全球性的公共卫生问题,超重或肥胖人群数量在全球范围内持续增长[1],过多能量摄入造成白色脂肪组织的病理性扩增是导致食源性肥胖的重要原因。肥胖过程中脂肪组织会发生反应性生长重塑,主要表现为脂肪细胞的增生和肥大。脂肪细胞增生主要表现为功能正常的脂肪细胞数目增多,是糖代谢、胰岛素、瘦素等指标相对正常的一种适应性改变[2];而脂肪细胞肥大主要表现为脂肪细胞体积增大,同时伴有脂肪细胞功能障碍和胰岛素抵抗,是与2型糖尿病结局密切相关的重要病理性重塑[3-5]。脂肪细胞肥大是细胞内甘油三酯合成代谢大于分解代谢的结果。因此提高脂解水平、降低成脂能力,控制脂肪细胞肥大,减少白色脂肪的积聚扩张,是遏制肥胖进程,减少肥胖相关的代谢水平异常,提高肥胖患者预后的重要策略。
目前对于肥胖的治疗主要包括体育锻炼、限制高热量饮食等生活方式的干预,以及相关药物治疗。前者往往由于患者欠缺良好的依从性,无法达到理想的效果;潜在的药物不良反应又限制了后者的广泛应用,且目前尚无针对肥大脂肪细胞并改善其病理状态的临床药物。因此迫切需要一种依从性好、更安全、不良反应小的新方法来治疗肥胖。
低强度脉冲超声(low-intensity pulsed ultrasound,LIPUS)是一种安全性高、无创且穿透性强的治疗超声,以脉冲波的形式输出,其主要利用声波的机械振动产生柔和持续的能量,能量强度远低于高强度聚焦超声(<500 mW/cm2)[6],而不会对器官造成损害[7-8]。本团队之前的研究已经发现利用LIPUS 体外辐照可促进脂肪间充质干细胞凋亡[9],抑制前脂肪细胞成脂分化[10],而LIPUS 是否能在体内改善脂肪细胞的肥大状况尚不清楚。本研究拟建立食源性肥胖小鼠,并对其进行超声干预,研究LIPUS对脂肪组织的生物学效应,并阐明其效应的分子学基础,为肥胖患者的临床治疗提供一种安全、无创、易转化的新思路。
1 材料和方法
1.1 材料
C57BL/6J雄性小鼠(北京维通利华实验动物技术有限公司);60% kcal 脂肪的高脂饲料(D12492)和10%kcal脂肪的低脂对照饲料(D12450J)(Research Diets 公司,美国);甘油三酯检测试剂盒(南京建成生物工程所);4%多聚甲醛(合肥白鲨生物公司);PBS缓冲液(Gibco公司,美国);DEPC水(上海碧云天生物技术有限公司);TRIzol、逆转录试剂盒(TaKaRa公司,日本);SYBR Green Master Mix(南京诺唯赞公司);qPCR 引物(南京金斯瑞生物科技有限公司);蛋白酶抑制剂、磷酸酶抑制剂(罗氏集团股份有限公司,瑞士);RIPA 裂解液、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、5 × 蛋白上样缓冲液、BCA 蛋白定量试剂盒(上海碧云天生物技术有限公司);牛血清白蛋白(bovine serum albumin,BSA)(Sigma公司,美国);十二烷基硫酸钠聚丙烯酰胺凝胶快速制备试剂盒(上海雅酶生物科技有限公司);二氟乙烯(polyvinylidene fluoride,PVDF)膜(Merck Millipore 公司,美国);增强型化学发光(ECL)试剂(ThermoFisher 公司,美国);GAPDH 抗体、β-tubulin 抗 体、C/EBPα 抗 体、Phospho-HSL(ser563)抗体、Phospho-HSL(ser660)抗体、HSL 抗体、ATGL抗体、Phospho-ERK1/2抗体、ERK1/2抗体、BAX 抗体、BCL-2 抗体(Cell Signaling Technology 公司,美国);PKA(催化亚基)抗体、PPAR-γ抗体(武汉赛维尔生物科技有限公司);辣根过氧化物酶标记山羊抗小鼠IgG、辣根过氧化物酶标记山羊抗兔IgG(北京中杉金桥公司)。
1.2 方法
1.2.1 实验设计
4 周龄C57BL/6J 雄性小鼠随机分为两组,普通饮食组(普食组,10% kcal 脂肪的低脂对照饲料喂养,n=10)和高脂饮食组(高脂组,60% kcal 脂肪的高脂饲料喂养,n=20)。动物每天自由摄食饮水,每48 h 称量并添加食物,同时称取未摄食完的食物,以评估食物摄入量,每周记录1次体重。在连续喂养10 周后,高脂组小鼠根据体重配对,并随机分为两组,继续高脂喂养。其中一组开始对腹股沟区脂肪垫进行LIPUS治疗(超声组,n=10),另一组除不接受LIPUS 辐照外,其余条件均与超声组保持一致。连续治疗10 周后对3 组小鼠实施安乐死。采集小鼠全血样本,超声路径下的皮肤、肌肉,分离小鼠靶区的腹股沟脂肪垫并称重,液氮速冻后将其保存于-80 ℃超低温冰箱,后续进行Western blot 和qPCR 分析。部分标本采用4%多聚甲醛固定,石蜡包埋后行HE染色。本研究已通过南京医科大学实验动物伦理委员会审查(IACUC-2008020)
1.2.2 超声方案
LIPUS 治疗设备包括超声波发生器(Agilent Technologies,美国)、宽频功率放大器(Verasonics 公司,美国)和超声平面换能器(重庆海扶医疗科技股份有限公司)。参考前期体内外研究结果[9-11],实验使用频率0.5 MHz 的平面换能器,在声强达到77.20 mW/cm2时对靶区脂肪组织进行治疗。超声组小鼠在1.5%异氟烷麻醉下进行LIPUS超声辐照,每周3次(20 min/次)连续治疗10周。
1.2.3 组织石蜡切片HE染色
取小鼠超声路径下皮肤、肌肉及腹股沟脂肪垫,用4%多聚甲醛固定组织48 h,将标本脱水,石蜡包埋,切片厚度5 μm。组织切片依照HE 染色标准方案进行,封片后镜下观察,采集图像。
1.2.4 甘油磷酸氧化酶-过氧化物酶(glycerol phosphate oxidase-p-aminophenazone,GPO-PAP)法测定组织内甘油三酯含量
取小鼠新鲜分离的靶区腹股沟脂肪组织,使用分析天平精确称重使其重量控制在100 mg左右,按重量(mg)∶体积(μL)=1∶9的比例加入9倍体积的匀浆介质无水乙醇,冰水浴条件下机械匀浆直至组织彻底破碎。4℃2 500 r/min 离心10 min,取上清,根据甘油三酯检测试剂盒说明书进行检测计算。
1.2.5 脂肪组织RNA提取及qPCR
使用TRIzol 试剂从150 mg 腹股沟脂肪组织中提取总RNA,0.5 μg总RNA逆转录合成第一链互补cDNA。将合成的cDNA 与SYBR Green Master Mix、基因特异的引物混合,采用ABI Prism 7900 系统进行qPCR扩增。每个样本进行3次重复分析,目标基因由管家基因GAPDH 归一化。所有qPCR 引物见表1。

表1 qPCR引物Table 1 Primers for qPCR
1.2.6 脂肪组织蛋白提取及Western blot
称取150 mg 脂肪组织于500 μL RIPA 裂解液中,加入蛋白酶抑制剂、磷酸酶抑制剂和PMSF,冰水浴下机械匀浆直至组织破碎彻底,于-80 ℃低温保存,第2 天取出组织于冰上复温,12 000g、4 ℃条件下离心30 min 吸弃上层脂肪,重复3 次直至上层脂肪去除干净。最后一次12 000g离心15 min,去除沉淀,获得蛋白上清液。制备8%~12%SDS-PAGE胶,进行蛋白电泳分离总蛋白,将蛋白转移至PVDF膜,于5%牛血清白蛋白溶液中常温孵育2 h,后于一抗溶液(1∶1 000 稀释)中4℃孵育过夜,漂洗后再与辣根过氧化物酶标记的二抗(1∶5 000 稀释)室温下孵育2 h。漂洗后使用ECL 试剂和化学成像仪进行化学显影,使用Image LabTM软件对图像进行量化。
1.3 统计学方法
所有数据均来自3个独立实验,数据采用Excel 2019(16.0)录入,计量资料经检验,数据符合正态分布,方差齐,结果以均数±标准差()表示,应用GraphPad Prism 8.0 软件进行统计学分析和作图,多组间比较使用单因素方分析,事后检验使用Bonferroni法。P<0.05为差异具有统计学意义。
2 结果
2.1 LIPUS局部辐照无法减轻肥胖小鼠体重
在连续喂养10周后,高脂组小鼠体重大于普食组小鼠体重,且差异有统计学意义(P<0.001,表2),认为肥胖模型建立成功。超声组小鼠腹股沟脂肪垫经过10周LIPUS辐照后,超声组与高脂组小鼠体重及体重增量均无显著性差异(表2,图1),提示LIPUS无法减轻食源性肥胖小鼠体重。
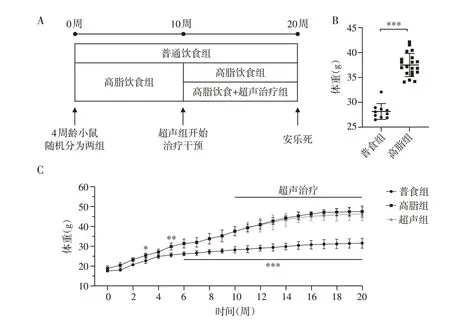
图1 LIPUS局部辐照无法减轻肥胖小鼠体重Figure 1 Local LIPUS stimulation could not reduce the body weight of obese mice
表2 20周后普食组、高脂组和超声组小鼠代谢相关指标Table 2 Metabolism associated parameters after 20 weeks of NC diet feeding,HFD feeding and LIPUS treated mice()
表2 20周后普食组、高脂组和超声组小鼠代谢相关指标Table 2 Metabolism associated parameters after 20 weeks of NC diet feeding,HFD feeding and LIPUS treated mice()
体重增量=最终体重-初始体重;脂质摄入量=摄食量×饲料脂质成分百分比;热量摄入量=摄食量×饲料能量密度。普食组食用10%kcal脂肪的低脂对照饲料,脂质成分占比4%,能量密度3.85 kcal/g,高脂组和超声组食用60%kcal 脂肪的高脂饲料,脂质成分占比35%,能量密度5.24 kcal/g。与普食组比较,*P <0.001;与高脂组比较,#P <0.001。
2.2 LIPUS的体内安全性评价
为了评估超声辐照对机体组织器官的安全性,密切关注了超声组小鼠在超声前后的基本行为和生活状态变化,并与高脂组进行比较。干预结束后取超声路径下的组织进行HE 染色,并通过Western blot评估靶区脂肪组织凋亡分子表达。结果显示,在超声干预期间,超声组小鼠未见焦躁、好斗等异常的行为学改变,超声前后生活状态无显著差异,与高脂组小鼠相比,热量摄入稳定(表2),体重变化平稳(图1C)。超声组小鼠的各项血液学指标、肝肾功能相关指标(表3)与高脂组小鼠相比均未见明显异常。小鼠超声靶区脂肪组织凋亡相关分子Western blot 结果提示LIPUS 不会在细胞层面上损伤细胞并促进其凋亡(图2A、B),超声穿透路径组织(皮肤和肌肉)HE染色切片中未见有显著组织损伤和炎症浸润(图2C)。以上初步结果表明LIPUS在该治疗剂量下具有良好的生物安全性和长期应用可行性,同时仍有待更全面的研究评估LIPUS的体内安全性。
表3 全血细胞计数和血生化评估LIPUS体内安全性Table 3 Safety tests of LIPUS in vivo with complete blood counts and plasma biochemical profile()

表3 全血细胞计数和血生化评估LIPUS体内安全性Table 3 Safety tests of LIPUS in vivo with complete blood counts and plasma biochemical profile()
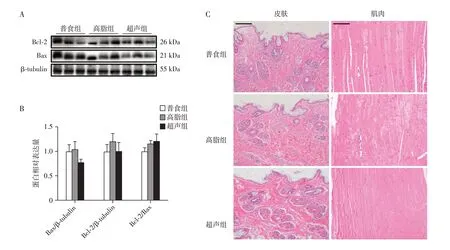
图2 LIPUS在体内的安全性评估Figure 2 Safety tests of LIPUS in vivo
2.3 LIPUS 显著减轻超声靶区脂肪重量并抑制了脂肪细胞的肥大
当声强达到77.20 mW/cm2时,经过10 周LIPUS治疗,超声组小鼠局部腹股沟脂肪组织含量显著减少,重量显著减轻(表2,图3A、B)。HE染色结果显示,LIPUS 抑制了腹股沟脂肪细胞的肥大(图3C、D)。与非超声组肥胖小鼠相比,超声组小鼠腹股沟脂肪组织内TG含量显著降低(图3E)。
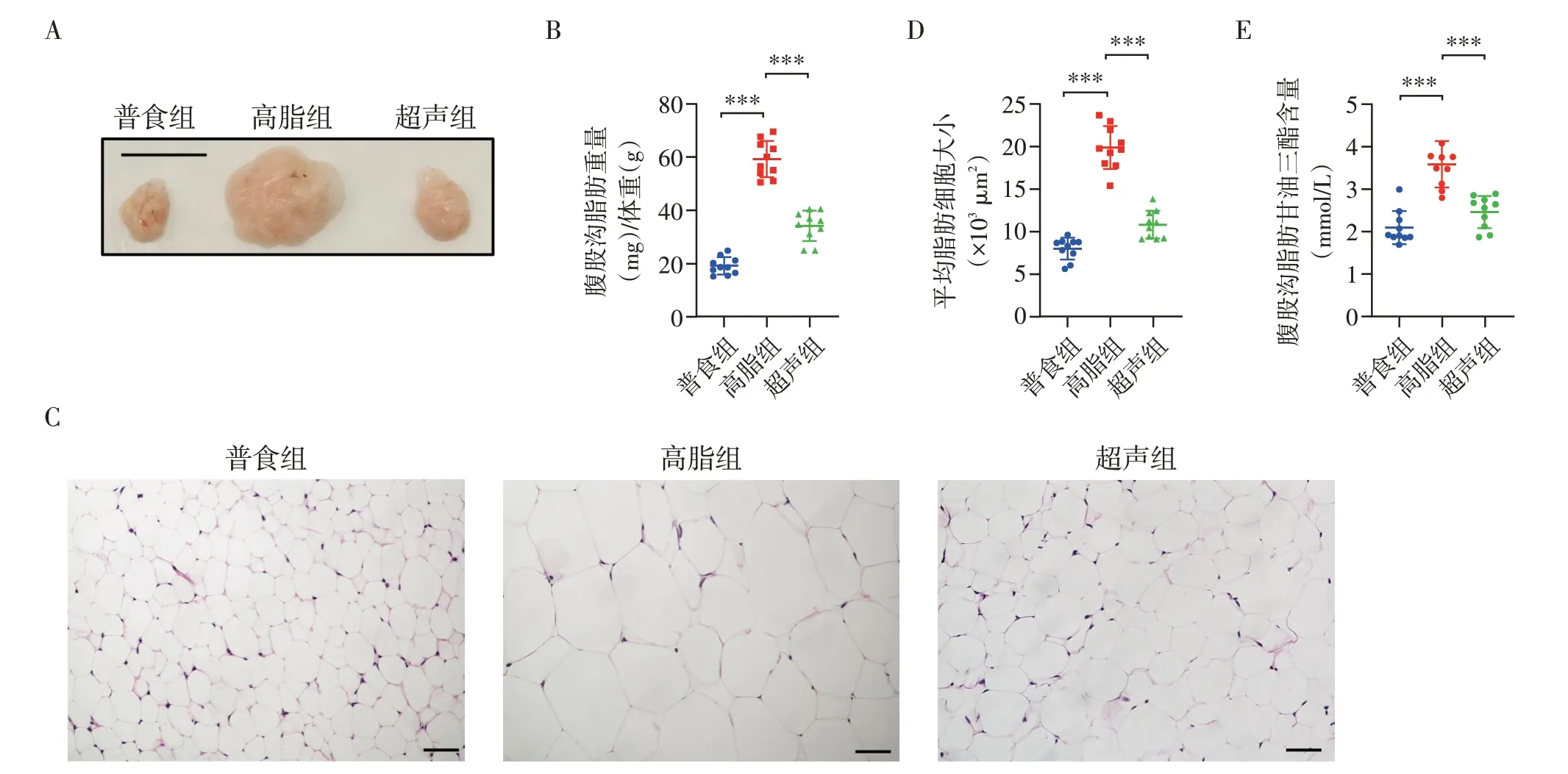
图3 LIPUS显著减轻超声靶区脂肪重量并改善了脂肪细胞的肥大Figure 3 LIPUS significantly reduced fat weight and improved hypertrophic adipocytes at the irradiation area
2.4 LIPUS 能够下调脂肪细胞成脂分化转录因子的表达
利用qPCR技术检测关键成脂分化转录因子,过氧化物酶增殖物激活受体γ(peroxisome proliferatoractivated receptor γ,PPAR-γ)、ccaa/增强子结合蛋白α(ccaa/enhancer-binding protein,C/EBPα)的mRNA表达量。与普食组相比,高脂组PPAR-γ和C/EBPα的mRNA 水平明显增加,而超声组显著低于高脂组,LIPUS 明显抑制了PPAR-γ和C/EBPα的转录水平(图4A);利用Western blot 技术检测PPAR-γ和C/EBPα的蛋白表达水平,高脂喂养使成脂分化转录因子PPAR-γ和C/EBPα蛋白表达显著升高,而超声干预显著下调C/EBPα表达量,使其接近普食水平,PPAR-γ也呈现一定下降趋势,但差异无统计学意义(图4B、C)。同时,LIPUS也增加了脂联素(adiponectin,ADPN)的转录水平,降低了瘦素(leptin,LEP)的mRNA水平,改善了高脂饮食导致的脂肪细胞因子的紊乱表达(图4D)。
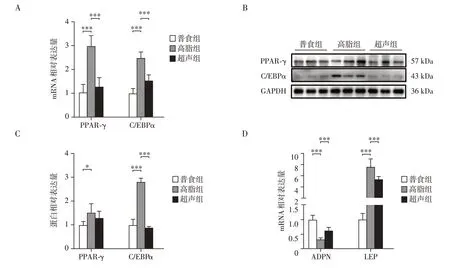
图4 LIPUS下调脂肪细胞成脂转录调控因子的表达Figure 4 LIPUS downregulated the expression of transcription factors for adipogenic differentiation in adipocytes
2.5 LIPUS能够激活脂肪细胞脂解相关的信号通路
为进一步明确超声改善靶区脂肪细胞肥大的分子机制,利用Western blot 技术检测脂解相关通路分子的蛋白表达水平,其中甘油三酯脂肪酶(adipose triglyceride lipase,ATGL)和激素敏感性脂肪酶(hormone-sensitive lipase,HSL)是脂解关键的两个脂肪酶。高脂饮食使ATGL 及其上游调控基因,包括干扰素调节因子4(interferon regulatory factor 4,IRF4)和叉头框蛋白O1(forkhead box O1,FoxO1)表达量显著下调,而LIPUS 干预可显著恢复其表达水平。超声辐照可显著提高HSL 转录水平(图5A),同时对HSL蛋白水平的影响主要表现在对其磷酸化激活上,HSL 在丝氨酸563 位点和丝氨酸600 位点磷酸化的表达量均有显著提高(图5B、C)。HSL的磷酸化激活主要有两种方式,分别是蛋白激酶A(protein kinase A,PKA)依赖[12]和细胞外信号调节激酶(extracellular signal-regulated kinase 1/2,ERK1/2)依赖[13]的途径,其中,PKA 可以使HSL在丝氨酸563和660位点磷酸化激活,激活的ERK1/2使HSL在丝氨酸660位点磷酸化激活。磷酸化激活的ERK1/2 以及PKA 在高脂组表达显著低于普食组,超声辐照可显著恢复其表达水平(图5C)。以上结果提示LIPUS 可显著上调脂解酶ATGL 的表达,并通过PKA 和ERK1/2 激活的方式促进HSL 磷酸化,从而提高脂解水平。
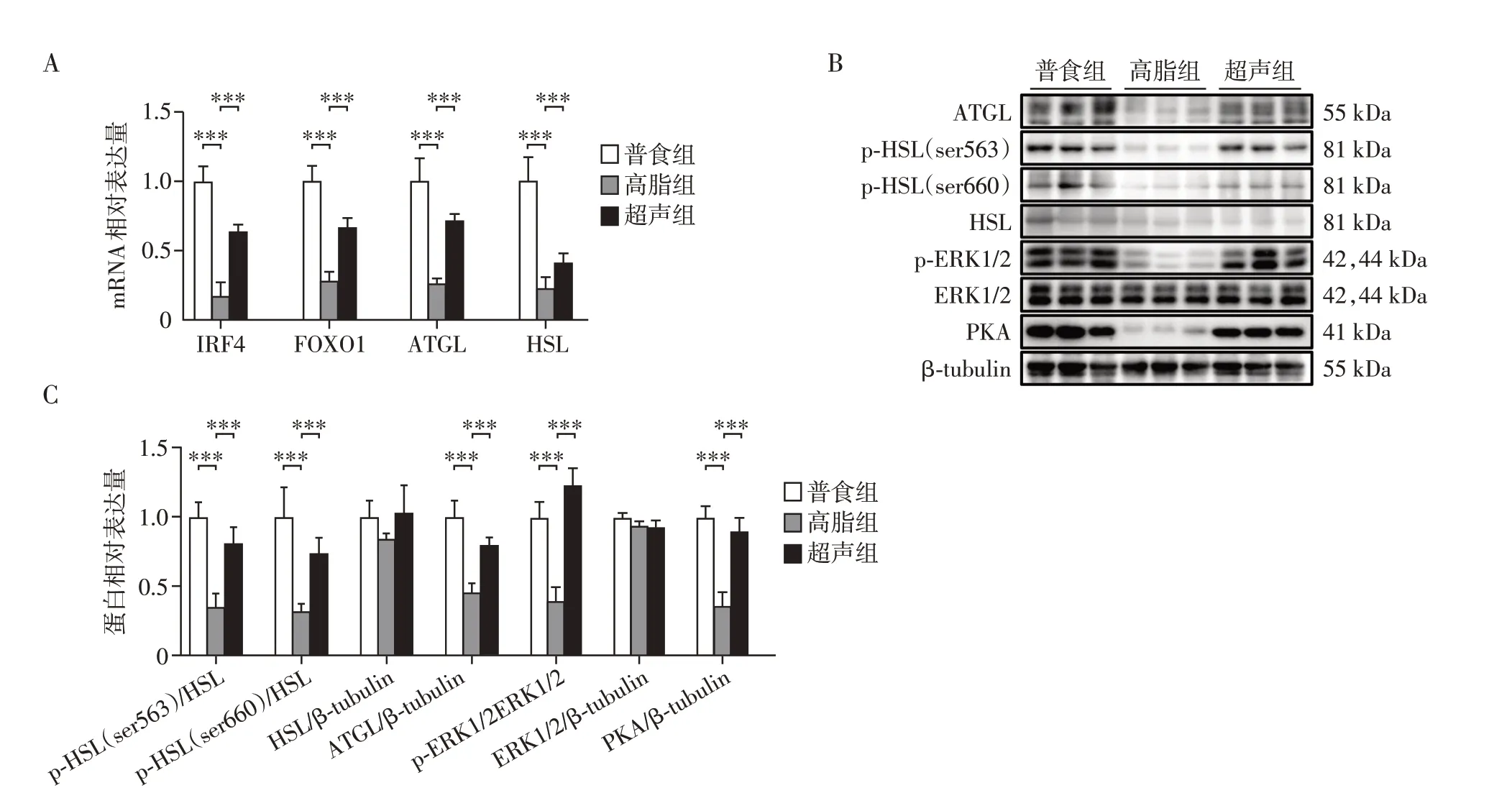
图5 LIPUS激活脂肪细胞脂解相关的信号通路Figure 5 Activation of adipocyte lipolysis related signaling pathways by LIPUS
3 讨论
食源性肥胖是热量摄入过多造成的,表现为以储能为主要功能的白色脂肪成脂活动强于脂解活动而积聚扩张肥大,而目前临床尚缺乏一种依从性高、安全有效、无创、易转化的干预方法。此前有体外研究表明LIPUS对内脏前脂肪细胞成脂分化具有抑制作用[10],但LIPUS 在体内是否能抑制脂肪细胞的肥大尚不明了。本研究首次发现LIPUS可以通过提高脂解酶表达水平,降低成脂分化转录因子表达,改善脂肪细胞肥大。同时本研究也首次证明LIPUS可激活脂肪细胞内PKA 和ERK1/2 相关的信号通路,提高HSL磷酸化水平,从而促进下游脂解。
PPAR-γ和C/EBPα是重要的成脂分化转录因子,通过上调乙酰辅酶A 羧化酶(acetyl-CoA carboxylase,ACC)和脂肪酸合酶(fatty acid synthase,FAS)促进甘油三酯的合成和脂肪的积累。本研究发现LIPUS 可显著下调高脂饮食诱导的PPAR-γ和C/EBPα的mRNA高表达,以及C/EBPα的蛋白水平,从而起到下调下游成脂分化信号的作用,降低成脂分化水平。在脂解方面,LIPUS促进了ATGL和HSL的转录水平,而ATGL转录水平的升高,也可能归因于其转录调控因子(IRF4和FoxO1)的作用。已有研究证实IRF4 和FoxO1 均可结合于ATGL 的启动子,其过表达均可上调ATGL和HSL的转录水平并促进脂解[14-15],这与本研究的结果一致。除脂解酶的表达量升高外,HSL 显著增多的磷酸化激活也是提高脂解水平的重要途经,本研究证实LIPUS 以PKA 和ERK1/2激活的方式促进HSL在丝氨酸563和丝氨酸660两个位点上的磷酸化,而以往研究表明,这将促使HSL 移位至脂滴表面并充分发挥水解活性[16]。此外,有研究证实磷酸化ERK1/2 还可通过减少PPAR-γ的表达来下调脂肪细胞成脂水平[17]。
瘦素和脂联素均主要由皮下白色脂肪产生[18-19],瘦素水平可以间接反映体内脂肪含量,肥胖机体内往往伴随着高瘦素水平,这与脂肪炎症和胰岛素抵抗密切相关[19]。而脂联素水平在肥胖时往往下降[20-21],研究表明其与胰岛素抵抗也存在着密切相关性[22]。本研究发现LIPUS在转录水平改善了瘦素抵抗性增高,并显著上调了脂联素的表达,表明LIPUS 可能会影响靶区脂肪细胞因子的合成,且具有抵抗脂肪炎症和改善胰岛素抵抗的倾向性。这为将来LIPUS应用在内脏脂肪提供了重要的实验基础。由于内脏脂肪垫对系统性代谢的影响更为显著[23],而LIPUS 如能类似地改善肥大的内脏脂肪细胞代谢状况,其对肥胖个体的胰岛素抵抗、脂肪炎症的改善将更为有效,这将为全球高达数亿的肥胖人口提供全新的治疗理念和干预方案。
本研究中使用的肥胖小鼠模型更接近实际的肥胖人群,这对未来LIPUS 的临床转化提供更贴合实际的研究支撑。此外,相较于高强度聚焦超声对细胞的破坏作用[24],LIPUS 更加柔性的能量使其具有更高的生物安全性,即使接受长期的干预治疗也往往不会对体内组织器官产生破坏作用,同时其作用方式的局部性也使其对远隔组织器官的影响大大降低,这对机体内环境稳态的维持及患者接受治疗时依从性的提高大有裨益。以上都有利于LIPUS的临床转化应用。
总之,本研究基于一种全新、无创、安全、依从性好、易于转化的LIPUS 平台,发现LIPUS 可以促进食源性肥胖小鼠靶区脂解水平,并下调成脂分化的调控因子,使脂解水平高于成脂水平,最终缩小脂肪细胞大小,改善脂肪组织肥大,这为临床治疗食源性肥胖患者提供了重要的实验依据和新思路。
