有氧运动联合外源性脑源性神经营养因子协同增强心肌血管生成效应
2022-04-25王碧蕾夏宝妹王锦玉
王碧蕾,夏宝妹,金 虹,王锦玉
1南京特殊教育师范学院康复科学学院医学康复教研室,江苏 南京 210038;2东南大学附属中大医院心血管内科,3康复医学科,江苏 南京 210009
《中国心血管健康与疾病报告2020 概要》指出,我国心血管疾病的患病率处于持续上升阶段,心血管病死亡占城乡居民总死亡原因的首位,已成为威胁我国公众健康的重要因素[1]。心肌梗死(myocardial infarction,MI)是心血管疾病最严重的结果之一。虽然经皮冠状动脉介入治疗及药物干预降低了急性心肌梗死的病死率,但长时间的心肌缺血、缺氧导致心肌细胞坏死或凋亡,心肌梗死区发生心室重构,逐渐发展为慢性心功能不全,严重影响患者的生活质量,给家庭和社会带来巨大的经济负担。
指南推荐规律的有氧运动训练是保持心血管健康的重要因素,也是MI后心脏康复的重要组成部分[2-3]。中、高强度有氧或抗阻运动均可增加心肌组织血管密度[4-5],运动中增高的血液层流剪切力(laminar shear stress,LSS)发挥重要介导作用[6]。中等强度有氧运动要求的时间较长(30~60 min)且需达到一定强度(运动时心率为最大心率的60%~85%)。然而,大量患者因高龄、重症、体弱或并发症等原因不能保证充分的运动训练,从而限制了该种运动方式的推广;另外,心血管疾病的危险因素也可能损害血管结构对运动训练的适应。所以,积极探寻诱导或强化运动效果、提高运动获益的治疗方法,可以为MI患者带来广泛获益。
脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)属于神经营养因子家族,是一种小分子二聚体蛋白质,通过与其高亲和力受体原肌球蛋白激酶受体B(tyrosine kinase receptor B,TrkB)结合发挥生物效应。我们前期研究证实BDNF 介导了运动的血管保护效应,运动可增加MI 大鼠血清BDNF 水平,且与其心肌血管密度和心功能改善程度密切相关[7]。但考虑到大量患者存在高血压、糖尿病等并发疾病,其内皮功能不佳、BDNF 分泌能力不足,可能影响其运动效果,那么在运动的同时外源性补充BDNF 是否可促进运动效应更好地发挥?
本研究体外构建12 dyn/cm2LSS 模拟运动对血管壁的生理效应,观察循环中BDNF 水平对TrkB 及其下游Akt 通路激活的影响;利用MI 大鼠模型,从整体水平探讨外源性补充BDNF是否可协同有氧运动强化其心肌血管生成及心功能改善的效应,为临床探求更为理想的诱导或强化运动获益的途径。
1 材料和方法
1.1 材料
1.1.1 实验动物
实验选用健康雄性SPF 级SD 大鼠60 只,体重220~250 g、12 周龄,由中国科学院上海实验动物研究中心提供[许可证号:SCXK(沪)20130006]。饲养于东南大学实验动物中心,室温保持20~25 ℃,湿度(55±10)%,昼夜明暗交替时间10~14 h,噪音<60 dB,大鼠自由饮食和饮水。动物购买后在实验前分笼适应实验室环境饲养1周,4只/笼,期间统一适应性跑台训练5 d,每天10 min。所有动物实验均经东南大学实验动物福利伦理委员会批准(伦理号:20200406021)。
1.1.2 主要材料和试剂
HUVEC 由东南大学医学院心血管病研究所提供。ECM 培养基(Sciencell 公司,美国),胰酶(Hyclone公司,美国),胎牛血清(杭州四季青公司),人重组BDNF(human recombinant brain-derived neurotrophic factor,rhBDNF)(Proteintech 公司,美国),羊抗BDNF 多克隆抗体、兔抗TrkB 多克隆抗体、兔抗TrkB(phospho Y515)多克隆抗体、β-actin 多克隆抗体(Abcam 公司,英国),抗羊二抗(Thermo Fisher Scientific 公司,美国),兔抗CD34 多克隆抗体、兔抗Akt多克隆抗体、兔抗磷酸化Akt多克隆抗体(Sigma-Aldrich 公司,美国),抗兔二抗(北京中衫金桥生物技术有限公司),羊抗兔FITC(Proteintech 公司,美国),即用型免疫组化试剂盒(福州迈新生物技术开发有限公司),DAB显色试剂盒(北京中衫金桥生物技术有限公司),BDNF检测试剂盒(R&D Systems公司,美国),Transwell 小室(Corning 公司,美国),Matrigel 基质胶(BD Bioscience 公司,美国),平行板流动小室(华西医学中心生物工程研究室),动物跑步机(成都泰盟软件有限公司)。
1.2 方法
1.2.1 流室系统装配和细胞干预
系统装配:本系统由流室系统和灌流系统两部分组成,包括蠕动泵、流室、储液槽和医用硅胶管道等(图1)。蠕动泵为本系统提供稳定的常定流。流室系统是由有机玻璃制成的盒装结构(包括流入仓、剪切力发生仓和流出仓),为保证流动液以均匀速度通过相同缝隙流入发生仓,两端的流入仓和流出仓分别外接灌流系统。灌流液以固定流量由蠕动泵泵出后经管道进入流室系统而对HUVEC 施加剪切力,后经管道流回储液槽,灌流液循环利用。也可在流入、流出口分别放置储液槽,一端提供新鲜培养液,一端接收流出液,灌流液非循环利用。
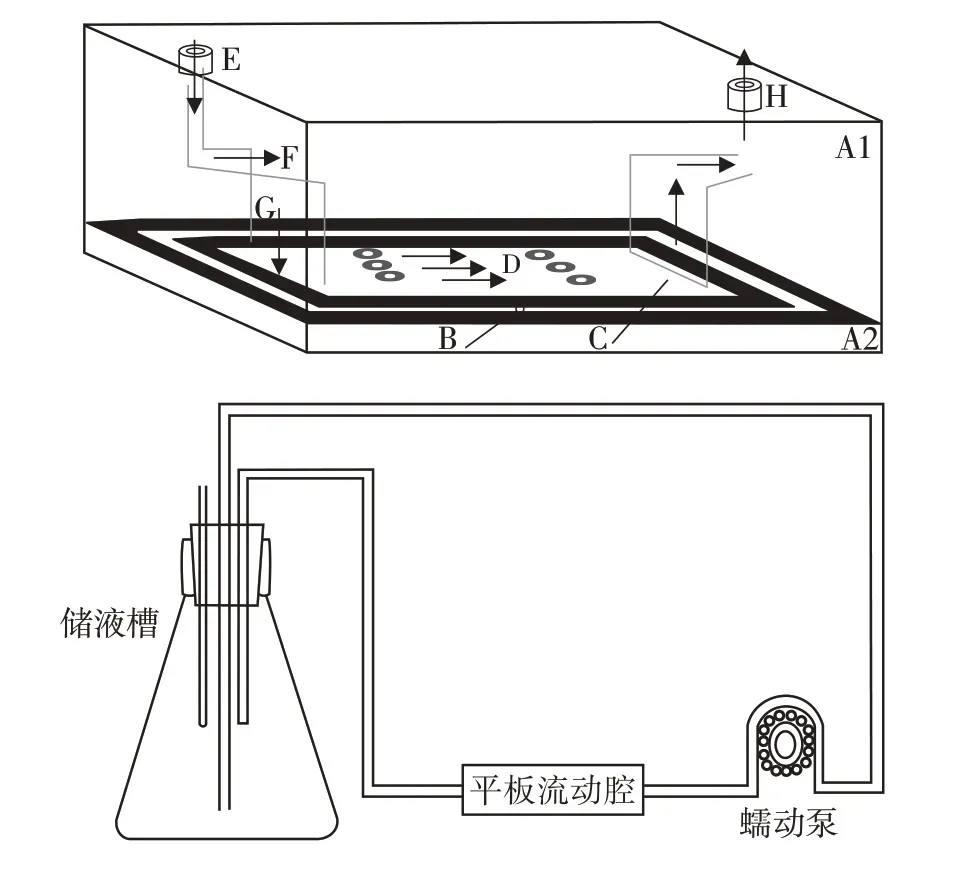
图1 平行板流动小室系统(循环流体)Figure 1 Parallel plate flow cell system(circulating flow)
流量流速计算:剪切力SS 与流量Q、流室尺寸之间的计算公式为SS=6ηQ/WH2(η为灌流液的黏度,Q 为循环液的流量,W 为流室宽度,H 为流室高度)。本实验中η=0.765 1 dyn/cm2,W=2.57 cm,H=0.04 cm,SS=12 dyn/cm2,Q=0.050 7 mL/s。
流体剪切力的加载:载玻片经高压消毒灭菌后,放入超净台中风干,并使用0.2%多聚赖氨酸包被。将包被好的载玻片用PBS 清洗3 遍,再将培养至第2~5 代的细胞接种于载玻片上,放入培养皿,静置2 h待细胞贴壁后,往培养皿中加入培养基,置于培养箱中继续培养待细胞长满80%后部分继续静止培养,取出置于流室系统中进行实验。流室系统装备完善后,在储液槽中加入ECM培养基,开启蠕动泵,产生LSS 作用于HUVEC;LSS 分别由非循环流体、循环流体、循环流体加入人重组BDNF(50 ng/mL)[8]产生。
1.2.2 ELISA检测循环流体BDNF浓度
收集LSS 干预0、15、30、60 min 时段的循环流体。96 孔板前2 列为标准曲线孔,按照试剂盒说明书给出的浓度使用标准品稀释液稀释相应标准品;按照1∶4加入样品稀释液稀释样品100 μL/孔,室温孵育过夜。严格按照试剂盒说明书检测各时段循环流体中BDNF的浓度。
1.2.3 Western blot检测蛋白表达及磷酸化水平
在LSS 干预的0、15、30、60 min 检测BDNF、TrkB 蛋白表达及TrkB、Akt 磷酸化水平。细胞裂解液提取各组细胞样本总蛋白,采用BCA法对蛋白含量进行定量检测。与上样缓冲液按比例混合均匀后煮沸5 min,进行SDS-PAGE 凝胶电泳后转膜,5%脱脂奶粉溶液常温封闭1 h,分别加入1∶200稀释的抗BDNF、1∶50 稀释的抗TrkB、1∶50 稀释的抗TrkB(phospho Y515)、1∶800 稀释的抗Akt 多克隆抗体和兔抗磷酸化Akt多克隆抗体,4 ℃下孵育过夜,TBST缓冲液洗涤3次、10 min/次;随后以1∶800稀释的二抗室温孵育1 h,TBST 缓冲液洗涤3 次、15 min/次,加入化学发光试剂显色,胶片行显影、定影后扫描。
1.2.4 Transwell小室测定HUVEC迁移能力
将HUVEC随机分为对照组(Ctrl 组)、非循环SS组、循环SS组、BDNF组、循环SS+BDNF组,干预6 h后取出,消化重悬细胞,调整为5×108个/L,吸取0.1 mL细胞悬液加入上室,置于37 ℃、5% CO2培养箱中,18 h 后取出滤膜,4%多聚甲醛固定10 min,PBS 冲洗,棉签拭去上室表面内残存细胞,结晶紫染色。显微镜下随机选取5 个清晰的视野拍照,计算每个视野穿膜细胞数取平均值。
1.2.5 小管形成实验检测HUVEC体外血管生成能力
将HUVEC随机分为对照组(Ctrl 组)、非循环SS组、循环SS组、BDNF组、循环SS+BDNF组,干预6 h后取出,消化重悬细胞,调整为5×107个/L。将细胞外基质胶溶解后铺于96 孔板,细胞培养箱中孵育60 min。将上述细胞悬液加入96孔板(300 μL/孔),每组设置3 个复孔,继续培养18 h。每组随机选取5 个视野于倒置显微镜下观察、拍照并统计其每个视野下小管形成数量,取均值。
1.2.6 动物造模、分组和干预措施
雄性SD 大鼠随机分为5 组、每组12 只,分别为假手术组(Sham)、心肌梗死组(MIC)、心肌梗死+BDNF 组(MICB)、心肌梗死+运动组(MIE)、心肌梗死+运动+BDNF 组(MIEB)。心梗模型制备:使用戊巴比妥钠(0.2 mL/10 g)腹腔注射麻醉,建立呼吸支持,行冠状动脉左前降支结扎术,结扎成功后,左心室前壁会变苍白并且运动异常,逐层关胸。假手术组只开胸穿线,不结扎冠状动脉,手术时间与其他组匹配。有氧运动:参照Morais等[9]的方法,采用跑台的方式进行有氧运动训练。心梗手术后1周开始跑台适应训练,训练时长从10 min/d 开始,逐日增加,至第5 天达到60 min/d 并长期维持至训练结束。训练速度从5 m/min开始,逐渐增加到20 m/min并长期维持至训练结束。跑步机坡度从0°开始,逐渐增加到25°。每周训练5 d、休息2 d,共训练4周。MICB 和MIEB 组大鼠在运动前10 min 尾静脉注射BDNF蛋白0.4 μg/kg[10-11]。
1.2.7 心功能检测
心梗手术后1 周、运动方案实施前以及最后一次运动训练完成后48 h,每组分别取6只大鼠,异氟烷吸入麻醉下进行经胸超声心动图检测,用来评估心功能。选取频率为12 MHz 的超声探头进行心脏大小和功能参数的采集,用高分辨率超声Vevo770系统进行数据分析。探头放置于大鼠左前胸,在心脏乳头肌水平进行M 型超声检测,测量舒张末期左心室内径(left ventricular internal diameter at enddiastole,LVIDd)、收缩末期左室内径(left ventricular internal diameter at end-systolic,LVIDs),系统自动算出射血分数(left ventricular ejection fraction,LVEF)、短 轴 缩 短 率(left ventricular fraction shortening,LVFS)。所有检测指标均取3个心动周期的平均值,超声测量依据美国超声心动图学会制定的标准。
1.2.8 免疫组化检测心肌血管密度
最后一次运动训练完成后3 h,每组取6 只大鼠,迅速摘取大鼠心脏,沿心梗结扎线以下取部分左心组织经4%多聚甲醛固定,石蜡包埋后切片,常规脱蜡至水,经抗原修复后,用3% H2O2消除内源性过氧化物酶活性,抗原修复,滴加兔抗CD34多克隆抗体4 ℃过夜,PBS 冲洗3 次,加入二抗37 ℃孵育60 min,PBS 冲洗3 次,用DAB 显色,再经苏木素复染,最后脱水、透明、封片。显微镜下观察,CD34主要表达在血管内皮细胞中,呈黄色至褐色。每张免疫组化切片随机选择10个视野,计数阳性血管总数。毛细血管判断标准:以黄染的血管内皮细胞为标准,数个血管内皮细胞围成管腔,直径小于10 μm或单细胞管腔均作为1个毛细血管计数。
1.3 统计学方法
采用SPSS19.0软件进行统计学分析,实验流程重复3次,数据用均数±标准差()表示。多组间比较采用单因素方差分析,两两比较采用SNK 检验,P<0.05为差异有统计学意义。
2 结果
2.1 LSS干预对BDNF表达的影响
循环流体和非循环流体产生的LSS 分别干预HUVEC 0、15、30、60 min。循环流体中BDNF 蛋白浓度随着干预时间延长逐渐增高,各时段间差异有统计学意义(P<0.05,图2A)。两种流体干预下,HUVEC 中BDNF 蛋白表达水平均随干预时间延长而逐渐升高,各时段间差异有统计学意义(P<0.05,图2B、C)。
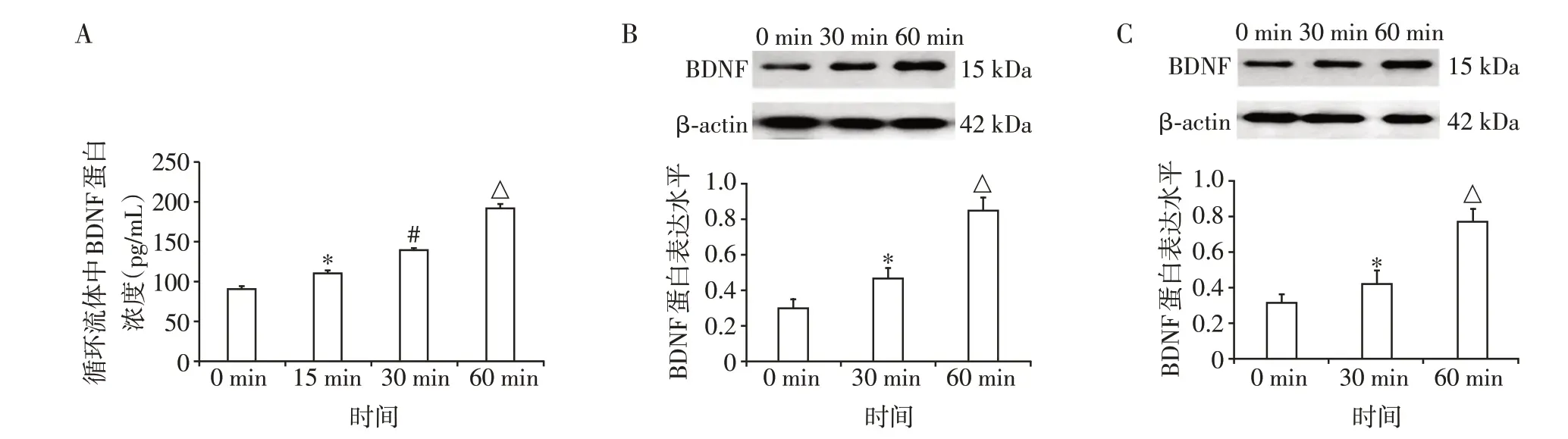
图2 循环流体及非循环流体干预下BDNF蛋白表达水平Figure 2 BDNF levels in the circulating flow and non⁃circulating flow
2.2 LSS干预过程中流体BDNF水平对TrkB磷酸化的影响
循环流体和非循环流体产生的LSS 分别干预HUVEC 0、30、60 min。非循环流体环境中,TrkB 蛋白磷酸化水平随着LSS 干预时间延长无明显变化,各时段间无显著差异(P>0.05);循环流体环境中,TrkB蛋白磷酸化水平随着LSS干预时间延长而逐渐升高,各时段间差异有统计学意义(P<0.05);循环流体加入BDNF 后,TrkB 蛋白磷酸化水平较单纯循环流体干预组进一步增强,各时段间差异有统计学意义(P<0.05,图3)。

图3 Western blot检测不同BDNF水平的流体干预下TrkB蛋白磷酸化情况Figure 3 TrkB phosphorylation states in the flows with different BDNF levels detected by Western blot
2.3 LSS干预过程中增加流体BDNF水平对TrkB下游Akt通路激活的影响
循环流体和非循环流体产生的LSS 分别干预HUVEC 0、30、60 min。非循环流体环境中,TrkB 蛋白磷酸化水平随着LSS 干预时间延长无明显变化,各时段间差异无统计学意义(P>0.05);循环流体环境中,Akt 蛋白磷酸化水平随着LSS干预时间延长而逐渐升高,各时段间差异有统计学意义(P<0.05);循环流体加入BDNF 后,Akt 磷酸化水平较单纯循环流体干预组进一步增强,各时段间差异有统计学意义(P<0.05,图4)。
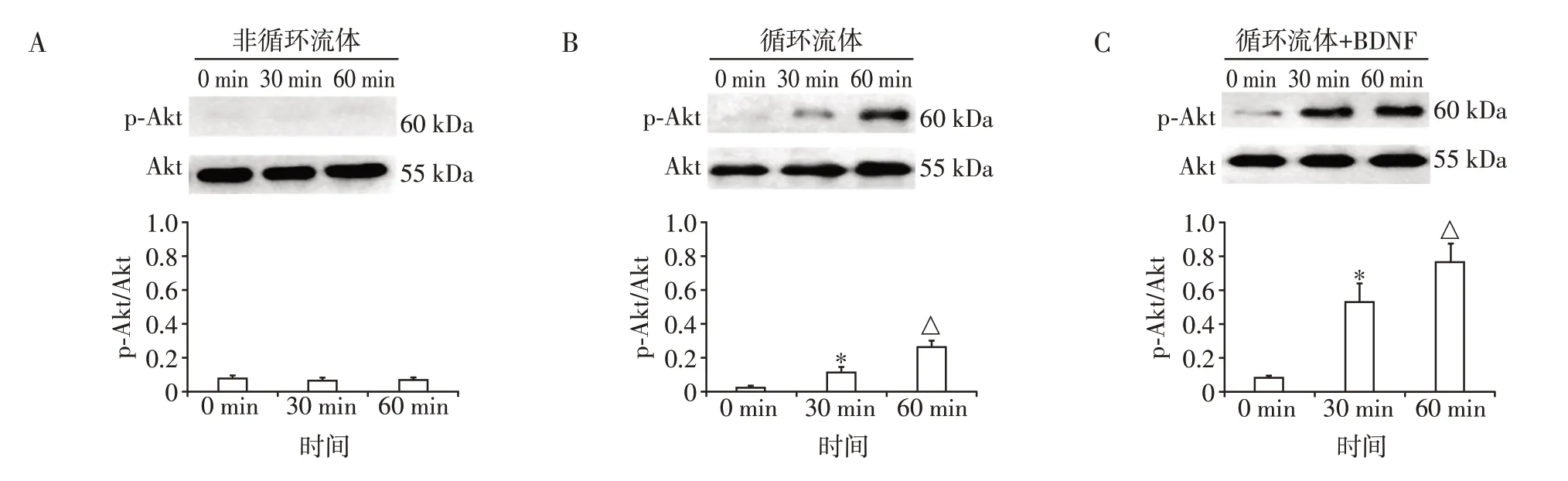
图4 Western blot检测不同BDNF水平的流体干预下Akt蛋白磷酸化情况Figure 4 Western blot measurement of Akt phosphorylation states in the flows with different BDNF levels
2.4 LSS干预过程中增加流体BDNF水平对HUVEC体外血管生成能力的影响
体外细胞迁移和小管形成实验结果显示,非循环流体干预组HUVEC 迁移和小管形成能力与对照组(Ctrl 组)比较差异无统计学意义(P>0.05)。BDNF 干预组HUVEC 迁移和小管形成能力较对照组显著增高(P<0.05),但仍低于循环流体干预组(P<0.05)。循环流体+BDNF干预组HUVEC迁移和小管形成能力较其他各组均显著增高(P<0.05,图5)。
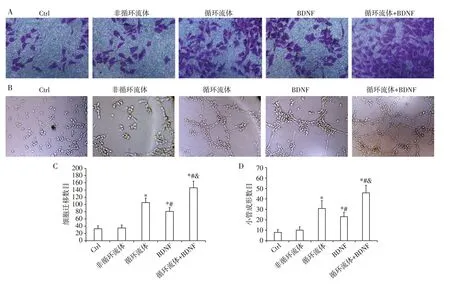
图5 不同BDNF水平的流体干预对HUVEC迁移及小管形成能力的影响Figure 5 Effects of the flows with different BDNF level on HUVEC migration and tube⁃forming capacity
2.5 BDNF协同有氧运动促进MI大鼠心肌血管生成
图5为各组心肌组织免疫组化CD34染色切片代表照片,黄染部位为毛细血管。MIC组和MICB组心肌毛细血管密度显著低于Sham 组(P<0.05);MIC组和MICB 组心肌毛细血管密度无显著性差异(P>0.05);MIE组心肌毛细血管密度显著高于MIC、MICB组(P<0.05),仍低于Sham组(P<0.05);MIEB组心肌毛细血管密度显著高于MICB 组和MIE 组(P<0.05),低于Sham组(P<0.05,图6)。
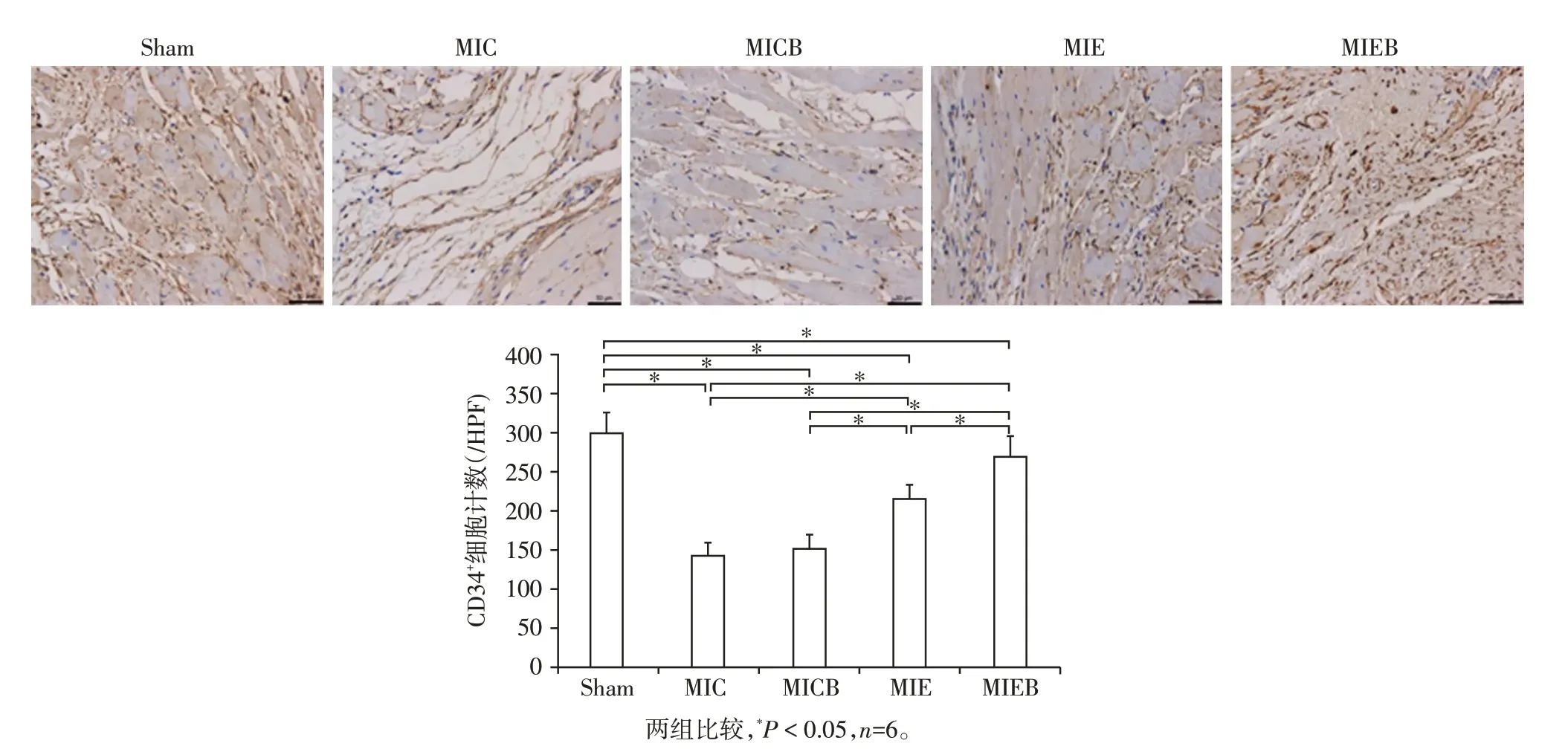
图6 外源性注射BDNF、运动及两者协同作用对MI大鼠心肌血管生成的影响(×200)Figure 6 Effects of intraventricular application of BDNF,exercise training and synergistic action of the two factors on myocardial angiogenesis of MI rats(×200)
2.6 BDNF协同有氧运动改善MI大鼠心脏功能
造模术后1 周,MIC、MICB、MIE、MIEB 组大鼠LVEF、LVFS 显著低于Sham 组(P<0.05),LVIDd、LVIDs 较Sham 组显著增高(P<0.05);MIC、MICB、MIE、MIEB 组间LVEF、LVFS、LVIDd、LVIDs 无明显差异(P>0.05,图7)。
经过4周的干预,MIE组和MIEB组LVEF、LVFS均较干预前升高(P<0.05),LVIDd、LVIDs 均降低(P<0.05),且MIEB 组变化较MIE 组更为明显(P<0.05),但与Sham组比较,差异仍有统计学意义(P<0.05);MIC组和MICB 组LVEF、LVFS、LVIDd、LVIDs与干预前比较,差异无统计学意义(P>0.05,图7)。
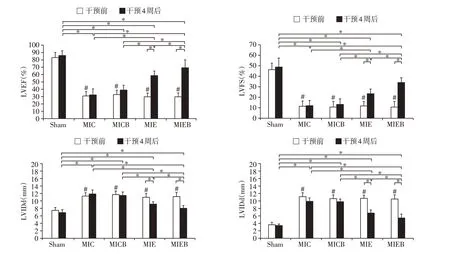
图7 外源性注射BDNF、运动及两者协同作用对MI大鼠心功能的影响Figure 7 Effects of intraventricular application of BDNF,exercise training and synergistic action of the two factors on cardiac function of MI rats
3 讨论
循证医学证据表明,以运动疗法为核心的心脏康复在降低心血管病致残率和死亡率以及提高心血管病患者生活质量方面有确切获益[2-3]。其中,冠心病运动康复的中心效应发挥了重要的心脏保护作用。中心效应的原理主要是指运动能够促进心肌血管生成及增强心肌收缩能力。
大量研究证实BDNF/TrkB 通路作为一种诱导性配体/受体系统在体内展现出强大的促血管生成和心脏保护作用[12]。冠心病患者循环BDNF水平与血管内皮功能[13]和心肺适应能力(峰值耗氧量)呈正相关[14]。血清BDNF 水平降低与心衰患者的死亡和再住院有关[15]。而低水平BDNF 和低水平峰值耗氧量结合可预测心衰患者的心血管相关死亡率[16]。我们前期的研究结果揭示,有氧运动训练可提高MI 大鼠血清BDNF 浓度,并与心肌血管密度及心功能水平的改善呈正相关,提示该系统在运动的心血管获益中发挥重要作用;同时,我们构建了12 dyn/cm2LSS,以模拟运动对血管的生理效应,发现LSS 作用下内皮细胞BDNF 合成和分泌显著增加,从而判断运动主要通过其诱导的LSS 增高促进BDNF生成[7]。在血液循环过程中,血流与血管内皮接触而生成和血流方向一致的摩擦力,称为血流剪切力(shear stress,SS)。其中,LSS 是通过与血流方向相同的层流血流形成的。在生理范围LSS(10~15 dyn/cm2)作用下,内皮细胞可释放多种生物活性物质,维持血管适度的张力、抑制血小板黏附及血管重塑,并且随着剪切力在一定范围内的适度增大,这种作用得到进一步增强。适度的运动训练能够通过心率的加快及心输出量的增加,加快血流速度、提高外周血管张力,从而导致平均LSS 的增加[17]。运动性充血状态下,加速的血流可引起动脉系统反馈性舒张以降低局部剪切力至基础水平,从而间接改善局部血供;但毛细血管顺应性有限,运动可导致其承受的剪切力维持在较高水平,其机械应力传导是微血管重构的重要因素[18]。升高的剪切力可以加速内皮细胞分裂,在体内,局部血管生成情况也与局部组织充血程度、即局部微血管剪切力密切相关[19]。
随着运动强度的适度提升,局部血管LSS 水平相应升高,其发挥的血管保护效应亦随之增强。研究证实,BDNF的生成与运动强度呈正相关,且可影响运动获益程度[20-22],而低强度有氧运动提高BDNF的效果不明显[23]。故而,充足的运动强度才能确保LSS 上升、BDNF 浓度提高至获益水准;充足的运动时间才能达到足够的LSS 作用起效时限。然而,相当一部分患者因重视程度不足、医疗条件欠缺、高龄、重症后虚弱等原因不能保证充足的训练强度和时间。
细胞实验中,本研究亦发现在LSS 干预下,BDNF 是配体浓度依赖性地发挥其生物学效应的。LSS诱发的TrkB及其下游Akt通路的磷酸化持续增强依赖于流体中BDNF水平的维持。在平行板流动小室中,循环和非循环流体产生的LSS均可使BDNF表达增加。但在使用开放回路的非循环流体进行干预时,非循环流体中HUVEC分泌的BDNF不停随液体流出,故BDNF浓度极低、可忽略不计;同时,其中的TrkB 受体及下游Akt 通路亦处于未激活状态。而Akt通路在心脏血管生成方面发挥重要作用,Cao等[8]证实老化的心脏微血管内皮细胞TrkB 表达降低以及相应的BDNF-TrkB-PI3K/Akt 信号通路的损伤可导致BDNF介导的细胞迁移障碍。在使用循环流体产生的LSS 进行干预时,灌流液中BDNF 浓度随干预时间延长而持续增高,TrkB 及其下游Akt 通路激活程度呈持续增高趋势。在循环流体中加入BDNF 后,TrkB、Akt 的磷酸化水平较单纯循环流体干预组显著增高,相应的HUVEC 体外血管生成能力也显著增强。这也进一步解释了为何运动后BDNF水平与心肌血管生成及心功能改善呈正相关性。循环BDNF 浓度越高,其受体TrkB 表达及其下游通路激活程度越高,能够发挥出更显著的生物学效应。
然而,心血管疾病危险因素可损害血管内皮细胞功能,影响BDNF 分泌。冠心病患者循环BDNF浓度显著降低,且与血管性血友病因子呈正相关,提示内皮功能障碍是循环BDNF水平受损的重要决定因素[13]。动物及临床实验均证实存在高血压[24]、糖尿病[25-26]、肥胖[27]等情况下,个体血清BDNF水平低于对照组,且对运动的敏感度也可能相对较低,无论是心肌梗死后的心肌代偿水平还是运动后心脏恢复能力都有所下降。Val66Met 单核苷酸多态性(SNP)携带者中BDNF 的钝化表达亦可能不会表现出血清BDNF 浓度的运动强度依赖性变化,也为其运动获益带来不确定性[28]。
所以,改善血管内皮功能、从而诱导或强化运动效果的治疗药物的产生,可以为医学界带来广泛的益处。这也为外源性注射BDNF强化运动效应带来了理论可行性。Hang 等[10]发现静脉注射BDNF可减轻阿霉素对心脏的毒性作用;皮下注射BDNF可改善心功能不全小鼠的运动耐力,进一步证实其在体内的生物学效应[29-30]。这些研究结果均提示外源性BDNF 对于心血管疾病亦存在一定的治疗意义。我们的动物实验发现静脉注射BDNF协同运动可显著提高MI大鼠心肌血管密度及左心功能,考虑运动时增高的LSS结合较高浓度的BDNF 能够强化其TrkB 及下游Akt 通路激活程度,从而有效改善内皮细胞功能。其心功能的改善,一方面与心肌细胞血供改善有关,另一方面外源性BDNF 可能对心肌细胞本身亦有一定的保护作用,这也是我们下一步研究中拟进一步探讨的问题。
在后续研究中,我们还会进一步摸索BDNF 的给药浓度、给药方式和给药时机,探讨BDNF协同有氧运动对心肌BDNF/TrkB 及其下游信号通路的影响,在争取获得更佳疗效的同时,为临床优化有氧运动效果改善MI 预后寻找新策略并提供理论和实践依据。
