LDL-C/HDL-C 对慢性髓系白血病患者深度分子学反应的预测价值
2022-04-25徐子瑶胡金花刘文洁钱思轩
徐子瑶,胡金花,孙 倩,刘文洁,洪 鸣,钱思轩
南京医科大学第一附属医院血液科,江苏 南京 210029
慢性髓系白血病(chronic myeloid leukemia,CML)是一种Ph 染色体阳性的骨髓增殖性疾病,酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)的出现明显改善患者的预后,使得大多数患者出现不同程度的缓解,包括深度分子学反应(deep molecular response,DMR),为无治疗缓解(treatment-free remission,TFR)提供了可能。脂质是机体重要的组成成分和代谢物质,脂代谢异常是多种心血管疾病发生的重要原因,同时也与多种肿瘤的发生发展密切相关,如乳腺癌、前列腺癌、结直肠癌以及血液肿瘤等。已有研究报道脂蛋白脂肪酶(lipoprotein lipase,LPL)的异常表达与慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)的不良预后相关[1]。急性髓系白血病(acute myeloid leukemia,AML)中低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)的表达是其独立不良预后因子[2]。因此,为了探究血脂水平在CML 患者初诊及TKI 治疗后的变化及其对治疗反应的预测价值,我们比较了453 例CML 患者在初诊时、达到主要分子学反应(major molecular response,MMR)和DMR 时的血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C)的水平和脂质比值差异,评估血脂水平对治疗反应的预测价值。
1 对象和方法
1.1 对象
选取2000年5月—2021年7月于南京医科大学第一附属医院血液科收治的491例CML患者为研究对象,按照以下纳入、排除标准,最终453 例纳入分析,其中男291 例,女162 例,中位年龄46(5~90)岁。Sokal积分:低危335例,中危99例,高危19例。130 例为伊马替尼一线治疗,323 例为二代TKI 治疗,包括达沙替尼、尼洛替尼和国产氟马替尼,其中100 例为伊马替尼疗效不佳或不耐受更换为二代TKI。纳入标准:①所有患者均经形态学、细胞遗传学、分子生物学检查,根据典型临床表现,合并Ph染色体或BCR-ABL1 融合基因阳性确诊为CML[3];②初诊(treatment-naïve,TN)时及TKI 治疗后进行血脂水平检测。排除标准:①加速期;②急变期;③临床资料不完整。根据中国成人血脂异常防治指南(2016 年修订版),选取血脂在合适水平的正常人315 例,均来自健康体检者,其中男190 例,女125 例,年龄22~82 岁,平均(46.70±14.14)岁。本研究经医院伦理委员会批准(2017-SR-170)所有研究对象均知情同意。患者筛选研究流程图见图1。
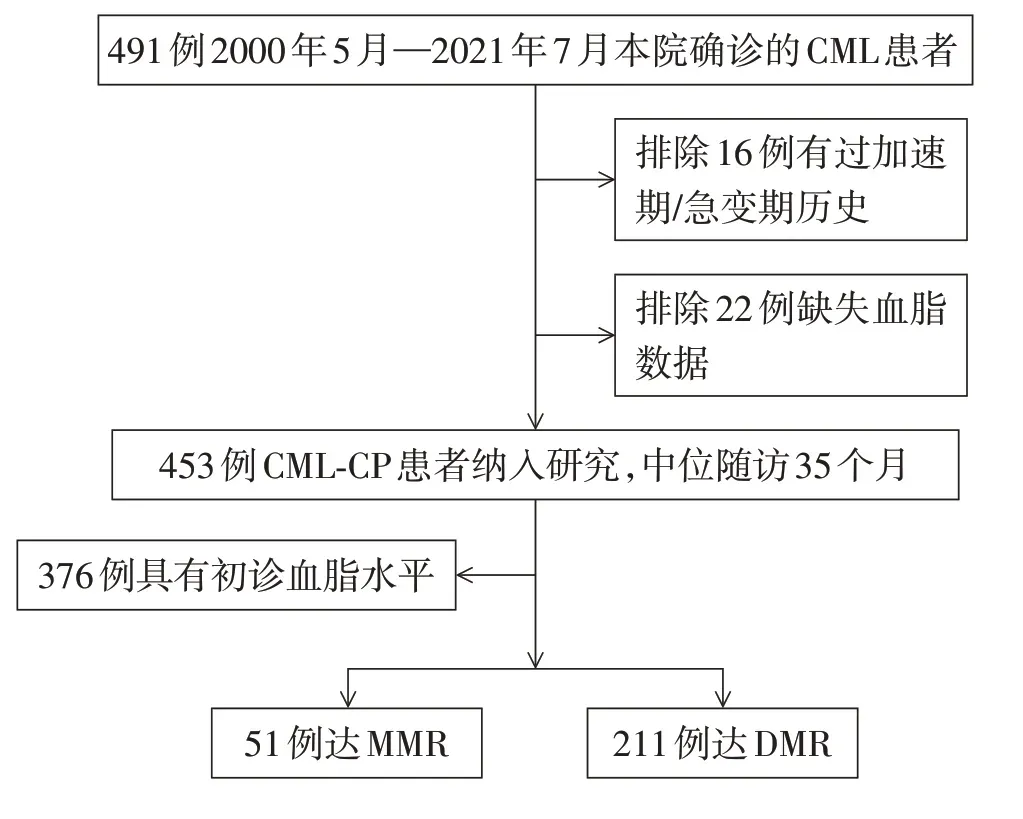
图1 患者筛选研究流程图Figure 1 Flowchart of patients’selection
1.2 方法
为排除和减少饮食影响,所有患者和健康体检者均禁食12~16 h后,于次日清晨采集肘静脉血3 mL,采用OLIPAS AU2700 全自动生化分析仪及相应配套试剂测定TC、TG、HDL-C、LDL-C水平。非高密度脂蛋白胆固醇(non-high-density lipoprotein cholesterol,non-HDL-C)水平=血清TC-血清HDL-C。中间是减号。TC正常值范围为3.00~5.70 mmol/L,TG正常值范围为0~2.25 mmol/L,HDL-C 正常值范围为1.03~1.55 mmol/L,LDL-C正常值范围为2.60~4.10 mmol/L。
疗效评估标准:根据2013 版欧洲白血病网络(European Leukemia Network,ELN)治疗指南[4]评估患者疗效,包括①细胞遗传学反应:完全细胞遗传学反应(complete cytogenetic response,CCyR);②分子学反应:MMR,分子学反应4.0(molecular response 4.0,MR4.0),分子学反应4.5(molecular response 4.5,MR4.5),分子学反应5.0(molecular response 5.0,MR5.0),分子学无法检测(undetectable minimal residual disease,UMRD)。DMR包括UMRD和MR4.0及以上。
453例患者中103例本院确诊后未于本院随访,未规律监测分子学反应,另外350 例患者进行了规律的疗效评估,最终40例患者未达到CCyR,48例未达MMR(已达到CCyR),51例达到MMR,211例患者达到DMR。
1.3 统计学方法
所有数据采用SPSS26.0、GraphPad Prism8.0 和R软件进行统计学分析和绘图。计数资料以率或百分比表示,组间比较采用卡方检验。服从正态分布的计量资料用均数±标准差()表示,两组间比较采用t检验;非正态分布计量资料采用中位数(四分位数)[M(P25,P75)]表示,两组间比较采用Mann-WhitneyU检验。多组比较采用单因素方差分析,两两比较采用LSD 检验。应用Logistic 回归模型探索DMR 的独立相关因素,并使用R 软件中的rms 包构建基于独立相关因素的列线图模型,通过c指数(c-index)判断列线图的预测能力。P<0.05 为差异具有统计学意义。
2 结果
2.1 CML患者初诊时血脂水平与正常人的比较
453例CML-CP患者中376例检测了初诊血脂水平,其中男239 例,女137 例,平均年龄为(44.87 ±15.27)岁。将初诊CML-CP 患者与正常人的临床特征和血脂水平进行比较(表1),两组在年龄和性别比例上差异无统计学意义(P>0.05)。与正常人相比,初诊CML患者表现为TC、HDL-C、LDL-C和non-HDLC 水平低(P<0.001),TG、non-HDL-C/HDL-C、TC/HDL-C、TG/HDL-C水平高(P<0.001),LDL-C/HDLC水平在两组之间差异无统计学意义(P=0.099)。
表1 初诊CML⁃CP患者与正常人的血脂水平比较Table 1 Comparison of blood lipid levels and lipid ratios between newly diagnosed CML⁃CP patients and normal controls()
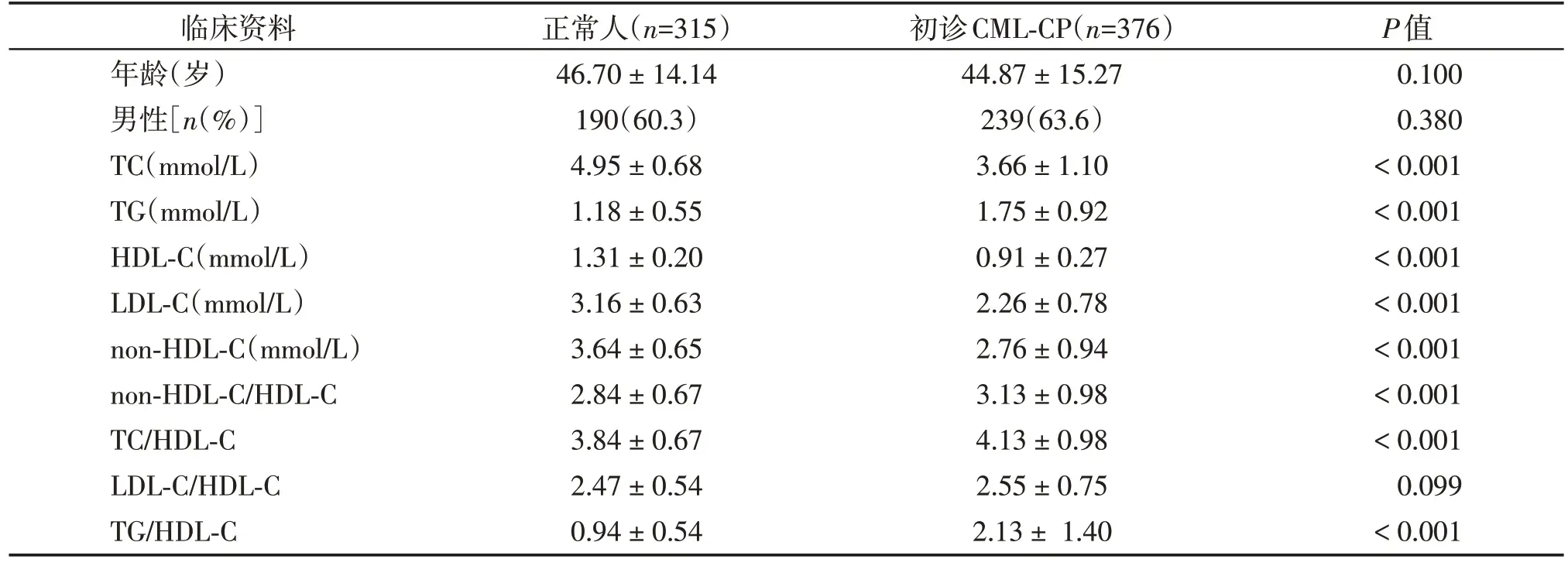
表1 初诊CML⁃CP患者与正常人的血脂水平比较Table 1 Comparison of blood lipid levels and lipid ratios between newly diagnosed CML⁃CP patients and normal controls()
血脂水平随年龄增长而升高,至50~60 岁达到高峰,其后趋于稳定或有所下降。中青年女性血脂水平低于男性,但绝经期后显著升高,常高于同龄男性。因此,我们对患者进行不同年龄段分组,分为≤20 岁组、21~45岁组、46~65岁组、≥66 岁组。对女性患者,分为绝经期前(<50 岁,pre-menopausal,Pre-M,n=80)和绝经期后(≥50岁,post-menopausal,Post-M,n=57),比较不同组别患者血脂水平与正常人的差异。结果如表2 所示,不同年龄段患者与正常人之间差异均有统计学意义,与总体趋势一致,但TG、non-HDL-C/HDL-C 和TC/HDL-C 水平在≤20 岁组和≥66 岁组无差 异,HDL-C 水平在≤20 岁组无差异。与正常人相比,绝经期前后患者均表现为TC、HDL-C水平低和TG、LDL-C、TG/HDLC水平高,且TG、LDL-C和TG/HDL-C 水平在绝经期后显著升高(P<0.05,图2)。
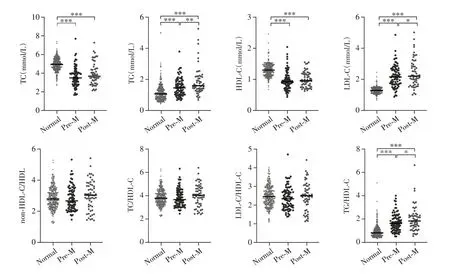
图2 女性患者中绝经期前后组与正常人的血脂水平比较Figure 2 Lipids of female patients before and after menopause compared with normal controls
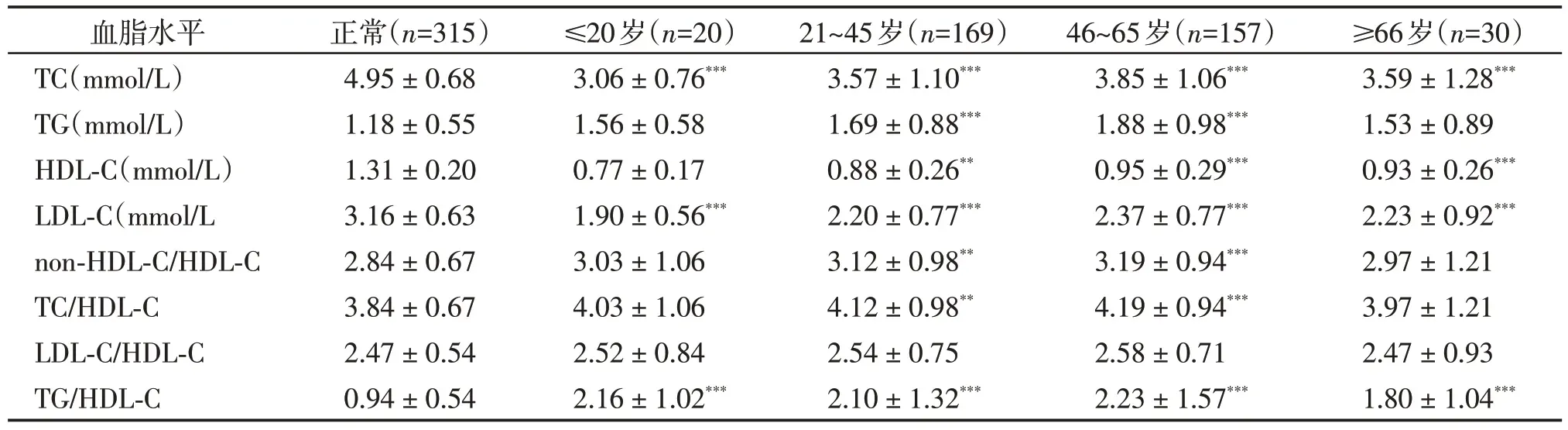
表2 不同年龄组CML⁃CP患者与正常人的血脂水平比较Table 2 Comparison of blood lipid levels between CML⁃CP patients and normal controls in different age groups
2.2 CML患者达到分子学缓解后血脂水平恢复
随后我们比较了CML-CP患者初诊时以及达到分子学缓解后的血脂水平。在经TKI治疗后,MMR组和DMR组患者TC、HDL-C和LDL-C水平均上升,TG/HDL-C 水平均下降,差异均具有统计学意义(P<0.001)。MMR组与初诊时相比,TG、TC/HDL-C、LDL-C/HDL-C、non-HDL-C/HDL-C 水平呈下降趋势。而DMR 患者相较于MMR 患者来说,LDL-C、TC/HDL-C、LDL-C/HDL-C和non-HDL-C/HDL-C水平更低(P<0.05,图3)。CML患者达到分子学缓解后血脂水平恢复至正常水平。另外,为排除绝经与否对于血脂的影响,我们比较了MMR 组和DMR 组女性患者中绝经期前和绝经期后血脂水平,两组在TC、TG、HDL-C 和LDL-C 水平上差异无统计学意义(均P>0.05)。
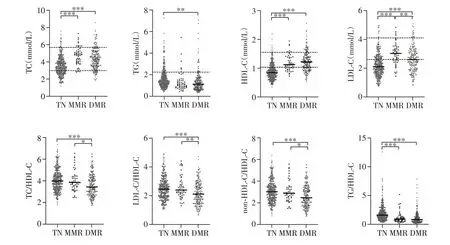
图3 初诊CML⁃CP患者达到分子学缓解时的血脂比较Figure 3 Lipid profile of CML⁃CP patients at different molecular response stage
2.3 MMR患者与DMR患者的临床特征和血脂水平比较
为了进一步探究血脂水平对DMR的预测价值,我们对DMR(n=211)和MMR(n=51)患者血脂水平和基线特征进行比较(表3)。两组患者在年龄、性别分布,有无冠心病、高血压、糖尿病和有无服用调脂药物上无明显差异(P>0.05)。DMR组患者Sokal评分低危患者比例较高(P=0.008),且二代TKI用药患者较多(P=0.021),TKI 治疗时间明显长于MMR组(P<0.001)。DMR 患者TC、LDL-C、non-HDL-C、non-HDL-C/HDL-C、TC/HDL-C和LDL-C/HDL-C水平明显低于MMR 患者(P<0.05)。两组患者在LDH、TG、HDL-C 和TG/HDL-C 水平上差异无统计学意义(P>0.05)。
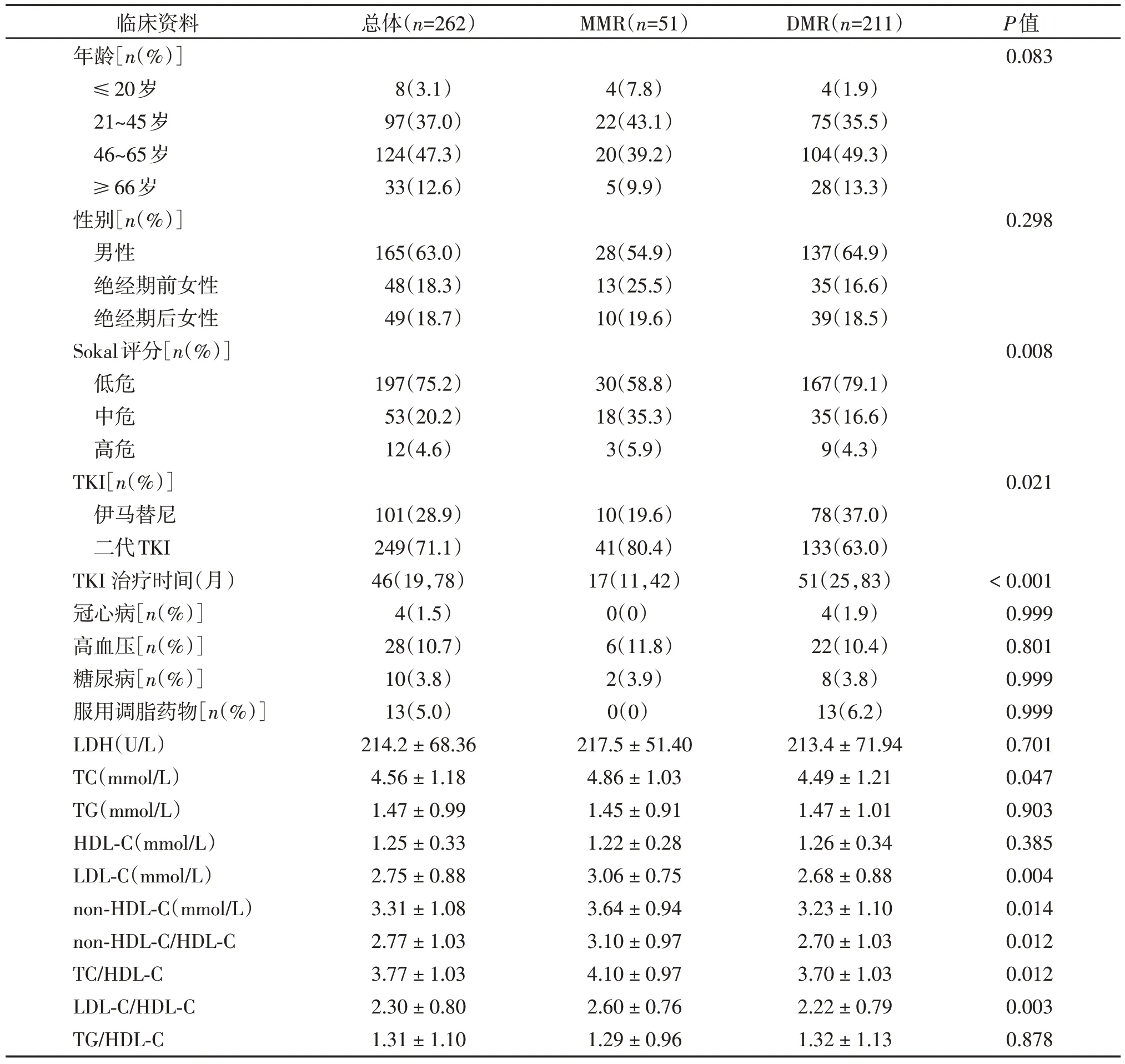
表3 CML⁃CP患者的临床特征Table 3 Comparison of baseline characteristics between the two groups of CML⁃CP patients
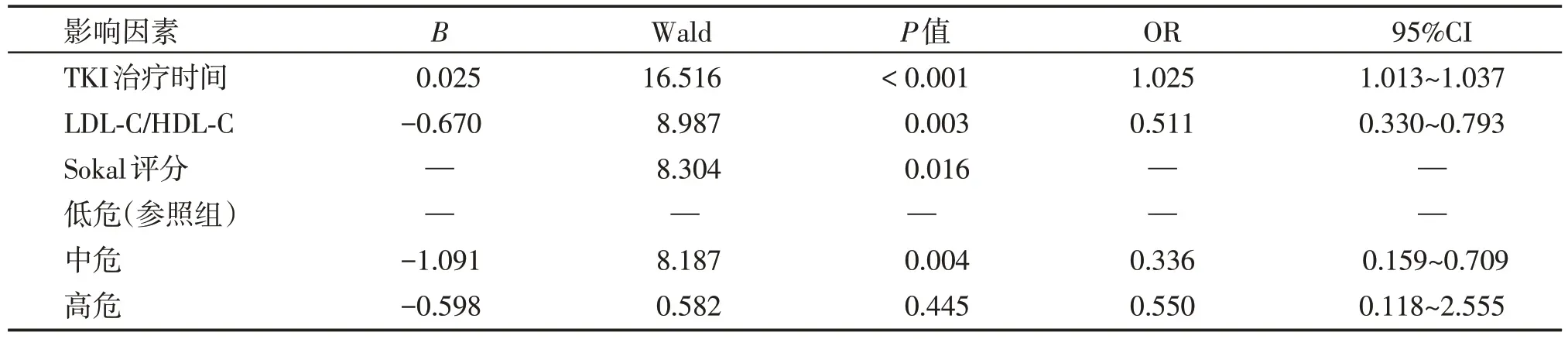
表3 多因素Logistic回归分析Table 3 Multivariate Logistic regression analysis of independent correlation factors of DMR
2.4 多因素Logistic回归分析DMR的独立相关因素
为明确在MMR患者中血脂水平与DMR的相关性,我们首先进行了单因素分析,再将P<0.1 的因素(包括年龄、Sokal 评分、TKI 用药选择、TKI 治疗时间、TC、LDL-C、non-HDL-C、non-HDL-C/HDL-C、TC/HDL-C 和LDL-C/HDL-C)纳入多因素Logistic 回归模型,结果显示TKI 治疗时间(OR=1.025,95%CI:1.013~1.037,P<0.001)、Sokal 评分(P=0.016)和LDL-C/HDL-C(OR=0.511,95%CI:0.330~0.793,P=0.003)是DMR的独立相关因素(表4)。基于多因素Logistic回归发现的独立相关因素,构建列线图模型(图4),预测模型的c指数为0.780(95%CI:0.709~0.851,P<0.001),表明本列线图对DMR 具有一定预测价值。
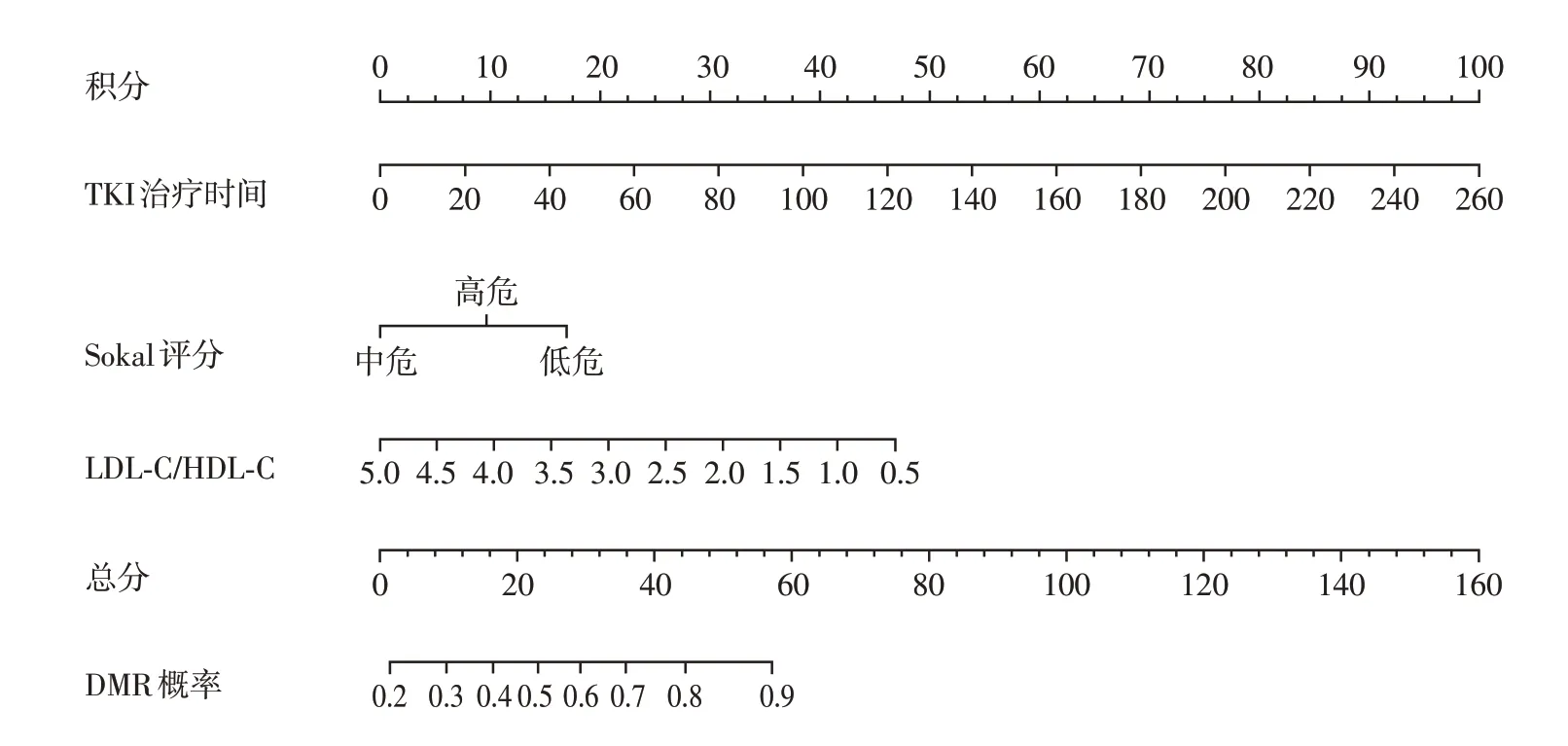
图4 基于Logistic回归模型的列线图Figure 4 Nomogram based on the logistic regression model
3 讨论
血脂异常涵盖了一系列脂质异常,但最令人担忧的是所谓的“致动脉粥样硬化特征”(通常称为“三联征”),即低HDL-C、高TG 和LDL-C,通常与动脉粥样硬化以及多种疾病密切相关[5-7],包括血液恶性肿瘤[8]。本研究发现与健康人相比,初诊CML-CP患者TG水平显著升高,而TC、HDL-C和LDL-C水平显著下降,TC/HDL-C、TG/HDL-C和non-HDL-C/HDL-C 比值显著升高,LDL-C/HDL-C 无明显差异,且在不同年龄段患者呈现一致趋势。绝经期后女性患者表现为高TG和LDL-C水平。
本研究发现初诊CML-CP 患者TG 水平明显升高,我们推测初诊患者脂代谢异常可能与铁过载相关的氧化应激有关。铁蛋白是体内广泛存在的储铁蛋白,CML 患者白血病细胞合成铁蛋白增加,使血清铁蛋白升高。Zhou等[9]研究了铁代谢状态与脂代谢之间的关系,游离铁作为第一线的促氧化剂,铁过载引起的氧化应激增加可减少脂肪酸氧化并增加脂质转运。同时体内实验结果表明,铁过载还能降低肝脏过氧化物酶体增殖物激活受体α(PPARα)的表达[10];右旋糖酐铁也可下调PPARα及其靶基因Nrf1、cpt-1α的表达,从而降低脂肪酸氧化,提高TG水平[10-11]。
胆固醇是机体不可缺少的重要物质,它不仅参与形成细胞膜,而且是合成胆汁酸、维生素D3 以及甾体激素的原料。TC 是血液中各种脂蛋白所含胆固醇的总和,其存在形式包括HDL-C、LDL-C、极低密度脂蛋白胆固醇等。胆固醇的合成与肿瘤细胞的代谢相关。恶性血液系统疾病包括AML、CML、CLL等因白血病细胞大量快速增殖引起的能量需求导致基线胆固醇水平明显下降,而肿瘤患者对治疗的积极反应往往伴随着胆固醇水平的升高。雌激素本身具有抗氧化作用,可作为自由基的清除剂,绝经期后女性患者LDL-C 水平的升高可能与雌激素水平的下降有关。本研究中初诊患者同步降低的LDL-C 与HDL-C 水平可能造成LDL-C/HDL-C 比值与正常人无差别。Pouwer 等[12]研究了TKI对于脂代谢的影响,他们发现伊马替尼和普纳替尼能够降低促动脉粥样硬化脂蛋白中含有的血浆胆固醇。TKI 除了用于靶向BCR-ABL1 酪氨酸激酶外,同时还参与不同过程影响其脱靶效力和活性。因此,需要更多研究探讨TKI治疗对胆固醇和脂蛋白代谢的影响。
CML 患者经TKI 治疗后达到DMR 时TG、TC/HDL-C、LDL-C/HDL-C 和non-HDL-C/HDL-C 水平明显下降,TC、HDL-C、LDL-C明显升高,表明其脂代谢不同程度的恢复。本课题组既往研究了CML 患者对伊马替尼不同反应时的代谢表型和基因组多态性,发现与正常人相比,初诊患者尿素循环、三羧酸循环、脂质代谢和氨基酸代谢紊乱;而对伊马替尼敏感的患者出现显著的代谢反应,紊乱的代谢明显恢复,CML 的大部分代谢物被调整到正常水平[13]。在病程中出现的脂质谱改变,其病理机制可解释为高细胞因子血症引起的急性期反应紊乱,即影响脂质代谢的酶活性的改变,如卵磷脂-胆固醇酰基转移酶和LPL等。
近年来,许多研究发现LDL-C/HDL-C[14]、TG/HDL-C[15]、TC/HDL-C[16]和non-HDL-C/HDL-C[5]等血脂联合指标对心脑血管疾病、糖尿病及多种代谢性疾病的预测价值优于单一脂蛋白。流行病学研究也表明LDL-C/HDL-C可作为心血管疾病[5]、糖尿病[17]、非酒精性脂肪性肝炎[18]、代谢性疾病[19]、强直性脊柱炎[20]等风险的独立预测指标。然而,LDL-C/HDL-C在CML-CP 患者中对DMR 的预测价值并未明确。本回顾性研究的结果表明,LDL-C/HDL-C 可作为DMR 的独立预测指标。LDL-C/HDL-C 表示促动脉粥样硬化蛋白与抗动脉粥样硬化蛋白的比值。HDL-C 本身可通过抗氧化和抗炎特性发挥其保护作用[21],并且能通过降低粒细胞-单核细胞祖细胞和骨髓细胞中白细胞介素-3来抑制髓细胞增殖和白细胞增多[22]。因此,升高的HDL-C提示着炎症反应的控制,可作为肿瘤负荷的生物标志物。此外,LDLR表达曾被报道与乳腺癌的进展密切相关[23],LDLR的下调可增加实体肿瘤对化疗的敏感性,通过肝X受体激动剂的药物靶向LDLR也可诱导肿瘤细胞死亡[24]。在AML 中也可见LDLR 受体表达的升高[2]。TKI 作为酪氨酸激酶抑制剂,不仅靶向BCR-ABL酪氨酸激酶,对KIT、表皮生长因子受体(EFGR)、血小板衍生生长因子受体(PDGFR)、SRC 激酶也有抑制作用。Luo 等[25]在小细胞肺癌中发现TKI 可以通过阻断固醇调节元件结合蛋白1(SREBP-1)依赖的EGFR信号通路来降低LDLR的表达,从而降低胆固醇的利用,导致肿瘤细胞生长受到抑制。我们推测TKI 可能通过EGFR 相关信号通路降低LDL-C。因此,LDL-C 的降低和HDL-C 的升高提示着较好的疗效,同时对于DMR有着较好的预测作用。
本研究有以下局限性:①回顾性研究;②并非所有患者每个阶段均检测了血脂水平;③部分患者未进行规律监测分子学反应;④样本量仍需进一步扩大。
动态监测CML患者的血脂变化水平,对于CML疗效的评估及预测具有重要意义,且LDL-C/HDL-C可作为DMR的独立预测指标,有助于识别最佳停药患者,为实现TFR提供了可能。
