本氏烟草NbRS基因克隆及响应镉胁迫中的功能初步分析
2022-04-22娄冰冰赵一博辛翠花卞晓燕郭江波
娄冰冰, 赵一博, 辛翠花, 卞晓燕, 郭江波
(1.内蒙古科技大学生命科学与技术学院, 内蒙古 包头 014010;2.雪川农业发展股份有限公司, 河北 张家口 076481)
随着工矿业的迅速发展,化肥、农药的大量使用,土壤重金属含量不断增加,土壤重金属污染日趋严重[1]。一些重金属元素是植物生长所必需的微量元素,常作为酶的重要辅因子,参与植物的生理生化活动以及代谢过程,浓度过高也会对植物产生毒害作用。例如,过量的锰、铜和锌会影响植物光合作用的正常进行,导致植株黄化,也会造成植物细胞损伤以及干扰植株对其他离子的吸收。另一些是植物生长非必需的元素,即使浓度很低也会影响农产品的质量品质,高浓度时会对植物产生毒害作用,如铅、镉、铬等。这些非必需的重金属离子会影响植物细胞膜透性、破坏植物抗氧化防御系统以及光合系统,严重时会导致整株死亡。植物中的重金属离子会通过食物链富集到各个生物群体,从而危害人体健康[2-5]。因此,许多研究者希望通过研究植物响应重金属胁迫的分子机制来解决上述问题。本实验室前期通过甲基化敏感多态性扩增技术克隆了编码精氨酰-tRNA合成酶(ArgRS)蛋白的基因,但是对该基因在植物中如何响应Cd2+胁迫的研究鲜有报道。精氨酰-tRNA合成酶是一类参与将氨基酸结合到其对应的tRNA上的过程的酶[6]。布氏锥虫ArgRS基因沉默会引起使细胞快速死亡,表明其对维持基本生命活动的重要性[7]。
在蛋白质合成过程中,氨基酸必须与特定的tRNA结合,在氨酰tRNA合成酶(aaRSs)生成氨酰tRNAs(aatRNAs),才能够开始蛋白质的合成。氨酰-tRNA合成酶催化的反应分两步进行:首先ATP将同源氨基酸激活以形成氨酰基-AMP,并释放一分子的焦磷酸;之后氨酰基部分转移到tRNA的2′-或3′-羟基上,与tRNA CCA末端的核糖环形成aa-tRNA[8]。根据催化活性位点的序列差异,氨酰tRNA合成酶分为两类:Ⅰ类aaRS在活性位点的Rossmann折叠域中具有两个同源保守序列HIGH和KMSK;Ⅱ类aaRS的活性中心包含一个7条反平行的β折叠结构和三个同源保守序列[9-10]。其中精氨酰-tRNA合成酶属于第Ⅰ类氨酰-tRNA合成酶,但是大多数不同来源的ArgRS不同,该蛋白缺乏保守的KMSK序列,并且它所催化的氨基酰化反应是一步完成的[11-12]。目前对精氨酰-tRNA合成酶的研究多在细菌与动物中,其在植物中的生物学功能知之甚少。
本氏烟草是烟草属植物,株型较小,易于进行遗传操作,是实验室常用模式植物。烟草脆裂病毒(tobacco rattle virus,TRV)侵染后能够诱发本氏烟草细胞内的RNA干扰机制,实现目的基因的定向沉默,是有效的研究植物基因功能的技术手段。本研究采用了TRV病毒诱导的基因沉默技术,快速分析本氏烟草精氨酰-tRNA合成酶在植物响应镉胁迫反应中的功能。
1 材料与方法
1.1 材 料
本氏烟草(Nicotianabenthamiana)种子,大肠杆菌(Escherichiacoli)菌株DB 3.1、Top 10和农杆菌(Agrobacteriumtumefaciens)GV 3101均由内蒙古科技大学生命科学与技术学院实验室保存提供。TRIzol试剂、2×TaqPCR Master Mix、pGM-T载体、琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒和反转录试剂盒购自北京全式金生物技术(TransGen Biotech)有限公司;SYBR®Premix ExTaqTM Ⅱ(Tli RNaseH Plus)和限制性内切酶购自宝生物工程(大连)有限公司。
1.2 方 法
1.2.1材料种植及Cd2+胁迫处理
烟草材料种植于有机土与蛭石等体积混合的花盆中,温室培养(光照16 h,22 ℃),待长出4片真叶时(约4周龄),分别用0(ck)、250 mg/L和500 mg/L氯化镉(CdCl2)溶液浇灌烟草,每周2次,每次150 mL,2周后分别采集各处理植株叶片0.2 g,用于后续试验。
1.2.2NbRS基因克隆与生物信息学分析
本实验室利用甲基化敏感性扩增多态性(Methylation-sensitive amplification polymorphism,MSAP)技术鉴定响应Cd2+胁迫相关基因,获得编号为MSAP 61-1的DNA差异片段,经在茄科植物数据库SNG(the Solanaceae Genomics Network) (http://solgenomics.net/)比对得到序列全长(基因序列编号:Niben 101 Scf 03307 g 00020.1),设计引物(见表1)扩增全长。目的条带纯化回收后连接植物表达载体,经过测序及序列比对正确,得到本氏烟草NbRS基因全长。
进一步利用NbRS基因序列在SNG数据库中检索得到其基因组序列:Niben 101 Scf 00551 Ctg 004,并获得内含子和外显子数据。利用GSDS 2.0(http://gsds.gao-lab.org)绘制基因结构图。
将NbRS蛋白序列输入SMART(http://smart.embl-heidelberg.de/),对该蛋白的结构域进行预测分析。
利用NbRS蛋白序列在NCBI中检索,获得拟南芥(Arabidopsisthaliana)以及茄科(Solanaceae)同源蛋白序列,然后通过MEGA X,采用最大似然分析法构建系统进化树(1 000次自动重复运算)。
1.2.3NbRS受镉胁迫表达量分析
用Trizol法提取不同浓度Cd2+处理一周的本氏烟草的总RNA,反转录cDNA。利用实时荧光定量PCR仪(ABI 7500),以EF1a为内参基因,分析重金属胁迫前后,候选基因表达水平的变化(引物见表1)。每个处理设置3次生物学重复,以0处理时表达量1.0为ck,低于1.0表示基因表达下调,高于1.0表示基因表达上调。采用Origin Pro 2018软件进行数据分析及作图。
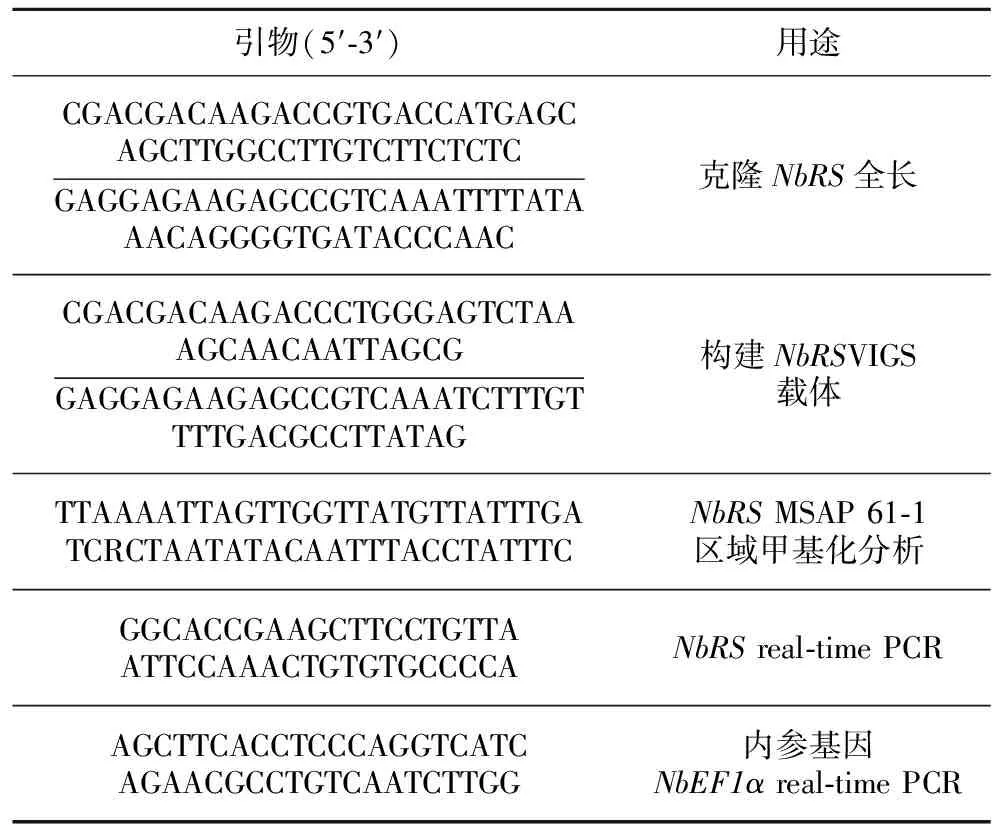
表1 NbRS基因相关引物Tlabe 1 List of NbRS-related primers
1.2.4镉胁迫对NbRSDNA甲基化水平影响
用SDS法提取不同浓度Cd2+处理完毕本氏烟草的基因组DNA,利用DNA重亚硫酸盐转化试剂盒(DP 215,天根生化科技(北京)有限公司)进行处理。以上述DNA为模板,对MSAP 61-1区域进行扩增(引物见表1),将PCR产物连接pEASY®-T 1 Cloning Vector(CT 101-01,北京全式金),测序。
1.2.5NbRS病毒诱导的基因沉默(VIGS)分析、载体构建及表型分析
VIGS载体构建。首先利用SGN VIGS Tool(https://vigs.solgenomics.net)选取NbRS基因最佳基因沉默区域设计引物(见表1),然后利用pEASY®-Uni Seamless Cloning and Assembly Kit(CU 101-01,北京全式金)将目的片段连接载体pYY 13[13]。
VIGS植物表型、重金属耐受力分析。将构建的VIGS载体转化农杆菌GV 3101,注射不大于60日龄的本氏烟草,2周后开始观察植物发育表型的变化。提取NbRSVIGS植物总RNA,以NbEF1a为内参,进行半定量RT-PCR验证候选基因沉默效果。用250 mg/L Cd2+处理VIGS植物,观察植物对Cd2+胁迫的响应。
VIGS植物光合效率测定。用Handy PEA植物效率分析仪测定植株NbRSVIGS后光合效率,时间设定为1~300 s,光源强度为3 000 μmol/(m2·s)。叶片暗适应时间通常为10~30 min。叶片夹在暗适应夹中,拉开暗适应夹上金属遮光片,将探头放在适应夹上相应的位置。对叶片进行暗适应后测定Fv/Fm值,利用Fv/Fm值进行光和效率曲线作图。
2 结果与分析
2.1 NbRS基因克隆及生物信息学分析
以编号为MSAP 61-1的DNA差异片段为模板,PCR扩增后连接到植物表达载体上,鉴定阳性克隆后测序分析。结果显示,基因编码区片段大小为1 947 bp,编码649个氨基酸。利用该基因CDS序列在SNG数据库中检索得到其基因组序列并进行分析,发现该基因有16个外显子,15个内含子(图1 A)。
进一步对该基因编码蛋白序列分析,发现含有3个保守结构域:精氨酰tRNA合成酶N端结构域(72到161位氨基酸)、精氨酰tRNA合成酶(169到520位氨基酸)和DALR反密码子结合域(534到649位氨基酸)(图1 B)。精氨酰tRNA合成酶结构域是ArgRS类蛋白家族的特征结构域[14],因此编码此蛋白的基因被命名为NbRS。位于NbRS蛋白N端的精氨酰tRNA合成酶N端结构域参与tRNA的识别[15];精氨酰tRNA合成酶结构域属于Ⅰ类氨基酰基tRNA合成酶的特征结构域,是负责激活氨基酸的催化中心结构域[16];位于NbRS蛋白C端的DALR结构域是一个全α螺旋结构域,是精氨酸tRNA合成酶的反密码子结合结构域(ABD)[17]。
以NbRS蛋白序列在NCBI数据库中Blast,获得拟南芥及茄科植物烟草(Nicotianatabacum)、马铃薯(Solanumtuberosum)、番茄(Solanumlycopersicum)中的同源氨基酸序列,使用MEGA X构建系统进化树(图1 C)。结果表明,来源于本氏烟草的NbRS与烟草和番茄来源的精氨酰tRNA合成酶序列同源性更高(group Ⅰ),而来源于拟南芥的序列(group Ⅱ)聚于一个类群。说明克隆得到的NbRS是属于精氨酰tRNA合成酶家族,与前述蛋白结构域分析结论一致。
2.2 NbRS基因沉默改变植物发育表型
目前关于NbRS基因对植物生长发育影响的研究较少,为了进一步确定该基因是否参与植物发育,通过病毒诱导的基因沉默技术(VIGS)定向下调了该基因表达(图2 A、B)。结果显示,NbRSVIGS植株中NbRS的表达量低于对照植株,VIGS植株叶片颜色变黄、叶面扭曲不平,出现凸状浅绿斑驳,叶尖向下卷曲呈杯状。结果表明,NbRS基因是控制植物生长发育的关键基因。
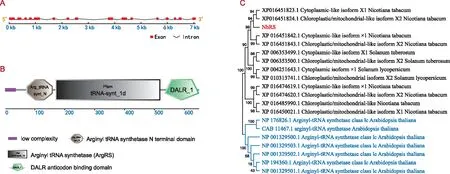
注:A为NbRS基因组序列示意图,显示了外显子和内含子。全长基因组NbRS为1 950 bp,具有 16个外显子和 15个内含子。NbRS的基因结构由GSDS 2.0(http://gsds.cbi.pku.edu.cn/index.php) 构建。B为NbRS蛋白结构域示意图。NbRS的蛋白结构由SMART (http://smart.embl-heidelberg.de/) 绘制。C为拟南芥以及茄科植物中NbRS蛋白的系统发育分析。通过NCBI网站对NbRS蛋白进行比对,构建系统发育树。来源于本氏烟草的NbRS与烟草和番茄来源的精氨酰tRNA合成酶序列同源性更高(group Ⅰ),而来源于拟南芥的序列(group Ⅱ)聚于一个类群。图1 NbRS基因及蛋白生物信息学分析Fig.1 Bioinformatics analysis of NbRS gene and encoding protein
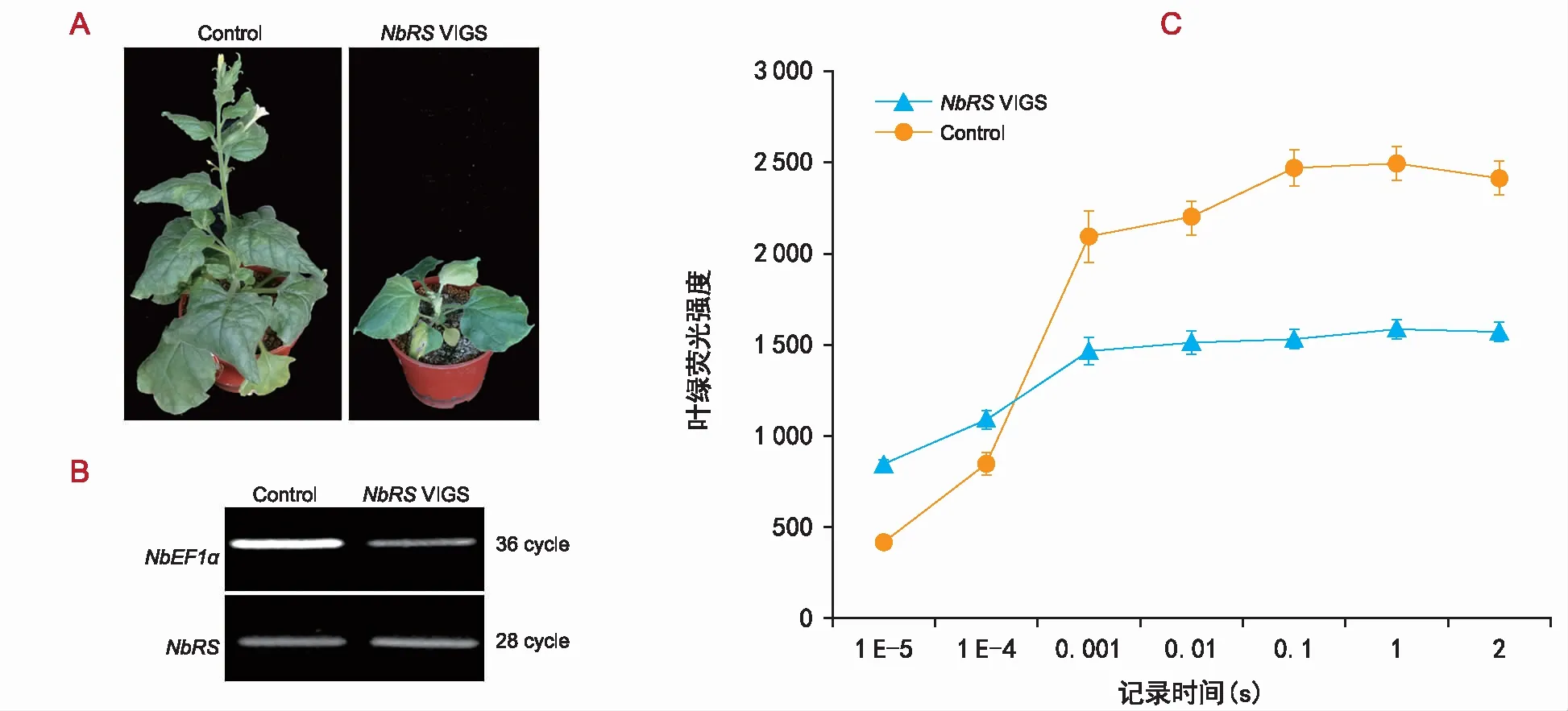
注:A为NbRSVIGS植物的表型,为了测试NbRS沉默植物的表型,构建了NbRSVIGS载体,通过农杆菌侵染到本氏烟草的植株中。空载体作对照。2周后,对对照植物和VIGS植物进行观察。与对照植物相比,NbRSVIGS植株叶片颜色变黄、叶面扭曲不平,出现凸状浅绿斑驳,叶尖向下卷曲呈杯状。B为NbRS在对照和VIGS植物中的表达水平。通过半定量RT PCR检测NbRS的表达,NbEF1α用作内标对照。C为NbRSVIGS和对照植物光合速率的测定。使用Handy PEA植物效率分析仪测定植株的光合效率,NbRSVIGS后植株的光合效率低于对照组。图2 NbRS参与植物的生长发育Fig.2 Plant growth and development mediated by NbRS gene
使用Handy PEA植物效率分析仪测定NbRSVIGS植株的光合效率(图2 C),结果显示,NbRSVIGS后植株的光合效率低于对照,说明NbRS基因沉默后,影响植株的光合效率,但具体机制需进一步研究。
2.3 Cd2+胁迫对NbRS基因组序列DNA甲基化水平影响
DNA经重亚硫酸盐转化处理后,未发生甲基化的胞嘧啶(C)转变为尿嘧啶(U),而发生甲基化的胞嘧啶(C)保持不变[18]。由图3可以看出,候选基因NbRS有1处碱基位点发生变化:由原来的胞嘧啶C脱氨转变为U(DNA中为T),表明在不同浓度Cd2+处理后,NbRS基因组序列发生去甲基化反应,甲基化水平下降。
2.4 NbRS基因参与植物响应镉胁迫反应
本研究结果表明,Cd2+处理改变NbRS基因的甲基化,而且NbRS基因沉默后导致植物的生长发育异常,但是该基因缺失对植物耐受Cd2+胁迫的影响尚不明确。为了深入确定NbRS基因是否参与植物响应Cd2+胁迫的反应,利用实时荧光定量PCR分析了不同浓度Cd2+处理的条件下,NbRS基因表达水平的变化(图2)。在250 mg/L Cd2+胁迫一周后,本氏烟草植物中NbRS基因的表达量降低,在浓度500 mg/L Cd2+胁迫一周后,NbRS基因的相对表达量升高1.7倍。结果表明,Cd2+对NbRS基因的表达有影响。
NbRS基因沉默后,植物对重金属响应Cd2+胁迫反应变化的结果(图4)显示,用250 mg/L Cd2+处理本氏烟草植株约10 d后,与对照植物对比,NbRSVIGS植株叶片明显变黄、枯萎甚至死亡,说明NbRS沉默后,植物对Cd2+胁迫的敏感性增加。
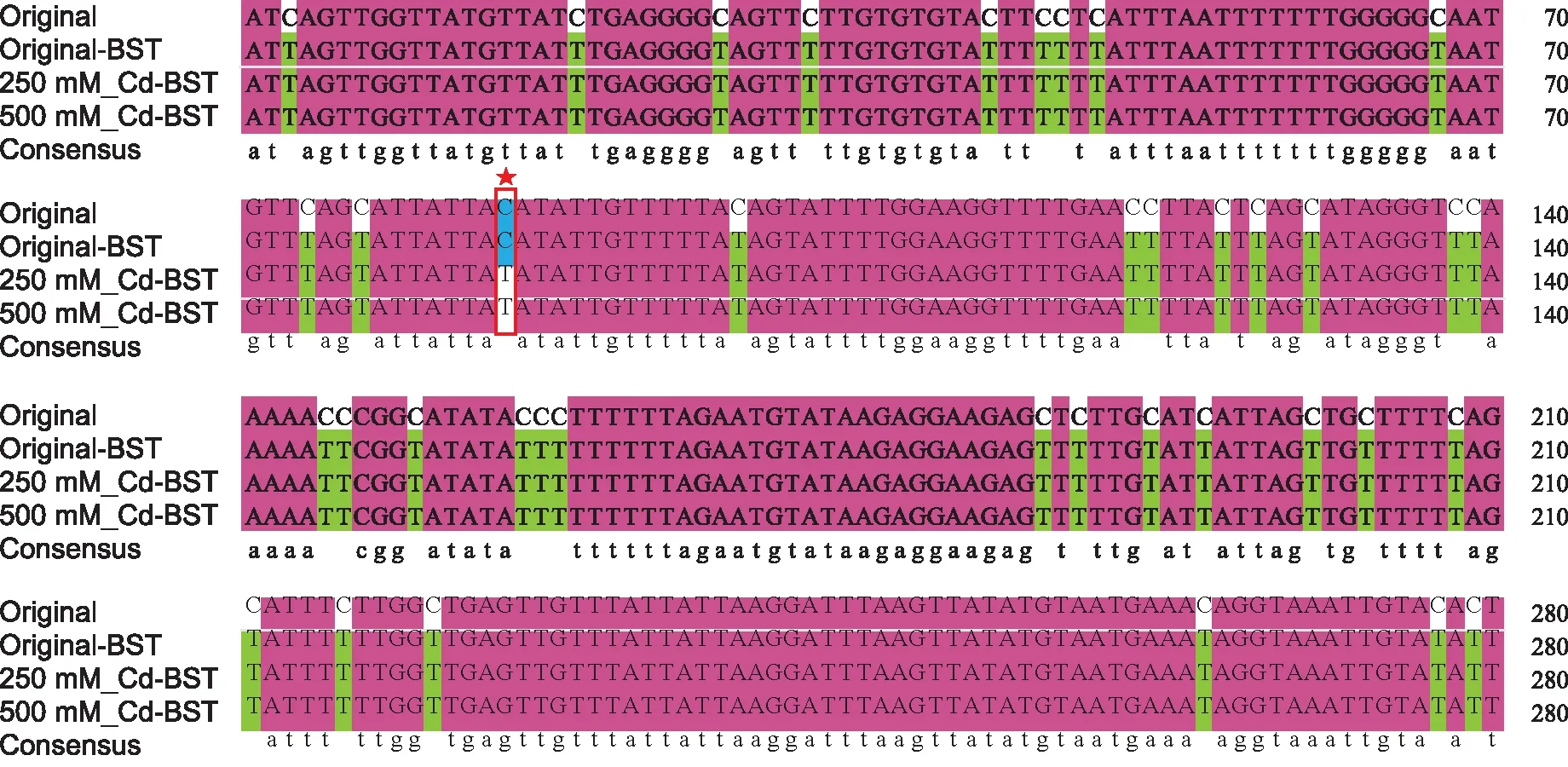
注:用星号加框标记的胞嘧啶是甲基化状态在暴露于Cd2+后发生变化的胞嘧啶。Original表示不含Cd且未经过重亚硫酸盐处理的样品。Original-BST表示不含Cd且含有重亚硫酸盐的样品。250 mM-Cd-BST表示用250 mg/L Cd2+和重亚硫酸盐处理的样品。500 mM-Cd-BST表示用500 mg/L Cd2+和重亚硫酸盐处理的样品。字母上的数字表示核苷酸的位置。从基因组序列中基因的起始密码子开始计数。NbRS只有一个CG位点(85)的甲基化状态发生了变化。该CG位点在Cd2+处理下被去甲基化。图3 NbRS在Cd2+处理前后甲基化变化情况Fig.3 Comparison of methylation changes of NbRS before and after Cd2+ treatment
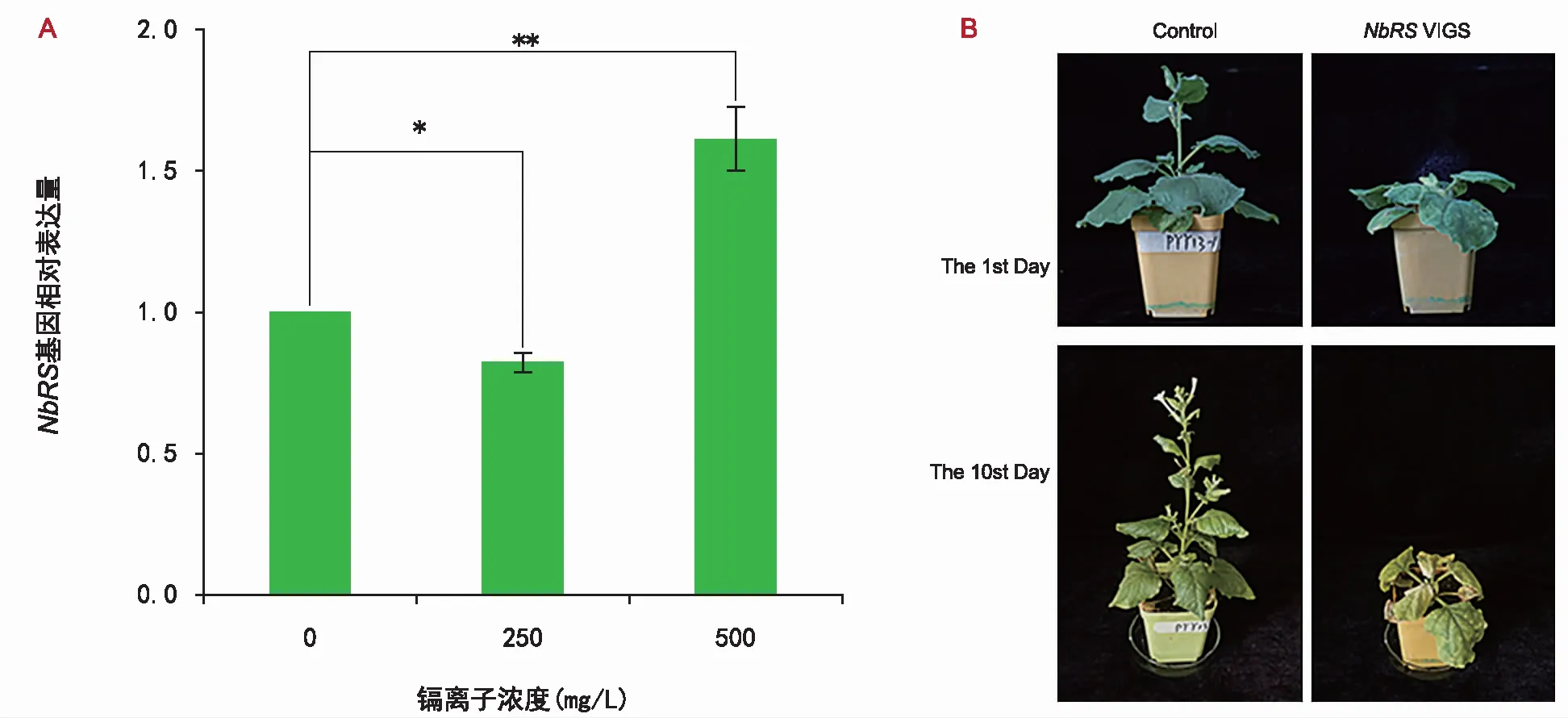
注:A为不同浓度Cd2+处理下NbRS表达的定量PCR分析。误差线表示3个独立生物学重复测量值平均值的标准差。“*”表示在p<0.05水平上的显著差异,“**”表示在p<0.01水平上的显著差异。B为NbRSVIGS植物对镉胁迫的响应。使用浓度为250 mg/L Cd2+处理植株。10 d后,通过与空载体对照植物进行比较,观察NbRSVIGS植物对Cd2+的响应。图4 NbRS基因参与植物响应Cd2+胁迫反应Fig.4 Plant response to Cd2+ stress mediated by NbRS gene
3 讨 论
精氨酰tRNA合成酶(ArgRS)参与tRNA酰基化,是蛋白质生物合成过程中具有重要功能作用的酶,属于第一类氨酰tRNA合成酶[19]。ArgRS催化的tRNA-Arg的氨基酰化反应与其他氨基酰-tRNA合成酶不同,即在tRNA Arg的存在下,才能催化ATP-PPi的交换反应。大肠杆菌ArgRS属于第一类aaRS,是由577个氨基酸残基组成的单链酶,分子量约为6.7万,目前对其研究较多的还是其结构和序列[20];哺乳动物的精氨酰tRNA合成酶是由RaRs基因编码的,在哺乳动物细胞内有两种形式的ArgRS,一种与aaRS复合物的形成有关,命名为cArgRS,另外一种是以游离形式存在于细胞中,命名为ΔNArgRS。刘杨[21]研究表明,沉默ArgRS基因引起的抗氧化应激、线粒体功能和糖代谢改善可能是治疗缺血性卒中的潜在靶点;在植物中,除了其催化精氨酰-tRNA合成的功能外,其他方面的研究很少。
本研究证实,NbRS基因是控制植物生长发育的关键基因,参与植物响应Cd2+胁迫。Cd2+胁迫能够改变NbRS基因组中基因编码区序列的甲基化修饰水平,但是具有的生物学机制和意义尚不明了。为深入研究NbRS基因功能及镉胁迫机理奠定了一定基础,为培育植物耐受或低积累镉提供了新的候选基因。
