贺兰山东坡不同植被类型的土壤真菌多样性及其群落结构
2022-04-16杨虎王佩瑶李小伟王继飞杨君珑
杨虎,王佩瑶,李小伟,王继飞,杨君珑*
1. 宁夏大学农学院,宁夏 银川 750021;2. 宁夏贺兰山国家级自然保护区管理局,宁夏 银川 750021
土壤真菌在土壤生态系统中具有分解有机物,维持土壤生态系统平衡、物质循环和能量转换的重要作用(Adélia et al.,2015);也能与植物形成共生体,促进植物生长及土壤生产力的改善(Hu et al.,2017),对土壤质量具有重要影响。土壤真菌多样性及其群落结构能反映土壤养分与土壤健康状况(Tedersoo et al.,2014)。影响土壤真菌多样性及其群落结构的主要因子有生物因素,如植被类型(Roy et al.,2013)、根系分泌物(刘淑霞等,2008)、凋落物(桑昌鹏等,2017)等;非生物因素,如土壤温度(Ma et al.,2012)、pH 值(Tripathi et al.,2012)、土壤养分状况(Cox et al.,2010)等。但不同的生态系统,其主导环境生物和非生物因子存在巨大差别(柴永福等,2016)。因此,辨析影响不同生态系统土壤真菌群落多样性及其组成的主要影响因素,对生态系统稳定性研究具有重要意义。
相对于水平分布的生态系统,山地生态系统在海拔梯度上由于生态因子的改变形成了土壤理化性质、植被类型以及区域小气候的梯度效应(谷晓楠等,2017),土壤真菌受海拔梯度效应的影响,会形成明显的地理分布特点(Cui et al.,2019)。在山地森林生态系统中,真菌群落多样性随着海拔梯度增加存在上升(Ni et al.,2018)、下降(Sheng et al.,2019)、“单峰”模式(Liu et al.,2015)、“U”型模式(Wang et al.,2015)和无明显变化(Meng et al.,2013)5种模式。这说明土壤真菌对于土壤环境变化非常敏感(Hu et al.,2014)。因此,分析不同海拔梯度植被类型的土壤真菌群落结构及其多样性对山地生态系统植被恢复及对环境变化的响应意义重大。
贺兰山是宁夏平原乃至华北地区的天然生态屏障。其植被类型在海拔梯度上分布明显,由低到高依次分为山地荒漠草地、浅山疏林和灌丛、亚高山针叶林、亚高山草甸(刘秉儒等,2014)。该区域是研究海拔梯度上不同植被类型真菌群落结构的天然场所,然而,对于该区域的研究主要集中于动植物,迄今仅有刘秉儒等(2013)利用Biolog微平板法和PLFA法对该区域土壤微生物功能多样性和群落结构做了相关报道,而PLFA法分类水平低,不能鉴定分析出微生物具体的分类水平(刘国华等,2012);高通量测序因其测序结果准确、通量高,能够准确反映土壤中微生物群落结构成为新一代被学者广泛应用的测序技术手段(楼骏等,2014)。本研究利用高通量测序技术,分析贺兰山东坡不同植被类型的土壤真菌多样性及其群落结构,阐明土壤真菌分布特征与影响因素,为贺兰山生态环境保护提供土壤微生物层面理论依据。
1 材料与方法
1.1 研究区概况
贺兰山位于银川平原和阿拉善戈壁荒漠之间,地处 38°27′—39°30′N、105°41′—106°41′E 之间(图1),山体孤立,其独特的地理位置阻挡了腾格里沙漠东移,削弱了西北寒流的侵袭。山地主体海拔在2000—3000 m之间,相对高度在1500—2000 m,由北向南地势逐渐降低,北部最高峰俄博疙瘩高达3556.1 m。该区是干旱—半干旱地区荒漠与草原的过渡带,呈现显著的过渡特征,拥有丰富的物种多样性,且在海拔梯度上呈现明显的植被类型带分布特征,由低到高大致分为荒漠草地带、疏林灌丛带、针叶林带和亚高山草甸带。该地区冬季寒冷干燥,夏季温暖少雨,是典型的大陆性气候。降雨量年季变化较大在 230—600 mm之间且具有明显的垂直分布,土壤类型主要为灰褐土、灰钙土和亚高山草甸土(刘秉儒,2010)。
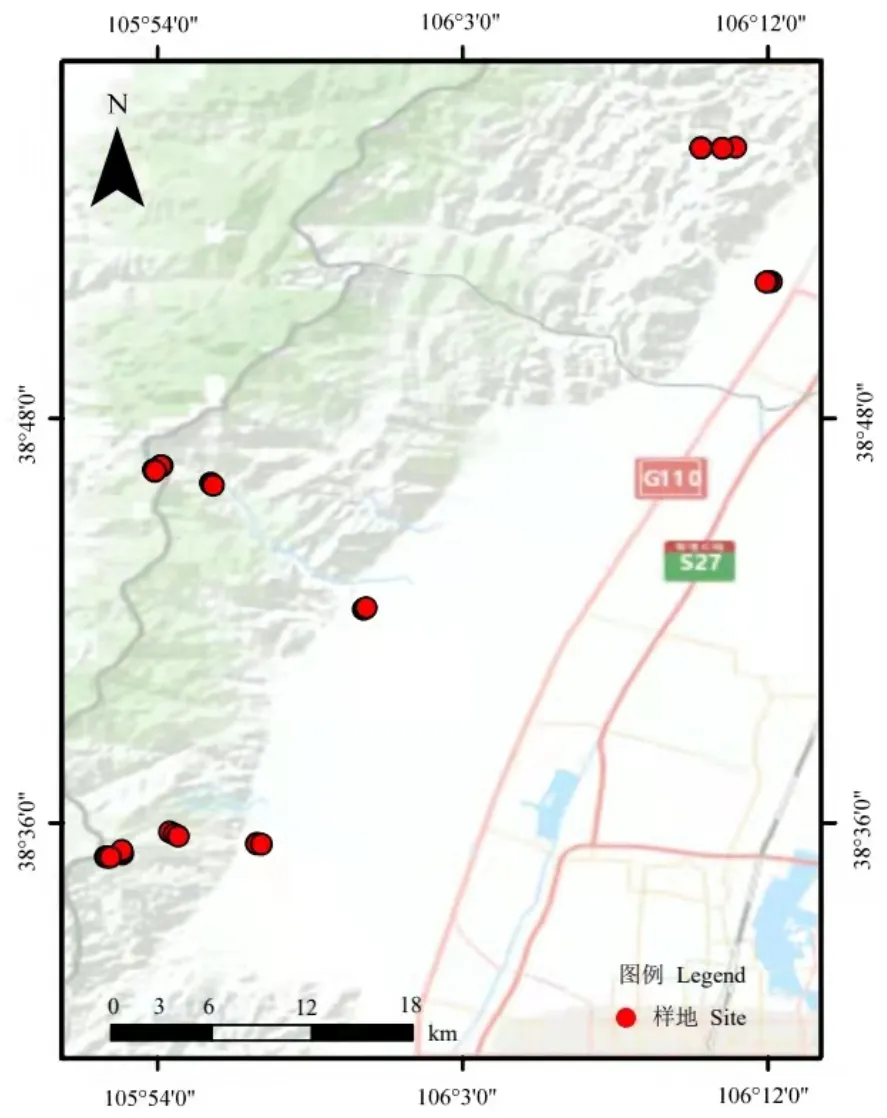
图1 样点分布图Figure 1 Sample point distribution diagram
1.2 样地设置及土样采集
贺兰山为南北走向山体,本研究从北至南分别在贺兰山东坡大水沟、苏峪口沟、大口子沟沿海拔分布建立3条调查样线。从低至高海拔按照植被类型分布(主要分布山地荒漠草地、浅山灌丛、亚高山针叶林和亚高山草甸),沿着调查样线在每个植被类型同一等高线位置建立3个重复调查样地,样地间隔100 m以上,每个植被类型共计9个重复样地。亚高山针叶林样地建立20 m×20 m的样方调查乔木;浅山灌丛在20 m×20 m样方中心和四角设置5个5 m×5 m样方调查灌木;山地荒漠草地、亚高山草甸在20 m×20 m样方中随机设置5个1 m×1 m样方调查草本。在每个样方内进行群落调查和土样采集。采用五点采样法,去除土壤上层覆盖未完全腐殖化的凋落物,在样方四角和中心点采集 0—20 cm层土样,五点土样混合作为该点的代表性样品。土壤样品带回室内后分成2份,一份−80 ℃冷冻保存,用于土壤微生物高通量测序,一份风干过2 mm筛用于土壤理化性质测定。群落调查记录物种名称、数量等,利用手持GPS记录样地的经纬度、海拔高度等地理位置信息。样地基本概况详见表1。

表1 不同植被类型样地基本概况表Table 1 Basic overview table of plots of different vegetation types
1.3 土壤理化性质测定
土壤理化性质主要测定全氮、全磷、有机质、pH值、土壤含水率等指标,土壤pH值采用酸度计法测定;有机质用重铬酸钾-外加热法测定;全氮用全自动凯氏定氮仪测定(雷磁,上海);全磷用钼锑抗比色法测定;含水率用烘干法测定。具体测定方法及所用仪器参照《土壤农化分析》(鲍士旦,2000)进行。
1.4 植物多样性指数计算
植物 Margalef丰富度指数(R)和 Shannon-Wiener多样性指数(W)指数参照相关方法(李聪等,2020)进行计算。
1.5 气象和地形数据获取方法
依据采样点的经纬度和海拔等数据,从全球气象数据库(http://worldclim.org/)获取温度、降雨量、太阳辐射等气象数据;依据样地坐标利用Arc GIS 9.3软件中数据高程模型(Digital Elevation Model,DEM)栅格,生成坡向、坡度等地形图后对数据层的样地坡向和坡度数据进行提取。
1.6 土壤真菌高通量测序流程
土壤真菌高通量测序,由百迈客生物科技有限公司(北京)完成。土壤真菌总DNA抽提,按照土壤DNA提取试剂盒(Omega Bio-tek,Norcross,GA,U.S.)操作步骤进行。以琼脂糖凝胶(1%)电泳检测DNA纯度和浓度。真菌ITS1区序列扩增,引物序列为 ITS1F:(5′-CTTGGTCATTTAGAGGAA GTAA-3′);ITS2R:(5′-GCTGCGTTCTTCATCGA TGC-3′)(Bellemain et al.,2010)。PCR 扩增所采用的物品有TransGen AP221-02快速测序的高保真DNA聚合酶和ABI GeneAmp® 9700型的PCR仪。PCR扩增体系:10×FastPfu缓冲液2 μL,dNTPs(2.5 mmol·L−1)2 μL,引物(5 μM)0.8 μL,rTaq 聚合酶0.2 μL,DNA模板10 ng和无菌水补至总体系20 μL。PCR扩增条件:98 ℃ 2 min初始变性、98 ℃15 s 条件下 25—30 个循环、55 ℃退火 30 s、72 ℃延伸 5 min(孙倩等,2019)。使用 AxyPrepDNA(AXYGEN公司)凝胶回收试剂盒酶切目的片段并回收 PCR产物,纯化和定量后形成测序文库,质检合格后基于PacBio测序平台进行测序。依据PCR引物序列和barcode序列区别划分所有样本数据,原始数据经过FLASH(V 1.2.11)软件对每个样品Reads拼接,拼接后对原始数据中残留的引物和barcode等人工序列进行切除,经过QIIME(1.9.1)软件过滤处理,使用UCHIME(V 4.2)软件去除嵌合体得到有效高质量的Tags数据(有效序列数)(Elizabeth et al.,2009)。以相似性为 97%,使用UPARSE(7.0.1090)软件,将序列聚类为分类操作单元(OTUs)。采用UNITE(8.0)数据库对97%同源性的OTUs代表序列进行物种注释分析,之后对每个样品的所有数据做均一化处理。
1.7 数据分析方法
利用Excel 2010软件对土壤理化性质和微生物多样性指数数据进行整理和计算;用SPSS 22软件进行单因素方差分析(One-Way ANOVA),采用Duncan法进行多重比较,显著性水平设为P<0.05;采用 Mothur(1.30.2)软件计算 α多样性指数(Shannon、Simpson、Ace、Chao1等指数);利用R(3.6.3)软件做土壤真菌群落 PCoA图、门水平下真菌群落丰度堆积图和土壤环境因子与门水平土壤真菌相关性热图,采用方差分解分析(Variance partitioning analysis,VPA)测量植被、海拔和环境因子对真菌群落结构变化的相对贡献。
2 结果与分析
2.1 不同植被类型的土壤性质及环境因子
不同植被类型的土壤理化性质以及环境因子数据详见表2。山地荒漠草地土壤 pH显著高于其他植被类型;土壤含水率随海拔上升显著增加;不同植被类型土壤全氮、全磷差异不明显;土壤有机质在亚高山针叶林最高,在山地荒漠草地最低,且差异显著(P<0.05);海拔、年均降雨量、太阳辐射、年均温在山地荒漠草地和浅山灌丛间差异不显著;而与亚高山针叶林以及亚高山草甸之间均有差异,且随着海拔的增高,年均降雨量逐渐升高,而太阳辐射和年均温逐渐降低;不同植被类型间坡向差异不明显,但是坡度随着海拔升高逐渐增大且山地荒漠草地坡度显著低于其他类型。植被多样性指数由高到低表现为浅山灌丛最高,亚高山针叶林最低,且差异显著。
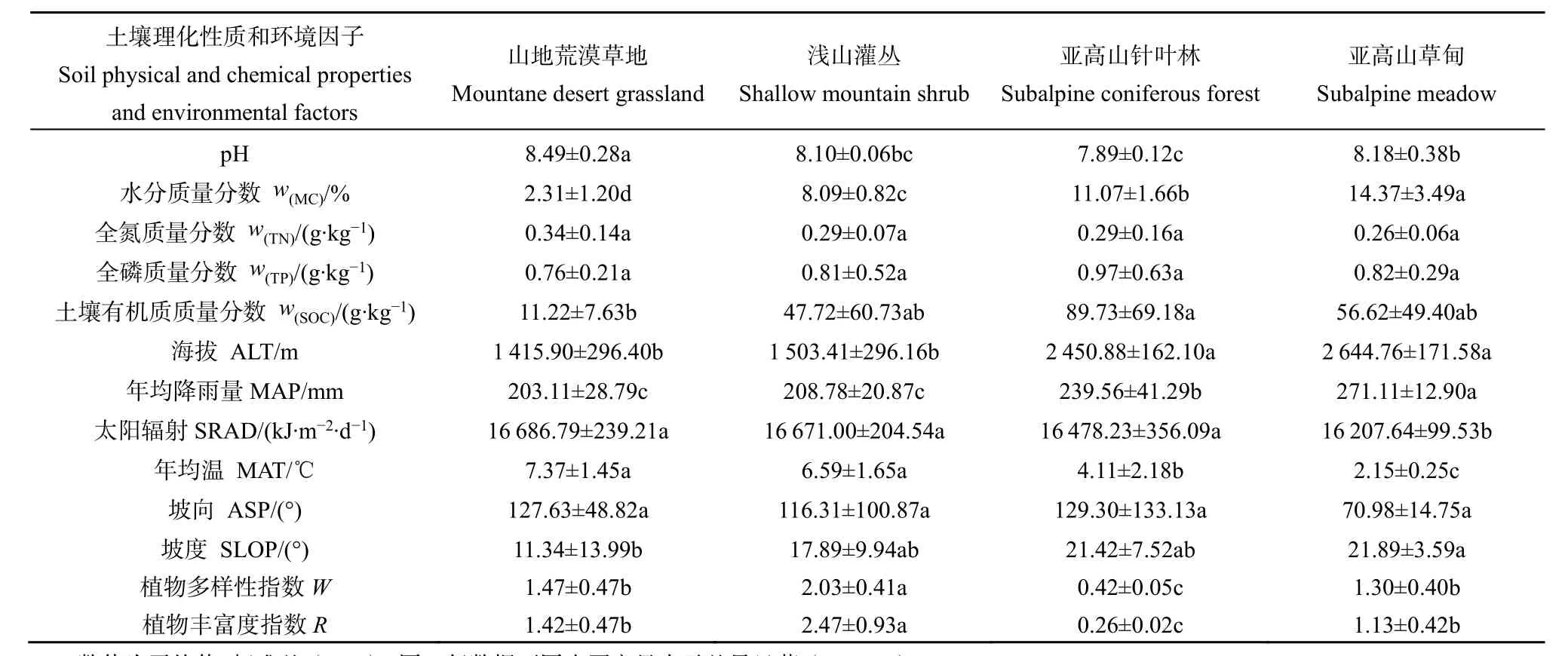
表2 不同植被类型土壤理化性质及环境因子Table 2 Soil physical and chemical properties and environmental factors of different vegetation types
2.2 不同植被类型的土壤真菌多样性及群落构成
2.2.1 土壤真菌多样性测序
通过测序,36个样本共检测到有效序列256993个,经过滤优化后共得到高质量序列249745个,平均序列长度606 bp,在97%的序列相似性水平下对序列条数进行聚类共检测到 OTU 7988个,平均文库覆盖率 97%以上。稀释曲线可以有效反映土壤真菌OTU数随测序量的变化情况,由图2可知,随着测序数量的增大,所有样地的有效序列数都趋于平缓且稳定,说明测序数据量合理,本次测序结果可以准确反映不同样地不同真菌群落数目。
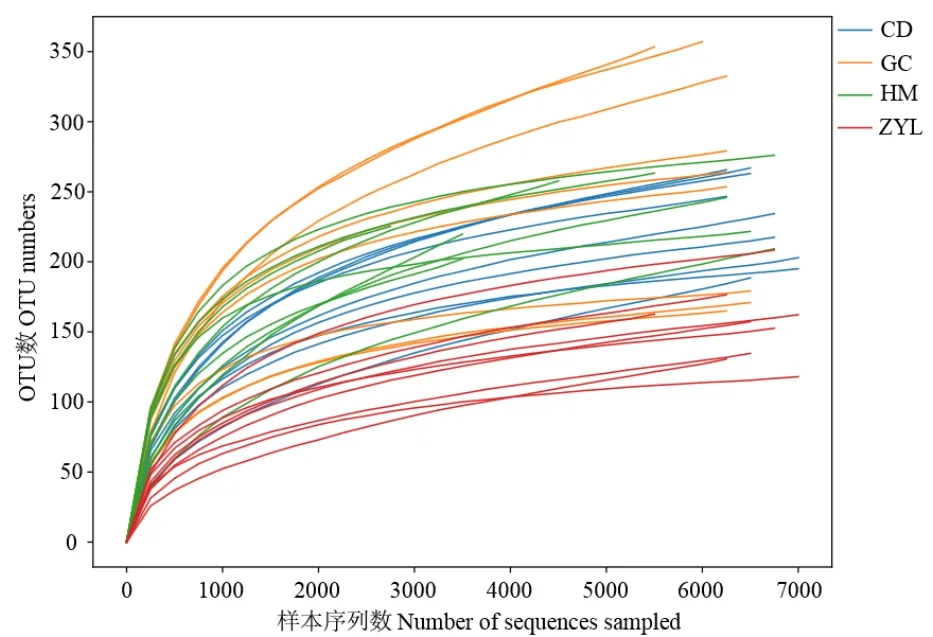
图2 稀释性曲线Figure 2 Rarefaction Curve
2.2.2 真菌多样性分析
对不同植被类型土壤真菌 OTU数和土壤真菌α多样性指数统计分析(表3),结果表明OTU数和 Ace、Chao1、Shannon、Simpson指数指数由高到低都表现为浅山灌丛>山地荒漠草地>亚高山草甸>亚高山针叶林,且亚高山针叶林显著低于其他植被类型(P<0.05)。
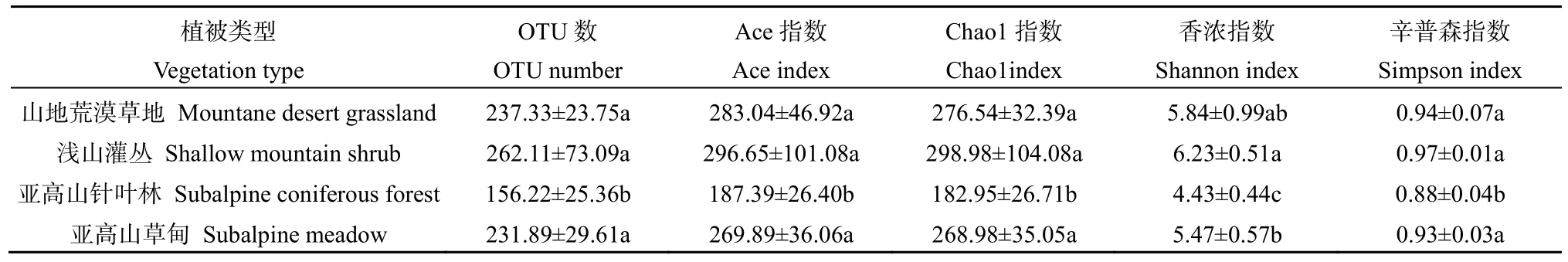
表3 不同植被类型土壤真菌OTU数和α多样性指数Table 3 Soil fungi OTU number and α-diversity index of different vegetation types
主坐标分析(PCoA)表明(图3),不同植被类型土壤真菌群落整体上存在差异性。浅山灌丛真菌群落分布相对扩散,说明该植被型土壤真菌群落组内差异性较大;其他植被类型土壤真菌群落组内相似性较高;与此同时亚高山针叶林较其他植被类型主体真菌群落分布分散,说明亚高山针叶林与其他植被类型真菌群落结构差异较大,这与α多样性指数分析结果一致。
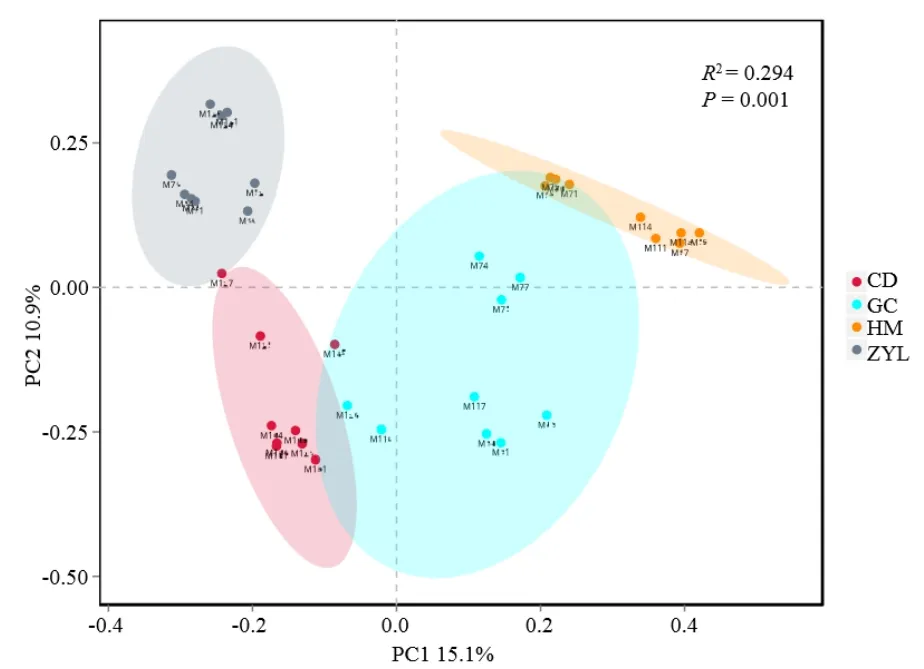
图3 土壤真菌群落PCoA图Figure 3 PCoA diagram of soil fungal community
2.2.3 真菌群落组成分析
贺兰山东坡不同植被类型土壤真菌相对丰度如图4所示,相对丰度大于1%的真菌门为子囊菌门(Ascomycota,丰度范围 21.2%—60.4%,均值46.7%)、担子菌门(Basidiomycota,12.8%—57.2%,29.6%)、球囊菌门(Glomeromycota,0.3%—18.9%,均值11.5%)、被孢霉门(Mortierellomycota,3.1%—19.9%,9.4%)、壶菌门(Chytridiomycota,0.5%—1.4%,1%);其中,子囊菌门和担子菌门真菌平均丰度占比达到了75.9%,是贺兰山东坡优势真菌群落。子囊菌门和球囊菌门真菌在海拔植被带丰度由高到低依次为山地荒漠草地、浅山灌丛、亚高山草甸、亚高山针叶林;担子菌门和被孢霉门丰度由高到低依次为亚高山针叶林、亚高山草甸、浅山灌丛、山地荒漠草地;壶菌门丰度由高到低依次为亚高山草甸、亚高山针叶林、浅山灌丛、山地荒漠草地。总体而言,不同植被类型真菌门水平相对丰度存在差异,尤其亚高山针叶林真菌群落丰度显著不同于其他植被类型。
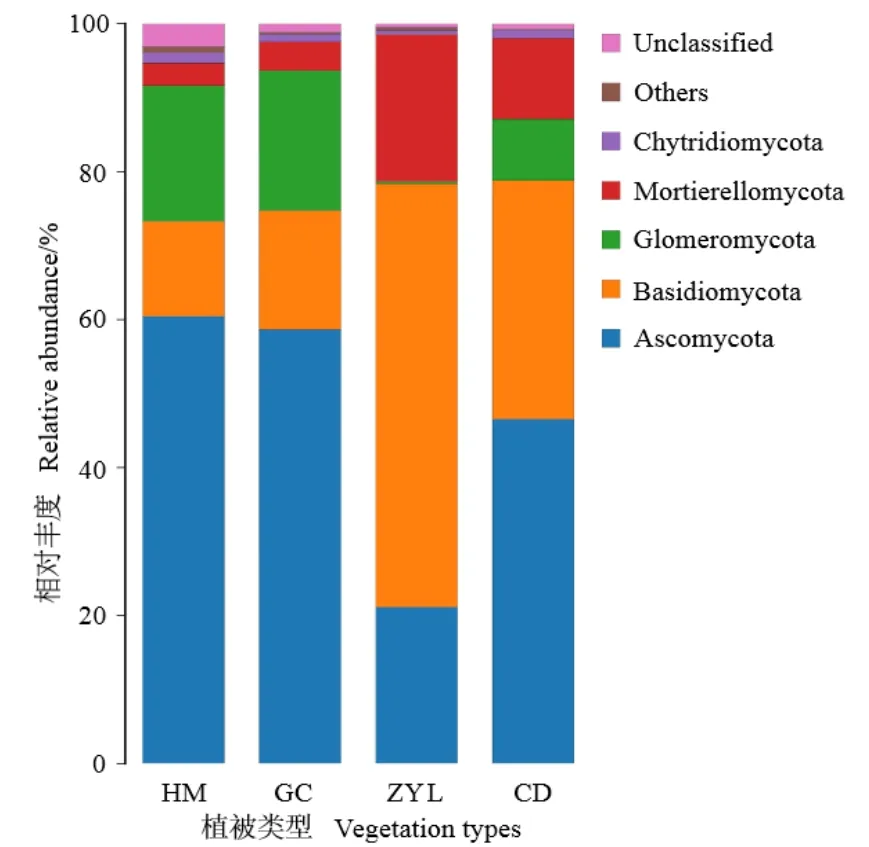
图4 不同植被类型土壤真菌群落组成堆积图(门水平)Figure 4 The accumulation diagram of soil fungal community composition of different vegetation types(phylum level)
2.3 土壤真菌群落和多样性与生态因子相关性分析
通过对门水平上优势真菌群落与植物多样性指数、土壤理化性质以及水热因子进行Pearson相关性分析发现(图5),大多数真菌群落在门水平上与以上因子有显著的相关性。如担子菌门真菌与植物丰富度指数、Shannon-Wiener多样性指数、土壤pH极显著负相关,与年均温显著负相关,与土壤含水率和海拔极显著正相关;被孢霉门与植物丰富度和Shannon-Wiener多样性指数极显著负相关,与年均温显著负相关,与土壤有机质和海拔极显著正相关,与年均降雨量和土壤含水率显著正相关;子囊菌门与植物 Shannon-Wiener多样性指数、pH极显著正相关,与植物丰富度指数、太阳辐射和年均降雨量显著正相关,与土壤有机质和海拔极显著负相关,与年均降雨量和土壤含水率显著负相关;球囊菌门与植物丰富度和 Shannon-Wiener多样性指数极显著正相关,与年均温显著正相关,与土壤含水率和海拔显著负相关。
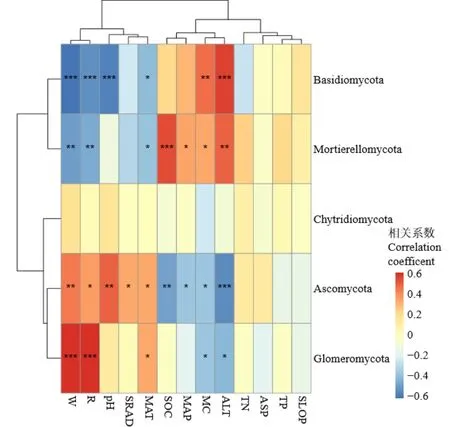
图5 门分类水平土壤真菌群落与环境因子相关性热图Figure 5 Heat map of the correlation between soil fungal communities and environmental factors at the phylum classification level
在山地生态系统中,土壤真菌受多种环境因子的影响。本研究利用方差分解分析(VPA)将所有影响因子归为植被、海拔和环境因子三类,定量研究了各类因子对土壤真菌群落的影响(图6)。结果表明,植被类型、环境因子、海拔分布解释了土壤真菌群落变异的 11%、9%、6%。与此同时各因子之间协调作用,植被与环境因子共同解释率 9%,环境与海拔共同解释率为33%,植被与海拔共同解释率为5%,三者协同解释率为7%。
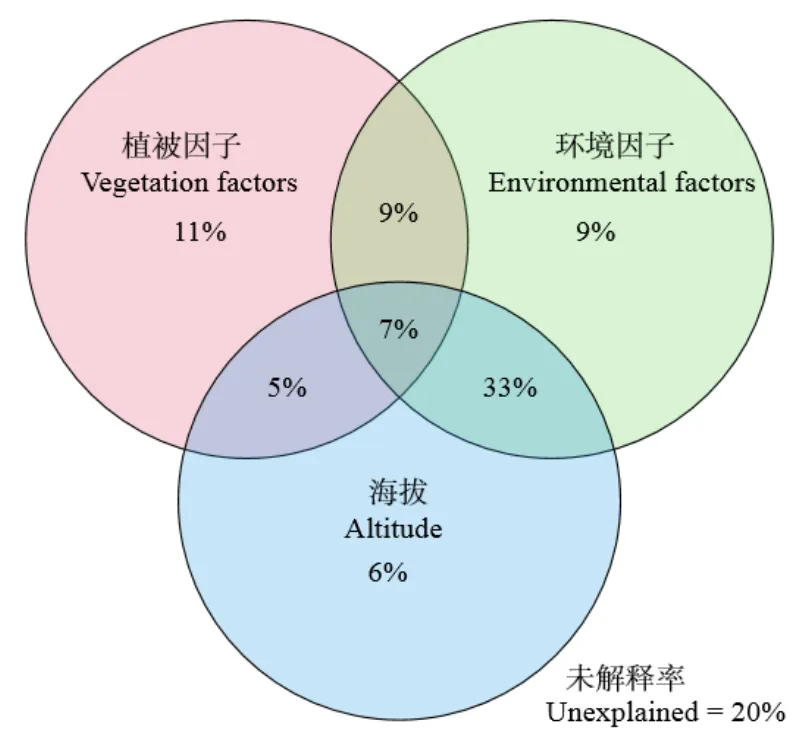
图6 影响真菌群落的因子方差分解分析Figure 6 Variation partitioning result of factors affecting fungal community
通过分析海拔、植物多样性与土壤真菌多样性的相关关系,来确定植被及海拔对土壤真菌多样性的影响程度(图7);结果表明,植物多样性指数与真菌 Ace多样性指数都呈极显著正相关(P<0.001),海拔与Ace指数相关性不明显。由此说明,贺兰山东坡土壤真菌群落多样性受植被的影响大于海拔。
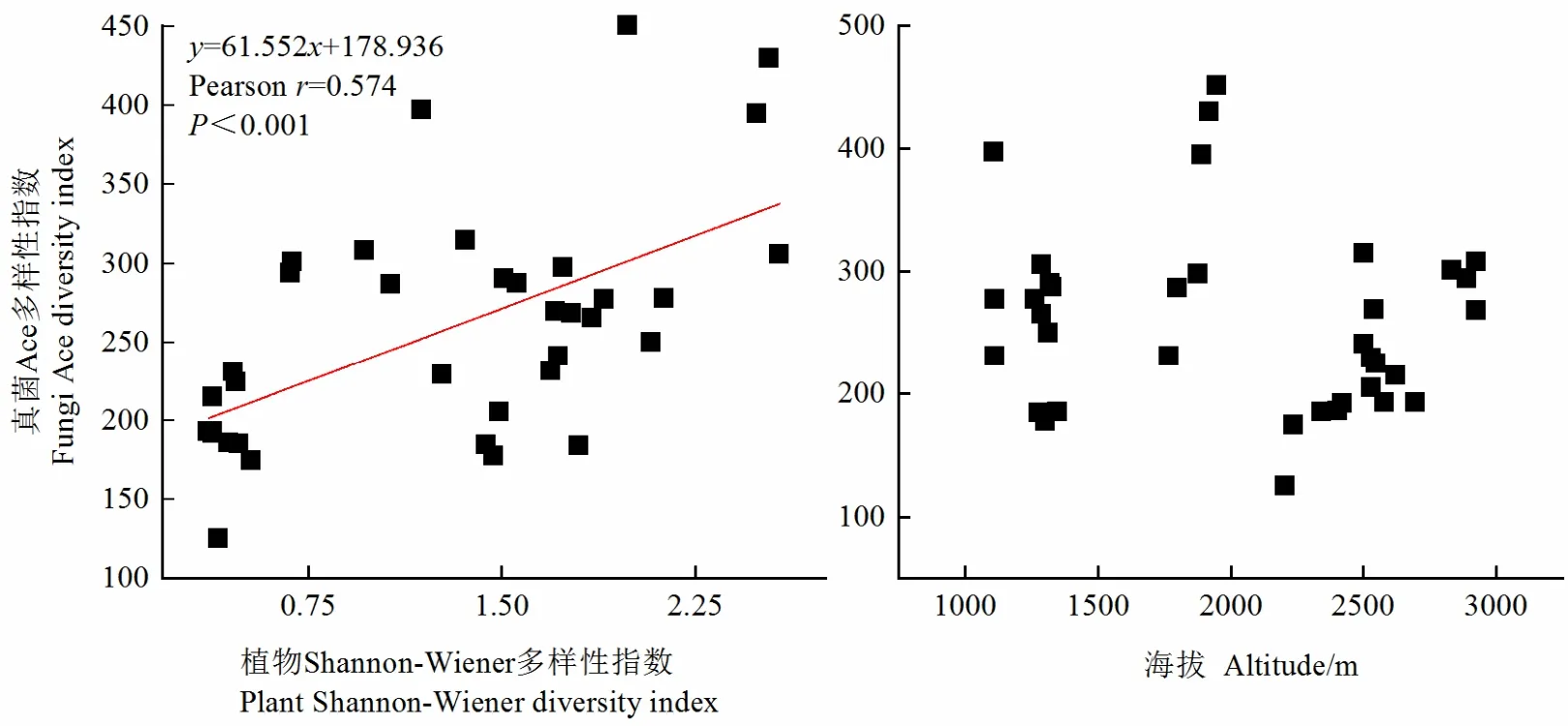
图7 植物多样性、海拔与真菌多样性之间的相关关系Figure 7 Correlation between plant diversity, altitude and fungal diversity
3 讨论
3.1 土壤真菌多样性及其群落组成
植物在生长过程中不断的从土壤中汲取营养物质和水分的同时向土壤中释放大量的分泌物,进而影响土壤环境的变化以及土壤微生物多样性(袁仁文等,2020)。植物种类越丰富,其分泌物和凋落物种类也就越多,土壤微生物多样性和丰富度也就越高(Coroi et al.,2004),本研究中植物丰富度和多样性指数高的植被类型中,真菌多样性指数也较高。对贺兰山东坡不同植被类型土壤真菌群落及其多样性的分析表明,亚高山针叶林土壤真菌多样性、丰富度指数和OTUs数都显著低于其他植被类型。可能是针叶林植被较其他植被类型物种单一,林下伴生植物相对欠缺且凋落物以及分泌物种类少,适于微生物生存的生态幅较窄从而存活率较低有关(Zak et al.,2003)。
本研究门水平上相对丰度>1%的真菌群落共检测到子囊菌门、担子菌门、球囊菌门、被孢霉门和壶菌门5个门;其中子囊菌门和担子菌门平均丰度达到75%以上,是贺兰山东坡土壤优势真菌群落。这与张树萌等(2018)和周煜杰等(2021)的研究结果较为相似。不同植被类型门水平上真菌群落组成差异不大,但是相对丰度存在一定差异,与王诗慧等(2021)对天山林区土壤真菌群落研究得出一致的结论。山地荒漠草地、浅山灌丛、亚高山草甸中子囊菌门占据优势地位,而在亚高山针叶林中,担子菌门真菌是绝对的优势真菌群落。究其原因,可能与植被种类的不同有很大的关系(陈秀波等,2019)。亚高山针叶林中,主要植被为青海云杉纯林,植被类型相对单一,而其他植被类型主要包括草本以及灌木,且植被种类相对丰富。已有研究表明,子囊菌门真菌以腐生菌居多,可分解多种难降解物质(Beimforde et al.,2014)而担子菌门真菌能够降解木质素等难以分解的物质(Frey et al.,2004),且在木质素含量较高是植被中占据优势(Bossuyt et al.,2001)。相对于灌木和草本,乔木林木质素含量更高,所以在亚高山针叶林中担子菌门真菌占据优势地位;其它植被类型中,植物种类较多,能够产生多种凋落物和分泌物,更有利于子囊菌的生存。除此之外,Tedersoo et al.(2014)也认为担子菌门和子囊菌门真菌能够积极响应土壤pH值的变化,且子囊菌门在pH较高的土壤中丰度更高。本研究中,子囊菌门的丰度变化与pH值表现出一致性,很好的证实了这一结论。
3.2 土壤真菌多样性及其群落组成的影响因素
森林生态系统中,植被类型和海拔是影响土壤真菌多样性的两大因素。真菌多样性与植物多样性和海拔的Pearson相关性表明(图7)真菌多样性与植物多样性显著正相关,与乔沙沙等(2017)对关帝山土壤真菌群落研究结果一致;说明不管是生物量较小草本植物还是生物量相对较大的木本植物,都可能因为物种的不同而提供不同质量的根际环境、凋落物和分泌物而产生互补的地下生态位,从而可以支持各种真菌有更大的多样性(Yang et al.,2017)。而真菌多样性与海拔没有表现出规律性,说明贺兰山东坡植被类型较海拔对土壤真菌多样性的影响更大。
土壤微生物群落结构受多种因素的影响,在不同区域、不同的森林土壤生态系统中影响土壤真菌群落组成的因素各有异同。例如罗正明等(2020)研究表明土壤 pH、植物丰富度和总碳含量是影响五台山土壤真菌群落结构的重要因素;盛玉钰等(2018)研究表明土壤pH、植物多样性、土壤湿度和土壤温度可能是影响神农架土壤真菌群落结构的重要因素;周煜杰等(2021)研究表明土壤有效磷含量、pH和海拔是影响秦岭火地塘土壤真菌群落的主要驱动因子。本研究结果表明,植物多样性、pH、年均温、土壤有机质、年均降雨量、土壤含水率及海拔都可能会影响到真菌群落组成。虽然以上结果各有异同,但其影响因素都离不开植被、气候、土壤、环境因子等,以上因子已然成为影响土壤真菌群落组成的最佳预测因子。
