福鼎槟榔芋软腐病病原菌的分离和鉴定
2022-04-14董晓菲林镇金刘盛荣吴小蝶叶祖云
董晓菲, 林镇金, 刘盛荣, 吴小蝶, 季 红, 叶祖云
(1.宁德师范学院,福建 宁德 352100;2.福建省特色药用植物工程技术研究中心,福建 宁德 352100; 3.深圳湾实验室,广东 深圳 518000)
槟榔芋[Colocasiaesculenta(L.) Schott]属天南星科芋属中魁芋类,是多年生草本植物,在我国常作一年生栽培作物,别名福鼎芋、魁芋、野生芋等,原产于福建、广西等地区[1].槟榔芋球茎个大,呈椭圆状,外皮粗糙带环状印,芋肉白中带紫红纹,富含淀粉和蛋白质等多种营养物质,深受消费者喜爱.2011年“福鼎槟榔芋”获得原中华人民共和国农业部农产品地理标志登记,目前已成为福鼎的支柱产业,种植面积超2 000 hm2,产值逾3亿元[2-5].槟榔芋软腐病是一种常见细菌性病害,又名茎腐病,是槟榔芋种植中发生最为严重的病害之一;其主要危害地下球茎或叶柄基部,可致球茎内部腐烂,植株发黄萎蔫,最后死亡;病菌可越冬,高温高湿易发病[6].近年来,随着福鼎槟榔芋种植面积的增大以及连作、非适宜地块种植的发生,软腐病发病率逐年增加,达40%以上,对槟榔芋产量和农民收入造成巨大影响[7].有关槟榔芋软腐病的研究主要集中在发生症状、传播特点和防治技术等方面[6,8-10],但关于引起槟榔芋软腐病的病原菌的鉴定和生物学特性尚未见报道.本试验从患软腐病的槟榔芋球茎分离到胡萝卜软腐果胶杆菌,对其进行鉴定,并测定其致病性和生物学特性,以期为福鼎槟榔芋软腐病的诊断和防治提供参考.
1 材料与方法
1.1 材料
患病槟榔芋球茎样品取自福建省福鼎市贯岭镇何坑村槟榔芋种植田地.
营养琼脂(NA)培养基(青岛海博生物),细菌基因组DNA试剂盒(康为世纪生物),药敏纸片(英国OXOID),升汞、乙醇、葡萄糖、淀粉、甘露醇(上海国药集团)等试剂.
1.2 方法
1.2.1 软腐病病原菌的分离纯化 参考方中达[11]的方法略有改动:将采集的发病槟榔芋球茎用水冲洗并晾干,用无菌剪刀将其切成约0.5 cm见方的组织块,经0.1%(体积分数)升汞和75%(体积分数)乙醇表面消毒和无菌水漂洗,晾干后置于无菌研钵中,加5 mL无菌水研磨成浆状;静置10~15 min后,将组织研磨液梯度稀释10、102、103倍,各取100 μL至NA平板上涂布,每个处理重复3皿,于37 ℃恒温培养24~48 h;根据涂布平板上菌落的形态、透明度、颜色等挑取特征一致的单菌落进行分离纯化,纯化3~5次后将分离出的优势单菌落置于斜面试管中4 ℃保存,同时将纯化好的菌株接种于液体NA培养基中,37 ℃下培养24 h,吸取适量菌液和甘油,使得甘油终浓度达20%,保存于-20 ℃的冰箱中备用.
挑取形态特征一致的优势单菌落进行分离纯化,纯化2~5次,将纯化的优势菌落接种于NA试管培养基中37 ℃培养24 h.
1.2.2 菌株的离体和田间活体回接致病性测定 根据Koch′s法则对分离菌株的致病性进行离体测定.将菌株接种于NA液体培养基中,37 ℃培养24 h,再用0.75%(体积分数)无菌生理盐水稀释成浓度约为1×108CFU·mL-1的菌悬液,备用.选取健康槟榔芋球茎,洗净晾干后切取大小3 cm×3 cm×0.7 cm的长方块,用0.1%(体积分数)升汞和75%(体积分数)乙醇表面消毒和无菌水充分涤荡后,放入有滤纸的无菌培养皿中,备用.采用无菌有伤接种法进行接种:用无菌刀和无菌镊子在处理后的组织块中央划约1 cm×1 cm×0.3 cm的十字伤口,注入20 μL菌悬液,以注入无菌水的槟榔芋为空白对照,设3次重复,于37 ℃恒温培养至少7 d[12-13].观察组织块发病症状是否与田间自然患病情况一致,若不一致则按1.2.1方法重新分离病原菌,并与最初接种菌的菌落形态和颜色进行比较[14].
分离菌株对田间活体的致病性测定:用无菌剪刀在健康槟榔芋球茎上制造伤口,每株一个伤口,用无菌针头吸取菌悬液缓慢注入伤口处,然后用细菌过滤膜密封并覆土标记,以注入无菌水的槟榔芋为空白对照,培养7 d后观察球茎发病情况是否与田间自然患病情况一致.
1.2.3 菌株的分子鉴定 采用细菌基因组DNA试剂盒提取DNA并进行PCR扩增,通用引物为27F(5′-AGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′).扩增程序:94 ℃预变性10 min、94 ℃变性45 s、55 ℃退火45 s、72 ℃延伸90 s、72 ℃再延伸10 min,30个循环.反应体系:DNA 2 μL、上下游引物各2 μL、10×Buffer 4 μL、dNTP 2.5 μL、Taq酶 0.2 μL,加 ddH2O至20 μL.结束后于4 ℃保存.将PCR产物委托擎科生物技术有限公司测序后,用MEGA 5的邻接法构建基于16S rDNA的系统进化树.
1.2.4 菌株的药敏试验 采用琼脂扩散纸片法(K-B)进行药敏试验.将菌株划线接种于NA平板上,于37 ℃恒温箱培养18~24 h,挑取3~5个单菌落溶于0.75%无菌生理盐水,制成浓度约为5×107CFU·mL-1的菌悬液.吸取150 μL菌悬液均匀涂布于NA平板培养基上,放置片刻,待菌液被吸收后,用无菌镊子将OXOID成品药敏纸片轻轻贴在平板上,每皿贴3片,每种一皿,37 ℃培养24 h后测定各培养皿中抑菌圈的直径[15].参考NCCLs药敏试验标准判断其敏感性[16]:抑菌圈直径大于25 mm为高度敏感(S);抑菌圈直径在15~25 mm为中度敏感(M);抑菌圈直径小于15 mm为耐药(R).本试验所用药物为头孢菌素、环丙沙星、头孢噻肟、头孢西丁、氯霉素、萘啶酸、头孢哌酮、四环素、头孢曲松、头孢唑啉、阿米卡星、阿莫西林克拉维酸、庆大霉素、青霉素、复方磺胺、链霉素、复方新诺明、磺胺甲恶唑、头孢唑肟、头孢他啶、头孢吡肟共计21种.
1.2.5 生物学特性测定 形态观察:从平板挑取培养24 h的单菌落制作装片,经革兰氏染色和鞭毛染色,在光学显微镜(宁波舜宇,E5)和透射电镜(HITACHI Instrument Tokyo, H600)下观察[14].
生理生化特性[17]:分别对菌株的需氧型、荧光反应、接触酶、明胶水解、淀粉水解、葡萄糖产酸、甘露醇产酸、V-P、吲哚、苯丙氨酸脱氨酶、柠檬酸盐利用、硝酸盐还原、丙二酸利用等进行试验.
pH对菌株生长的影响:将菌株接种于不同pH(5.0、6.0、7.0、8.0、9.0、10.0)的NA培养基,于37 ℃恒温培养48 h.温度对菌株生长的影响:将接菌的NA培养基在不同温度(4、20、28、37、41、45 ℃)下恒温培养48 h.耐热性:将菌株经65 ℃水浴30 min后,于37 ℃恒温培养48 h.培养期间每隔8 h测一次菌液D600 nm值,同时观察菌株生长状况,各处理重复3次[17].
2 结果与分析
2.1 田间发病症状
患病初期的植株与健康植株相比,外部特征无明显差异,但拔起时易断,球茎内部中心组织软化腐败,出现黏液并伴有腐烂恶臭味.后期地下球茎外围出现腐烂,最终全株发黄枯萎死亡(图1).

A.横切图;B.纵切图.图1 槟榔芋球茎软腐病发病症状Fig.1 Symptoms of soft rot disease in areca taro
2.2 菌落形态特征
图2 菌落形态特征Fig.2 Morphological characteristics of colony
采用平板划线法从槟榔芋球茎不同发病部位共分离得到6株细菌样品.其大小、颜色和形态均相似,菌落均为圆形,边缘整齐,表面光滑湿润,直径1~2 mm,乳白色,质地均匀,扁平状,有臭味(图2).
2.3 菌株的离体和田间活体回接致病性
从上述6株细菌样品中选取一株菌株,编号为141108.将其接种到健康槟榔芋组织块,7 d后芋块出现轻微变色,15 d后芋块腐烂并散发臭味,发病症状与田间自然患病情况基本吻合,对照组则没有变化(图3).从发病的芋块中划线分离病原菌,获得与接种菌株形态特征一致的病菌.
田间活体回接试验表明,培养7 d后接入菌株141108的植株球茎伤口处腐烂变软并散发臭味,其发病症状与田间自然患病情况基本一致,而对照组无变化(图4).根据Koch′s法则,分离的菌株为槟榔芋软腐病病原菌.
2.4 菌株的分子鉴定
提取菌株141108的DNA,经PCR扩增后得到一条清晰、明亮条带,分子大小约1 500 bp,与预期一致(图5A).
根据擎科生物技术有限公司测序结果,序列大小为1 419 bp.将序列上传至NCBI(登录号:KX525243.1),进行DNAMAN序列分析和BLAST比对,并用MEGA 5的邻接法构建16S rDNA系统进化树(图5B).结果显示,菌株141108与胡萝卜软腐果胶杆菌胡萝卜软腐亚种[Pectobacteriumcarotovorumsubsp.carotovorumKNU28210 (GU936993.1)]亲缘关系最近,相似度99%.

A.空白对照;B.注入菌悬液的槟榔芋块.图3 菌株141108对离体球茎的致病性Fig.3 Pathogenicity of strain 141108 to taro corm in vitro
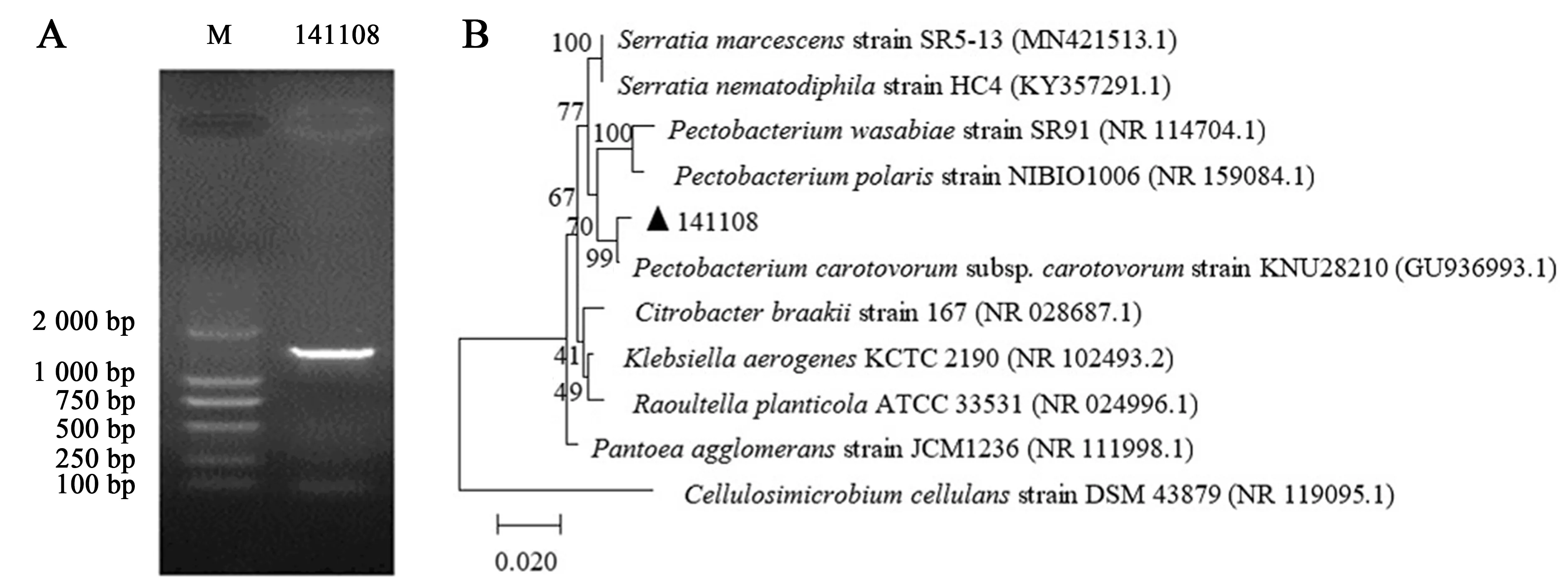
图5 菌株PCR电泳图(A)和16S rDNA系统进化树(B)Fig.5 PCR electrophoretogram (A) and phylogenetic tree of 16S rDNA (B) of the strain
2.5 菌株的药物敏感性
根据NCCLs药敏试验标准判断:在21种药物中,菌株对10种药物高度敏感,分别为头孢菌素、环丙沙星、头孢噻肟、头孢西丁、氯霉素、萘啶酸、头孢哌酮、四环素、头孢曲松、头孢唑啉;对阿米卡星、阿莫西林克拉维酸、庆大霉素、青霉素、复方磺胺、链霉素、复方新诺明中度敏感;对磺胺甲恶唑、头孢唑肟、头孢他啶、头孢吡肟耐受(表1).

表1 菌株141108的药敏试验结果1)Table 1 Drug sensitivity test of strain 141108
2.6 菌株的生物学特性
2.6.1 形态特征 菌株141108革兰氏染色呈阴性杆状,兼性好氧,具有鞭毛(图6).
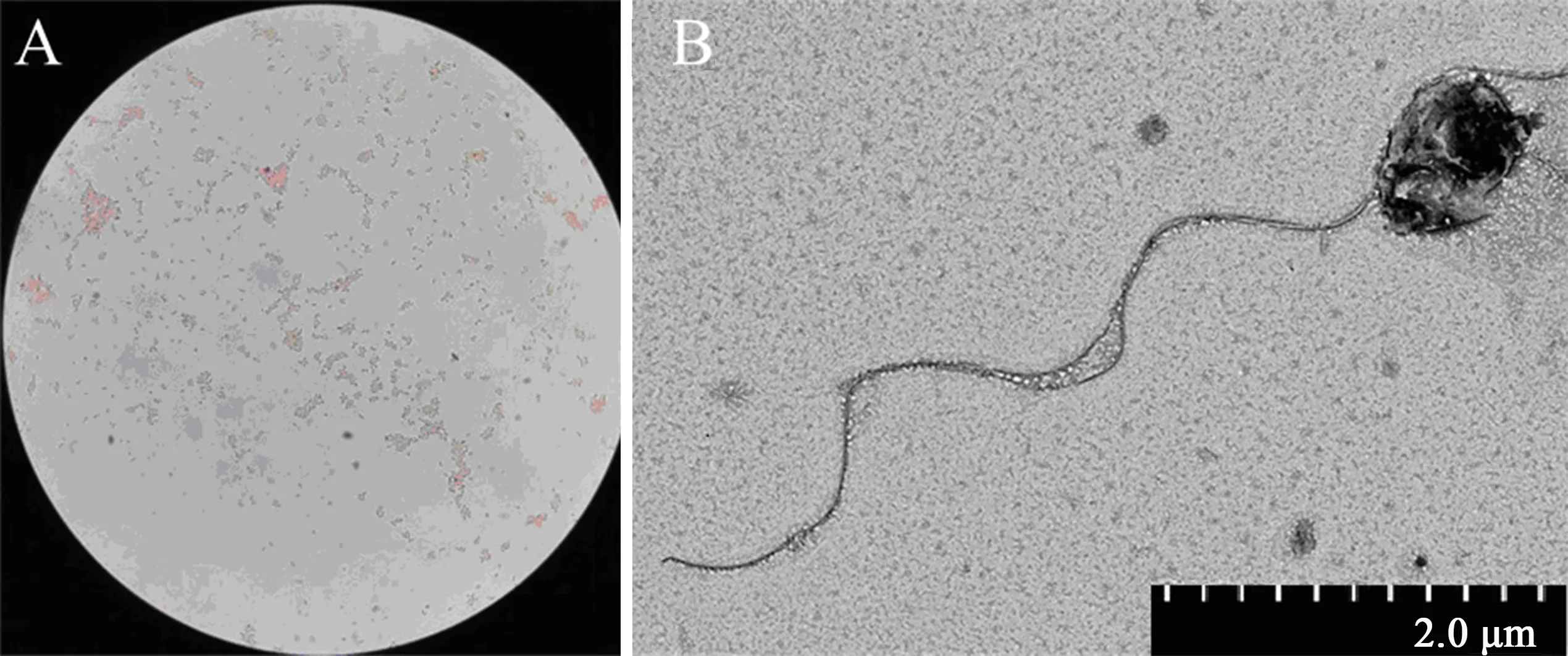
图6 菌株141108革兰氏染色(×1 000)(A)和鞭毛染色(B)Fig.6 Gram staining (×1 000) (A) and flagellum staining (B) of strain 141108
2.6.2 生理生化特性 菌株141108的主要理化特征见表2.根据《常见细菌系统鉴定手册》[17]和《伯杰细菌鉴定手册》[18]所列的细菌菌株形态和生理生化性状,初步判定菌株141108为胡萝卜软腐果胶杆菌.结合2.4的分子鉴定结果,将其确定为胡萝卜软腐果胶杆菌.
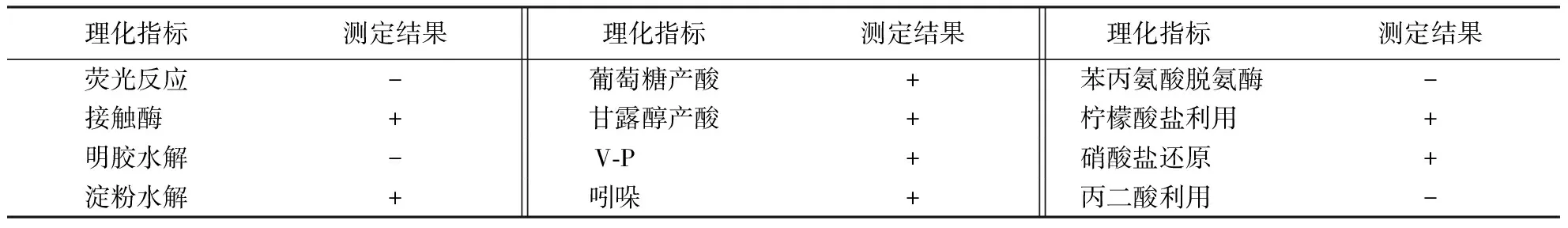
表2 菌株141108主要生理生化特性1)Table 2 Physiological and biochemical characteristics of strain 141108
2.6.3 pH和温度对菌株生长的影响 菌株141108在pH 5.0~10.0时均能生长,但在pH 5.0和pH 10.0时生长缓慢,最适pH为7.0;菌株在4~45 ℃均能生长,但在4和45 ℃时生长较慢,最适温度为28 ℃;菌株141108经65 ℃水浴处理后几乎不生长(图7).
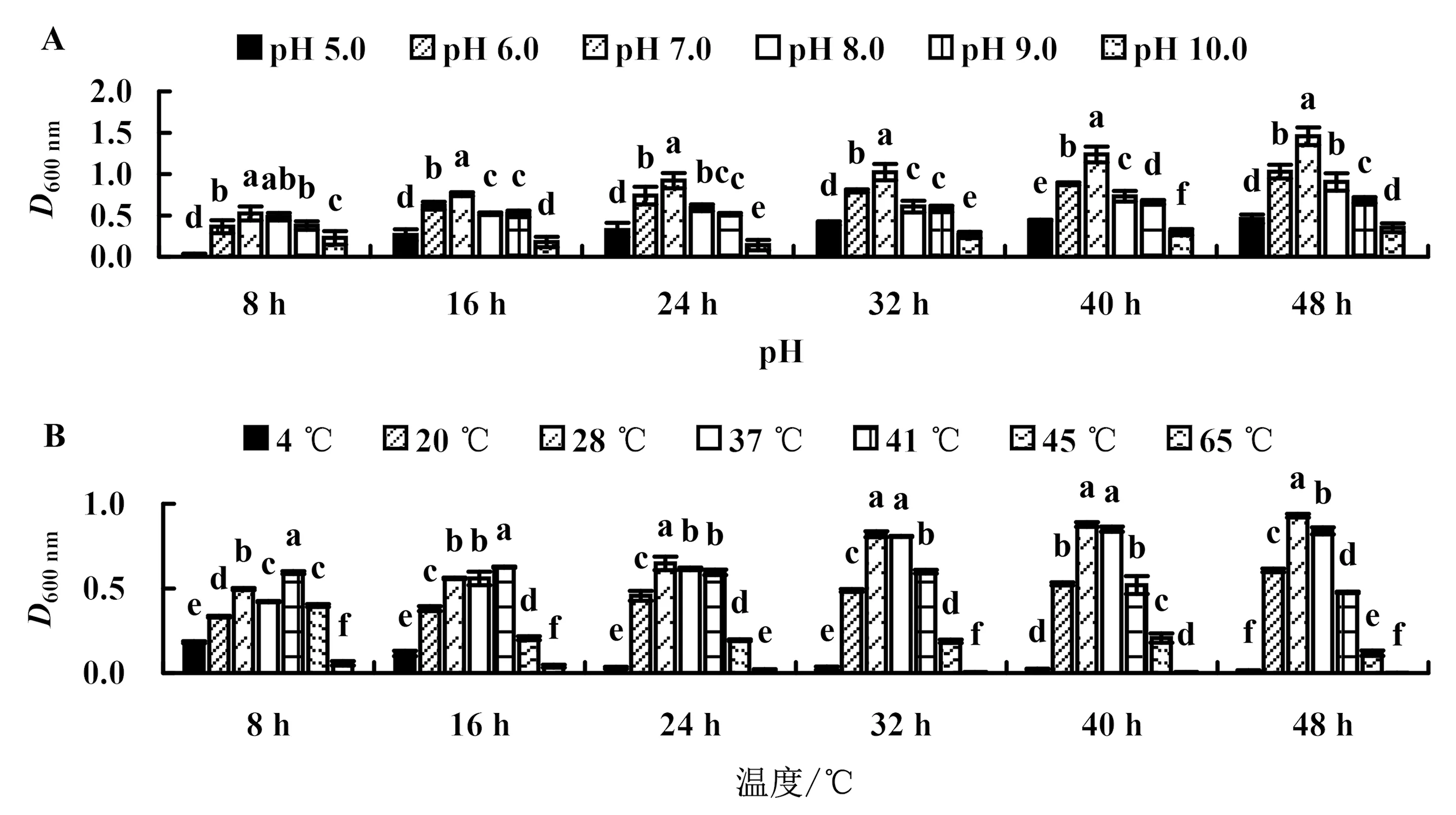
柱上不同小写字母表示同一时间不同处理间差异显著(P<0.05).图7 pH(A)和温度(B)对菌株141108生长的影响Fig.7 Effects of pH (A) and temperature (B) on the growth of strain 141108
3 讨论与结论
果胶杆菌属已成为我国植物病害的重要病原菌,引起的病症主要有枯萎病、萎蔫病、溃疡病、软腐病、树木癌肿病等,其中,胡萝卜软腐果胶杆菌能引起半夏[13]、魔芋[19]、马蹄莲[20]、人参[21]、火龙果[22]等植物软腐病的发生.有学者报道了福建长汀地区的槟榔芋细菌性软腐病病原菌为胡萝卜软腐欧文氏菌胡萝卜软腐致病型[6,23],但未对其做进一步鉴定.本研究从患病槟榔芋球茎分离到菌株141108,经形态观察、生理生化特性测定和分子测序,将其鉴定为果胶杆菌属胡萝卜软腐果胶杆菌.果胶杆菌属是较晚归入肠杆菌科细菌的成员,其属内记载的种此前均属于欧文菌属,根据《肠杆菌科病原细菌》[24]记载,胡萝卜软腐欧文氏菌(含5个亚种)已归入果胶杆菌属,胡萝卜软腐果胶杆菌即为原来的胡萝卜软腐欧文氏菌.
菌株141108对pH和温度适应范围广,只要在适宜的条件下就可迅速生长,具有一定的季节性和暴发性.本试验中的菌株为活菌制剂,田间接种易受环境温度、湿度、pH、土壤微生物等多种因素影响[25-26],这使该菌株在田间接种后的侵染能力与自然患病相比有所差异.有关该细菌病害的发病机理和田间防治措施仍需做进一步研究.
