硒化低分子果胶的制备与结构表征及抗氧化活性
2022-07-07吴慕慈何静仁
陶 雯,张 瑞,杨 宁,吴慕慈,何静仁,*
(1.武汉轻工大学硒科学与工程现代产业学院,湖北 武汉 430023;2.武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
果胶是一种具有重要价值的水溶性膳食纤维,广泛存在于高等植物的根、茎、叶和果实等组织器官的细胞壁中,与纤维一起具有结合植物组织的作用,相对分子质量介于5×10~3×10之间,主链由半乳糖醛酸经-1,4糖苷键连接而成,侧链由阿拉伯糖、鼠李糖和半乳糖等中性多糖组成。天然果胶作为联合国粮农组织/世界卫生组织推荐的不受添加量限制的安全食品添加剂,广泛用于食品工业,主要用作胶凝剂、增稠剂、乳化剂和稳定剂;还可以用于制药工业,对高血压、便秘等慢性疾病有一定疗效,并可降低血糖、血脂,减少胆固醇,解除铅中毒,同时还具有抗氧化、防癌、抗癌等作用。国内果胶资源丰富,但加工利用率低,大部分原料都被直接丢弃,苹果果胶是仅次于柑橘果胶的第二大商品果胶来源。作为一类多糖,果胶生理功效和生物活性与其分子质量、分支度、聚合度以及溶液中的高级构象等相关。天然果胶由于分子质量较大,食用后不能被肠道吸收,只有部分在大肠内发酵,因此对人体没有显著功效。低分子果胶由于分子质量、酯化度降低,更容易被小肠微绒毛吸收而进入血液循环,从而更好地发挥其药用价值。
硒是人体必需的14种微量元素之一,参与维持机体健康和生长发育,是谷胱甘肽过氧化物酶的活性中心,在人类防癌、延缓衰老、提高机体免疫力、预防治疗心血管疾病、克山病和大骨节病等方面发挥重要作用。世界卫生组织对健康成人的硒推荐摄入量为55 μg/d,由于人体自身不能合成硒,只能从膳食中获得硒,因此补硒势在必行。自然界中硒主要以无机硒和有机硒的形式存在,无机硒包括硒单质、亚硒酸盐、硒酸盐等,有机硒主要以硒蛋白、硒多糖、硒核酸等形式存在。由于无机硒的毒性较大,使用具有一定限制,而有机硒具有吸收率和生物活性高、毒性低、环境污染小等特点,因此新型有机硒补充剂的开发是目前研究的一个热点。
硒多糖作为一种有机硒化合物,兼具硒和多糖的双重生物功效。硒多糖的来源主要有2种,一种是从植物中提取天然硒多糖,另一种是利用多糖和硒人工合成硒多糖,但前者硒含量较低。因此,本研究以苹果果胶为原料,采用果胶酶水解、硝酸-亚硒酸钠法超声辅助制备硒化低分子果胶,对其进行结构表征,并考察其抗氧化能力、-葡萄糖苷酶抑制作用,以期为果胶的精深加工利用以及有机硒天然食品补充剂开发提供理论基础。
1 材料与方法
1.1 材料与试剂
果胶(来源:苹果;型号:APA185;酯化度60.9%;半乳糖醛酸含量>65%) 烟台帝斯曼安德利果胶股份有限公司。
亚硒酸钠(≥97%)、硝酸、盐酸(均为优级纯)、溴化钾(色谱纯) 国药集团化学试剂有限公司;氢氧化钠、硼氢化钾(均为优级纯) 天津科密欧化学试剂有限公司;硒标准品 国家有色金属及电子材料分析测试中心;果胶酶(EC3.2.1.15,来源于,5 000 U/mL) 德国Meker公司;-葡萄糖苷酶 上海阿拉丁生化科技股份有限公司;-(+)-半乳糖醛酸(≥98%) 上海源叶生物科技有限公司;单糖标准品 扬州博睿糖生物技术有限公司;醋酸铵、醋酸钠(均为优级纯) 美国Thermo Fisher公司;A052-1-1抑制与产生超氧阴离子自由基测定试剂盒、A018-1-1羟自由基清除能力试剂盒 南京建成生物工程研究所;其他试剂均为分析纯。
1.2 仪器与设备
SB-5200DTD超声清洗机 宁波新芝生物科技股份有限公司;Multiwave Pro微波消解仪 奥地利安东帕公司;AFS-8530原子荧光光度计 北京海光仪器有限公司;6700傅里叶变换红外光谱仪 美国尼高力仪器公司;ICS5000离子色谱仪、E220紫外-可见分光光度计美国Thermo Fisher公司;S01b10873热重分析仪梅特勒-托利多仪器公司;Zetasizer Nano ZS动态光散射仪英国马尔文公司;EnSpire多功能酶标仪 美国珀金埃尔默公司。
1.3 方法
1.3.1 硒化果胶的制备
准确称取1 g果胶于锥形瓶中,依次加入100 mL体积分数0.5%硝酸溶液、1 mL 1 g/mL亚硒酸钠溶液,于50 ℃(体系pH 3.19±0.01)充分搅拌至完全溶解,置于超声波清洗器(240 W、75 ℃)中反应6 h,冷却至室温。用0.1、1.0 mol/L NaCO溶液调节pH值至6,真空浓缩至原体积1/2,加入4 倍体积无水乙醇,醇沉过夜,于4 000 r/min离心25 min,弃上清液,沉淀沥干后加入70 mL去离子水溶解,使用截留相对分子质量500的透析袋透析48 h,通过抗坏血酸检测透析液直至无红色时结束,未透过液经浓缩、冷冻干燥得硒化果胶。
1.3.2 低分子果胶的制备
参考杜丽娟等的方法,略有修改。准确称取1 g果胶,加入8 μL果胶酶,用柠檬酸-磷酸氢二钠缓冲液(pH 4.0)定容至100 mL,搅拌分解(50 ℃、3 h),沸水浴中加热灭酶10 min,冷却后6 000 r/min离心10 min取上清液,上清液真空浓缩至原体积的1/4,用截留相对分子质量500的透析袋透析48 h除去小分子杂质和盐分,冷冻干燥得低分子果胶。
1.3.3 硒化低分子果胶的制备
参考上述硒化果胶制备方法稍作修改,超声波清洗器反应后,用0.1、1.0 mol/L NaCO溶液调节pH值至6,真空浓缩至原体积1/2,用截留相对分子质量500的透析袋透析48 h,通过抗坏血酸检测透析液直至无红色时结束,未透过液经浓缩、冷冻干燥得硒化低分子果胶。
1.3.4 低分子果胶、硒化果胶、硒化低分子果胶得率计算
分别按式(1)~(3)计算:

1.3.5 相对分子质量测定
采用体积排阻色谱-示差检测器-激光光散射联用技术测定样品相对分子质量与分布,按Zimm拟合计算果胶分子重均分子质量(m)。
测试条件:色谱柱:Aglient PL Aquagel-OH凝胶色谱柱(8.0 mm×300 mm);流动相:0.2 mol/L醋酸铵;流速0.7 mL/min;进样量20 μL;柱温30 ℃。
1.3.6 单糖组成测定
采用咔唑硫酸法测定半乳糖醛酸含量,离子色谱法测定中性糖组成及含量,取单糖标准品配制混合标准溶液。根据绝对定量方法测定不同单糖含量。准确称取10 mg样品置于安培瓶中,加入10 mL 3 mol/L三氟乙酸溶液,120 ℃水解3 h。准确吸取酸水解液转移至试管中氮吹至干,加入10 mL蒸馏水旋涡混合,吸取100 μL加入900 μL去离子水,12 000 r/min离心5 min,取上清液进行离子色谱分析。
测试条件:Dionex CarbopacPA20色谱柱(3 mm×150 mm);流动相:A:HO,B:15 mmol/L NaOH溶液,C:15 mmol/L NaOH和100 mmol/L NaOAC溶液;梯度洗脱:0~18 min,98.8% A、1.2% B;18.1~30 min,50% A、50% B;30.1~46 min,100% C;46.1~50 min,100% B;50.1~80 min,98.8% A、1.2% B;流速0.3 mL/min;进样量5 μL;柱温30 ℃;电化学检测器。
1.3.7 傅里叶变换红外光谱测定
取2 mg粉末试样、200 mg纯溴化钾研细均匀,置于模具中,在油压机上压成透明薄片,将样片放入红外光谱仪中测试,波数范围4 000~400 cm,扫描次数32,分辨率4 cm。
1.3.8 紫外光谱分析
配制1 mg/mL样品溶液,采用紫外-可见分光光度计进行扫描,扫描波长范围190~400 nm。
1.3.9 热重分析
参考商龙臣等的方法稍作修改,样品40 ℃干燥2 h,在氧化铝坩埚中加入样品5.00 mg,以空坩埚作为对照,程序升温速率10 ℃/min,扫描温度30~800 ℃,氮气流速20 mL/min。
1.3.10 粒径和电位测定
参考连科迅的方法稍作修改。用蒸馏水配置1 mg/mL样品溶液,采用激光粒度仪检测样品的粒径和电位。
1.3.11 蛋白质含量测定
采用碧云天Cat No.P0006 Braford蛋白浓度测定试剂盒测定。
1.3.12 硒含量测定
采用GB 5009.93—2017《食品中硒的测定》中氢化物原子荧光光谱法,稍作修改测定硒含量。
准确称取0.1 g样品,加入7 mL硝酸,振摇混合均匀后放入微波消解仪中消解,消解结束待冷却后,在电热板上180 ℃继续加热至消化液剩余体积约为1 mL,冷却后再加5 mL 50%盐酸溶液,继续180 ℃加热至0.5 mL,冷却,转移至100 mL容量瓶中,用10%盐酸溶液定容、混匀,待测。
以1 mol/L HCl溶液为载流,2%硼氢化钾和0.5 g/100 mL氧化钠混合溶液为还原剂,测定0、20、40、60、80、100 μg/L硒标准溶液的荧光强度,以硒标准溶液质量浓度为横坐标、荧光强度为纵坐标绘制标准曲线。样品中硒含量按式(4)计算:

式中:为试样中硒的含量/(μg/g);为试样溶液中硒的质量浓度/(μg/L);为空白溶液中硒的质量浓度/(μg/L);为试样消化液总体积/mL;为试样质量/g;1 000为换算系数。
1.3.13 羟自由基清除能力测定
采用羟自由基试剂盒进行测定,以VC作为阳性对照。
1.3.14 超氧阴离子自由基清除能力的测定
采用抑制与产生超氧阴离子自由基测定试剂盒进行测定,以VC作为阳性对照。
1.3.15-葡萄糖苷酶抑制作用的测定
参考Luyen等的方法稍作修改。配制不同质量浓度样品溶液(0.5、1、1.5、2、2.5、3 mg/mL)。取50 μL样品溶液,加入50 μL磷酸盐缓冲液(pH 6.8)、50 μL 0.5 U/mL-葡萄糖苷酶溶液,37 ℃温浴15 min后,加入100 μL 5 mmol/L对硝基苯---吡喃半乳糖苷溶液,37 ℃下温浴10 min,加入750 μL 0.20 mol/L NaCO溶液终止反应。以200 μL磷酸盐缓冲液(pH 6.8)为对照组,不加样品溶液、加入100 μL磷酸盐缓冲液(pH 6.8)为空白组,以阿卡波糖作为阳性对照。在405 nm波长处测定吸光度,按式(5)计算样品对-葡萄糖苷酶的抑制率:

式中:为样品组吸光度;为对照组吸光度;为空白组吸光度。
1.4 数据处理与分析
采用SPSS 22.0、Origin 9.0、Excel 2010软件进行数据分析与作图,利用最小显著差异法、Duncan多重比较进行差异显著性分析。
2 结果与分析
2.1 低分子果胶、硒化果胶、硒化低分子果胶得率
低分子果胶的制备方法有酸法水解、物理降解、酶水解等,但酸法水解在加热条件下降解速率极快,得到大量单糖,不易得到低分子果胶,并且在反应中引入了各种反应试剂,反应难以控制;物理降解不易引入副产物,但生产成本较高。因此,常使用反应条件相对较为温和、对果胶分子结构几乎没有破坏操作工艺简单的酶解法制备低分子果胶。果胶酶选择性作用,切断果胶分子中-1,4糖苷键,生成低分子果胶,也可能产生果胶低聚糖等,可通过透析等方式除去。低分子果胶、硒化果胶、硒化低分子果胶得率如表1所示。

表1 低分子果胶、硒化果胶、硒化低分子果胶得率Table 1 Yields of low-molecular-mass pectin, selenylated pectin, and selenylated low-molecular-mass pectin
2.2 相对分子质量分布
如表2所示,果胶的相对分子质量分布较均匀,主要集中在5.165×10,占56.1%,其次是6.491×10、1.881×10,分别占23.6%、17.4%。硒化果胶的相对分子质量较果胶略有提高,且分布比较集中,主要分布于1.148×10~7.574×10,分布比例达99%。酶解后,低分子果胶的相对分子质量明显降低,主要集中在5.161×10,占72.3%。硒化低分子果胶的相对分子质量主要分布在8.905×10,占61.3%。综上,说明果胶、低分子果胶经过硒化处理后相对分子质量均略有提高,这可能与果胶羟基被新的硒官能团取代有关。

表2 低分子果胶、硒化低分子果胶、果胶、硒化果胶的相对分子质量分布Table 2 Relative molecular mass distribution of low-molecular-mass pectin,selenylated low-molecular-mass pectin, pectin, and selenylated pectin
2.3 单糖组成
各单糖标准品在离子色谱中的保留时间如图1所示,2.0 min为溶剂氢氧化钠,40.0 min为溶剂乙酸钠。如表3所示,4种果胶多糖都主要由半乳糖醛酸组成,还含有少量鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖,但含量存在一定差异,可能是酶解过程中一些支链从糖链上断裂,也有可能是硒化修饰过程中较强的酸性环境破坏了多糖结构,部分支链被降解成单糖或寡糖,在后续透析过程中被除去。结果表明酶解与硒化处理对果胶的单糖组成不会造成较大影响,均主要以半乳糖醛酸为主链、中性糖为侧链的多糖组成。半乳糖醛酸标准曲线拟合方程为=0.005 2+0.002 9,=0.991 7,在20~100 μg/mL线性范围内拟合度良好。酶解后,低分子果胶中半乳糖醛酸含量显著低于果胶(<0.05),可能是因为酶解过程中产生果胶低聚糖,再经过透析除去。硒化处理后,硒化低分子果胶、硒化果胶半乳糖醛酸含量也较果胶显著降低(<0.05),可能是因为硒化反应时,果胶中加入溶剂搅拌预溶产生剪切力,同时使用超声辅助硒化产生空化效应,从而破坏了半乳糖醛酸羧基的C—O键。

图1 混合单糖标准品离子色谱图Fig. 1 Ion chromatogram of mixed monosaccharide standards
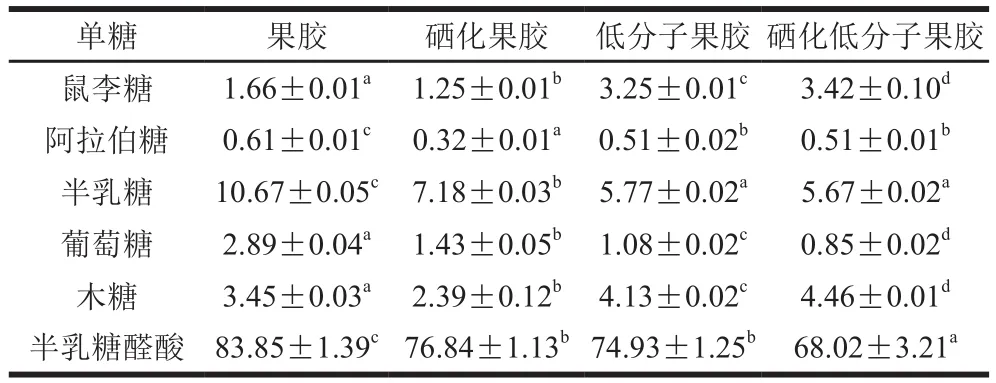
表3 低分子果胶、硒化低分子果胶、果胶、硒化果胶的单糖组成和含量(以干质量计)Table 3 Monosaccharide composition of low-molecular-mass pectin,selenylated low-molecular-mass pectin, pectin, and selenylated pectin(calculated on a dry mass basis)%
2.4 红外光谱分析
如图2所示,3 448 cm处出现的宽峰为O—H伸缩振动,峰形宽钝,表明不是游离—OH,而是其分子间发生缔合反应;2 926 cm为C—H伸缩振动吸收峰,1 448、1 336 cm为C—H弯曲振动吸收峰,这些均为多糖的典型结构;1 631 cm是自由羧基中C=O的伸缩振动峰,1 746 cm为酯化羧基中C=O的伸缩振动峰;1 245、1 104 cm为C—O伸缩振动峰,同时1 245、1 746 cm处的峰表明4种果胶均为酸性多糖。果胶经过酶解后,结构没有发生明显改变,均具有果胶多糖的典型结构。但果胶、低分子果胶经过硒化后,分别在697.49、794.09 cm和768、894.38 cm处出现新的吸收峰,根据研究推测可能是C—O—Se对称伸缩振动和Se=O伸缩振动,果胶、低分子果胶作为一种多羟基化合物,经硒化处理后硒与多糖基团以共价键相连,主要以亚硒酸酯形式存在。但相较硒化果胶,硒化低分子果胶的硒特征吸收峰出现了一定蓝移,可能是因为硒与多糖的结合位点发生变化。
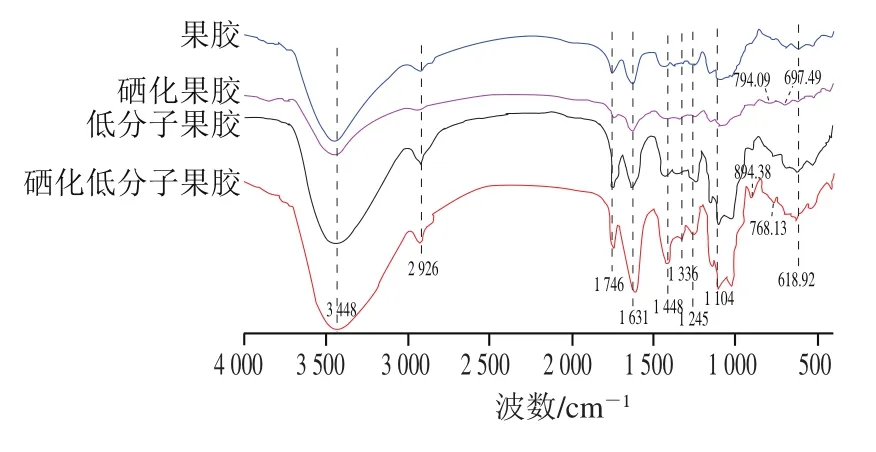
图2 低分子果胶、硒化低分子果胶、果胶、硒化果胶的红外光谱图Fig. 2 Infrared spectra of low-molecular-mass pectin, selenylated lowmolecular-mass pectin, pectin, and selenylated pectin
2.5 热重分析
热稳定性是评价物质是否具有生物应用的一个重要特性,常使用热重分析。样品质量由于脱水、分解、氧化等随着时间、温度的变化而变化。如图3所示,在30~800 ℃下,果胶、硒化果胶、低分子果胶、硒化低分子果胶的热重曲线趋势相似。在30~100 ℃下,果胶、硒化果胶、低分子果胶、硒化低分子果胶发生脱水,质量略有降低,可能是果胶损失了从环境中吸收的水分或结合水导致,质量损失分别为9.36%、10.08%、14.02%、15.86%。在200~400 ℃下果胶开始分解,质量损失最大;果胶、硒化果胶、低分子果胶、硒化低分子果胶,在200~250 ℃区间的质量损失分别为28.50%、23.98%、20.84%、18.44%,说明经酶解、硒化后果胶在此温度范围内热稳定性增强;在250~400 ℃区间的质量损失分别为24.99%、25.23%、27.85%、25.60%,果胶经过酶解、硒化后热稳定性略有降低。600~800 ℃后样品质量基本恒定,此期间的质量损失主要为加热分解导致,800 ℃时果胶、硒化果胶、低分子果胶、硒化低分子果胶的剩余质量分别为22.05%、14.57%、14.57%、15.68%。综合来说,酶解和硒化处理后,果胶热稳定性降低,可能是因为酶解后糖苷键发生断裂,生成了聚合度较低的低分子果胶;硒化反应时,果胶基团和亚硒酸根结合生成亚硒酸酯,使得产物在较高温条件下更容易脱水裂解,导致热稳定性降低。

图3 低分子果胶、硒化低分子果胶、果胶、硒化果胶的热重分析曲线Fig. 3 TGA curves of low-molecular-mass pectin, selenylated low-molecular-mass pectin, pectin, and selenylated pectin
2.6 紫外光谱分析
如图4所示,低分子果胶、硒化低分子果胶、果胶、硒化果胶均在200 nm波长附近有吸收峰,该吸收峰为多糖的特征吸收峰,在250~300 nm处有一小的吸收峰,可能含有少量蛋白质,经测定蛋白质含量均小于5%。

图4 低分子果胶、硒化低分子果胶、果胶、硒化果胶的紫外全波长扫描图Fig. 4 UV spectra of low-molecular-mass pectin, selenylated low-molecular-mass pectin, pectin, and selenylated pectin
2.7 粒径和电位分析
研究表明,粒径越小越易被机体吸收利用并发挥药理活性,Zeta电位通过粒子间静电排斥作用影响粒子在分散液中的稳定性,进而影响其生物活性。如表4所示,在质量浓度1 mg/mL下,低分子果胶、果胶经硒化处理后,聚合物分散性指数均显著降低(<0.05),分子质量分布变均匀,Zeta电位绝对值均显著增加(<0.05),粒径均降低,其中硒化低分子果胶的聚合物分散性指数最低、Zeta电位绝对值最大,粒径最小,说明果胶经过酶解、硒化处理后,分子质量分布均匀,粒子在溶液中呈分散状态不易凝结和聚集,分散度变高,体系稳定性增强。
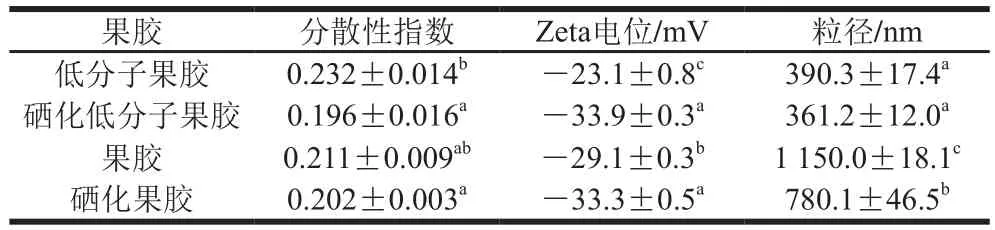
表4 低分子果胶、硒化低分子果胶、果胶、硒化果胶的粒径、电位和聚合物分散性指数Table 4 Particle size, potential and polydispersity index of lowmolecular-mass pectin, selenylated low-molecular-mass pectin, pectin,and selenylated pectin
2.8 硒含量
硒含量标准曲线拟合方程为=50.732-13.95,=0.999 7,在0~50 μg/L范围内线性关系良好。低分子果胶、果胶中几乎没有硒,可忽略不计。如表5所示,硒化果胶中硒含量明显高于硒化低分子果胶,可能与半乳糖醛酸、总糖含量有关。研究表明,硒多糖中的硒一般是通过氢键、盐键、范德华力等弱相互作用或者共价键与多糖的醛基或羟基相连。

表5 硒化低分子果胶、硒化果胶的硒含量Table 5 Selenium contents of selenylated low-molecular-mass pectin and selenylated pectin
2.9 体外抗氧化活性与α-葡萄糖苷酶抑制作用
硒化可以通过活化多糖异构碳上的氢原子提高多糖的抗氧化活性。如图5、表6所示,在0~1.5 mg/mL质量浓度范围内,样品的羟自由基清除能力随质量浓度的增加逐渐增强;当质量浓度超过1.5 mg/mL后,硒化低分子果胶、硒化果胶的羟自由基清除能力逐渐降低,低分子果胶、果胶的羟自由基清除能力趋于平缓。根据半最大效应浓度(concentration for 50% of maximal effect,EC),羟自由基清除能力依次为:VC>硒化低分子果胶>低分子果胶>果胶>硒化果胶。在0~1 mg/mL质量浓度范围内,样品超氧阴离子自由基清除能力随着质量浓度的增加呈线性增强,当质量浓度大于1 mg/mL时趋近平缓,且酶解、硒化处理增强了果胶清除超氧阴离子自由基的能力。根据EC可知,超氧阴离子自由基清除能力依次为:VC>硒化低分子果胶>硒化果胶>低分子果胶>果胶。
氧化应激和糖尿病代谢综合征密切相关,抑制-葡萄糖苷酶活力对缓解餐后血糖升高和减少糖尿病并发症具有重要意义。低分子果胶、硒化低分子果胶、果胶、硒化果胶、阿卡波糖均能抑制-葡萄糖苷酶活力,且呈量效关系,根据EC可知,-葡萄糖苷酶活力抑制作用依次为硒化低分子果胶>阿卡波糖>果胶>低分子果胶>硒化果胶,硒化低分子果胶抑制-葡萄糖苷酶能力强于阿卡波糖(<0.05)。与本研究结果相似,硒化南瓜多糖、硒化新疆乌拉尔甘草多糖、硒化榆树根多糖的体外抗氧化活性均明显强于未硒化多糖。以上结果表明,硒化低分子果胶不仅能作为一种有机硒补充剂,还具有一定的体外抗氧化活性,以及辅助降血糖、降血脂的潜力。

图5 低分子果胶、硒化低分子果胶、果胶、硒化果胶的体外抗氧化活性与α-葡萄糖苷酶抑制作用Fig. 5 In vitro antioxidant activity and α-glucosidase inhibitory effect of low-molecular-mass pectin, selenylated low-molecular-mass pectin,pectin and selenylated pectin

表6 低分子果胶、硒化低分子果胶、果胶、硒化果胶体外抗氧化活性与α-葡萄糖苷酶抑制作用的EC50Table 6 EC50 for in vitro antioxidant activity and α-glucosidase inhibitory effect of low-molecular-mass pectin, selenized low-molecularmass pectin, pectin and selenized pectin
3 结 论
多糖的活性与分子质量、溶解度、黏度、初级结构、高级结构等相关。相对分子质量越大,分子体积越大,越不利于多糖跨膜进入生物体内发挥生物学活性,相对分子质量小的多糖更容易结合活性位点,但是相对分子质量过低,又无法形成活性聚合结构。果胶作为一种高分子多糖常因其食品纤维功能被用作功能性食品材料,但其较大相对分子质量和黏度导致的操作不便性限制了其应用。近年来大量研究表明,硒多糖较普通多糖具有更强的抗氧化、降血糖活性等,因此受到广泛关注。本研究以苹果果胶为原料,分别制备低分子果胶、硒化低分子果胶、硒化果胶,结果表明,硒化低分子果胶的得率为(78.07±1.66)%,硒含量为(148.29±1.97)μg/g,半乳糖醛酸含量为(68.02±3.21)%,相对分子质量多为8.905×10,占61.3%。4种多糖均由鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、半乳糖醛酸组成,但含量存在一定差异,在200 nm波长附近均具有多糖的特征吸收峰,硒化低分子果胶粒径为(361.2±12.0)nm,具有较好的分散性,但热稳定性降低。傅里叶变换红外光谱中,果胶酶解前后结构无明显差异,但硒化后出现Se=O、C—O—Se新吸收峰。此外,果胶、硒化果胶、低分子果胶、硒化低分子果胶均具有较好的羟自由基、超氧阴离子自由基清除能力以及-葡萄糖苷酶活力抑制能力,且硒化低分子果胶的效果最强。硒化低分子果胶克服了果胶黏度大、分子质量大的缺点,具有硒和低分子果胶的双重功效,更容易被肠道吸收利用,且具有一定体外抗氧化活性,这可能与酶解后更多活性基团的暴露,或分子质量降低有利于其空间结构舒展并与自由基的结合有关;但体外抗氧化实验易存在假阳性结论,因此还需动物和细胞实验等进一步探究硒化低分子果胶生物活性的具体机制。
