甘肃省部分地区马铃薯晚疫病菌交配型及线粒体DNA单倍型分析
2022-04-04惠娜娜王立李继平郑果李培玲马生彪吕昭龙
惠娜娜 王立 李继平 郑果 李培玲 马生彪 吕昭龙

摘要 由致病疫霉Phytophthora infestans (Mont.) de Bary侵染引起的马铃薯晚疫病是一种世界范围内的毁灭性病害。为了明确甘肃省马铃薯晚疫病菌的遗传结构,对2018年甘肃省定西市、张掖市和陇南市采集的130株晚疫病菌进行了交配型和线粒体DNA (mtDNA)单倍型测定。结果表明:从130株晚疫病菌中检测到A1和A2两种交配型,A1交配型为14株(10.77%),A2交配型为116株(89.23%);检测到Ⅰa、Ⅱa和Ⅱb 3种线粒体 DNA单倍型,发生频率分别为88.46%、3.85%和7.69%。Ⅰa单倍型菌株的交配型为A1和A2,Ⅱa单倍型菌株交配型为A1和A2,Ⅱb单倍型菌株交配型为A1。该结果表明甘肃省部分地区马铃薯晚疫病菌以A2交配型,Ⅰa mtDNA单倍型为主。甘肃省各采集地晚疫病菌群体结构或与当地种薯繁育、调运有关。
关键词 马铃薯; 晚疫病菌; 交配型; 线粒体DNA单倍型
中图分类号: S435.32
文献标识码: A
DOI: 10.16688/j.zwbh.2021037
Abstract Potato late blight caused by Phytophthora infestans (Mont.) de Bary is a destructive disease in the world. In order to clarify the genetic structure of P.infestans in Gansu province, the mating type and mtDNA haplotype of 130 P.infestans strains collected in Dingxi city, Zhangye city and Longnan city in 2018 were determined. The results showed that A1 and A2 mating types were detected from 130 strains, among which 14 strains (10.77%) were the A1 mating type and 116 strains (89.23%) were A2. Three mtDNA haplotypes of Ⅰa, Ⅱa and Ⅱb were detected from 130 strains, and the occurrence frequencies were 88.46%, 3.85% and 7.69%, respectively. The mating types of Ⅰa haplotype strains were A1 and A2, Ⅱa haplotype strains were A1 and A2, and Ⅱb haplotype strains were A1. The results showed that the main pathogens of P.infestans in Gansu province were A2 mating type and Ⅰa mtDNA haplotype. The population structure of P.infestans in different collection sites in Gansu province may be related to the breeding and transportation of local seed potatoes.
Key words potato; Phytophthora infestans; mating type; mtDNA haplotype
由致病疫霉Phytophthora infestans (Mont.) de Bary侵染引起的馬铃薯晚疫病在甘肃省的发生日趋严重,是当前制约马铃薯产业健康可持续发展的最为严重的病害之一,其危害性高、防治难度大,对社会造成严重影响,现已被视为全球第一大作物病害[12]。马铃薯晚疫病菌是有A1和A2两种交配型的异宗配合卵菌,不同交配型菌株可进行有性生殖产生卵孢子。自1956年墨西哥首次发现A2交配型,世界各地陆续发现了A2交配型。张志铭等[3]1996年首次报道在我国山西和内蒙古检测到A2交配型,随后在河北、四川、云南等地相继检测到了A2交配型[45]。A2交配型菌株的存在大大增强了晚疫病菌的适应性和变异性[3]。
马铃薯晚疫病菌群体结构的组成与变化对马铃薯晚疫病的发生、流行具有重要作用[6]。致病疫霉mtDNA为伴母性遗传,序列简单、相对保守,是研究致病疫霉起源进化以及系统发育的理想对象[7]。国外研究表明晚疫病菌群体mtDNA单倍型可划分为4种,即Ⅰa,Ⅱa,Ⅰb和Ⅱb[8]。Fry等[910]及Goodwin等[1112]研究认为Ⅰb代表致病疫霉在第二次全球迁移前与US-1无性繁殖谱系密切相关的“旧”群体,而Ⅰa、Ⅱa和Ⅱb为致病疫霉第二次全球迁移发生后在墨西哥以外出现的“新”群体。研究晚疫病菌mtDNA单倍型可以揭示晚疫病菌遗传结构的演变,监控晚疫病菌群体的变异情况。
马铃薯是我国西北地区农民赖以生存的重要粮食作物和经济作物。甘肃省是我国重要的马铃薯种薯和商品薯繁殖基地及淀粉加工基地[13],2020年甘肃省马铃薯种植面积已超68.4万hm2[14]。近年来由于种植结构调整、气候变化等因素的影响,马铃薯晚疫病频繁流行,给马铃薯产业造成极大的损失,威胁甘肃省马铃薯产业的绿色健康可持续发展。本文对甘肃省马铃薯晚疫病菌的交配型和mtDNA单倍型开展相关研究,明确晚疫病菌交配型、mtDNA单倍型的组成与分布,初步探明了马铃薯晚疫病菌群体结构的变化,为进一步系统研究甘肃省晚疫病菌的群体结构提供了技术支撑,同时为甘肃省马铃薯晚疫病病害综合防控策略的制定提供参考。
1 材料与方法
1.1 试验材料
供试菌株:2018年采集自甘肃省定西市、张掖市和陇南市等地县的马铃薯种植生产田新发病田块,采集具有典型晚疫病症状的新鲜叶片,装入纸袋置于冰盒中,带回实验室,通过单孢分离[15]培养获得的130株晚疫病菌。
供试培养基为黑麦番茄培养基[15](60 g黑麦加500 mL蒸馏水煮沸1 h,过滤,滤液加100 mL 番茄汁,0.4 g CaCO3,20 g蔗糖,11 g 琼脂粉,蒸馏水定容至1 000 mL,分装,121℃灭菌)。
1.2 马铃薯晚疫病菌交配型测定
采用皿内对峙培养的方法。将待测菌株分别与标准菌株对峙接种在直径9 cm的黑麦番茄汁培养基平板上,菌饼之间距离1.5 cm,在18℃黑暗条件下培养14 d左右,用显微镜检查卵孢子的产生。同时将待测菌株单独接于培养基上,同等条件下培养,显微镜检查。待测菌株与A1标准菌株产生卵孢子的为A2交配型;与A2标准菌株产生卵孢子的为A1交配型;与A1、A2标准菌株均能产生卵孢子的为A1A2交配型;不需交配即能产生卵孢子的为自育型菌株。标准菌株A1(NL80029)和A2(NL88133)由西北农林科技大学单卫星教授提供。
1.3 马铃薯晚疫病菌线粒体 DNA单倍型测定
1.3.1 基因组DNA的提取
采用OMEGA试剂盒提取基因组DNA。取纯化培养7 d的致病疫霉菌株平板,刮下菌丝置于干净的离心管-20℃冷冻保存。将保存的冷冻菌丝倒入加有液氮的研钵充分研磨成粉末,利用试剂盒提取DNA,所得DNA经1%琼脂糖凝胶电泳检测。利用Q5000超微量核酸蛋白测定仪,检测DNA的纯度和浓度。
1.3.2 引物序列
利用Griffith等[8]的PCR-RFLP方法分析线粒体DNA单倍型。引物序列F2:5′-TCCCTTTGTCCTCTACCHAT-3′;R2:5′-TACGGCGGTTTAGCACATACA-3′;F4:5′-GGTCATCCAGAGGTTTATGTT-3′;R4:5′-CGATACCGATACCAGCACCAA-3′。引物由西安擎科生物工程有限公司合成。
1.3.3 PCR扩增体系和程序
PCR扩增体系(25 μL):2×TsingKe Master Mix 12.5 μL,100 μmol/L F2/R2或F4/R4引物各1 μL, 50 ng/μL 的基因組DNA 1 μL,用超纯水定容至25 μL。PCR扩增程序为:94℃预变性90 s;94℃变性40 s,55℃退火60 s,72℃延伸90 s,40个循环;72℃下延伸120 s。PCR产物于1.2%的琼脂糖凝胶中电泳检测,凝胶成像仪中拍照。本试验所用2×TsingKe Master Mix购于西安擎科生物工程有限公司。
1.3.4 酶切分析
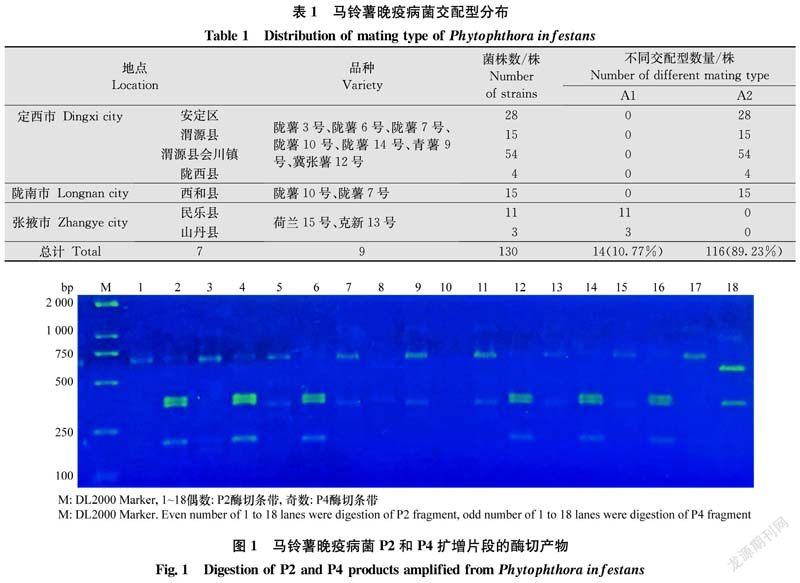
利用Msp Ⅰ 和EcoR Ⅰ 分别对F2/R2和F4/R4两对引物PCR产物(P2、P4)进行酶切4 h以上(37℃)。酶切体系为50 μL:PCR产物10 μL,Buffer 5 μL,限制性内切酶 1 μL,超纯水补足至50 μL。酶切产物于2%的琼脂糖凝胶电泳中检测,凝胶成像仪中拍照。根据酶切条带大小判断属于何种基因型。本试验所用限制性内切酶Msp Ⅰ和EcoR Ⅰ均购自生工生物工程(上海)股份有限公司。
1.4 数据分析
采用Microsoft Excel 2010进行数据统计分析。
2 结果与分析
2.1 马铃薯晚疫病菌交配型组成分析
交配型测定结果表明(表1),130株晚疫病菌中有10.77%为A1交配型菌株(14株),89.23%为A2交配型菌株(116株)。其中A1交配型均来自张掖市,A2交配型来自定西市和陇南市,各采集地菌株交配型结构相对单一。
寄主品种分析结果显示:A1交配型菌株寄主为‘荷兰15号’和‘克新13号’。A2交配型菌株寄主为‘陇薯6号’‘冀张薯12号’‘陇薯10号’‘陇薯7号’‘陇薯3号’‘青薯9号’和‘陇薯14号’。
2.2 马铃薯晚疫病菌线粒体DNA单倍型组成分析
线粒体单倍型测定结果表明(图1、表2):130株晚疫病菌中检测到Ⅰa、Ⅱa和Ⅱb 3种mtDNA单倍型,Ⅰa单倍型为115株,Ⅱa单倍型为5株,Ⅱb单倍型为10株,频率分别为88.46%、3.85%和7.69%。
从菌株来源分析,定西市采集分离的101株菌株包括Ⅰa和Ⅱa两种单倍型,分别为98株(97.03%)和3株(2.97%,安定区),陇南市采集分离的15株菌株均为Ⅰa单倍型,张掖市采集分离的14株菌株共鉴定出Ⅰa、Ⅱa和Ⅱb 3种单倍型,分别为2株(14.28%)、2株(14.28%)和10株(71.44%),上述结果表明甘肃省的晚疫病菌mtDNA结构较为复杂,不同地区晚疫病菌mtDNA单倍型组成差异较大。
2.3 马铃薯晚疫病菌交配型与线粒体 DNA单倍型相关性分析
晚疫病菌交配型和mtDNA单倍型测定结果表明:115株为Ⅰa单倍型,其所对应的交配型有2株为A1交配型(1.74%),分布于张掖市民乐县,113株为A2交配型(98.26%),分布于定西市、陇南市;5株菌株为Ⅱa单倍型,其所对应的交配型有2株为A1交配型(40.00%),分布于张掖市山丹县,3株为A2交配型(60.00%),分布于定西市安定区;10株菌株为Ⅱb单倍型,其所对应的交配型均为A1交配型,分布于张掖市民乐县。
3 结论与讨论
Niederhauser等[16]1956年在墨西哥中部首次发现了A2交配型,Hohl 1984年报道在瑞士发现A2交配型菌株,随后在美洲、欧洲、非洲和亚洲马铃薯主产区陆续报道了A2交配型菌株[6]。Vargas 等[17] 2009 年报道了哥伦比亚首次发现 A2交配型菌株,并测定出 A2 交配型菌株属于Ⅰa 型线粒体 DNA 单倍型,而 A1 交配型菌株为Ⅱa 型。Casa-coila等[18]研究表明巴西南部马铃薯晚疫病菌存在A1、A2、A1A2和自育型交配型菌株,A2为59.73%。国内学者研究表明中国北方地区(河北省、山东省、黑龙江省、内蒙古)主要以A1交配型、无性繁殖为主[1924],南方地区(湖北省、贵州省、云南省)以A2交配型为主[24]。部分学者在2003年-2015年对甘肃省马铃薯晚疫病菌交配型进行了相关研究[2233],检测到了A1、A2、A1A2和自育型,不同年份不同采集地交配型组成存在明显差异。本研究对2018年采集自甘肃省定西市、张掖市和陇南市的130株晚疫病菌交配型分析表明,甘肃省马铃薯晚疫病菌以A2交配型为主,各地区交配型组成相对单一,该结果说明甘肃省马铃薯主产区晚疫病菌主要以无性繁殖为主,这一结果与国内学者对甘肃地区马铃薯晚疫病菌交配型研究结果基本一致[2932]。李继平[31]2013年报道了2007年-2012年甘肃省晚疫病菌交配型存在A1、A2、A1A2和自育型,2008年发现A2交配型,之后A2交配型菌株比例上升,自育型菌株在2007年和2008年检测到,A1A2菌株在2011年和2012年发现,本研究未检测到A1A2和自育型菌株,这或与采样点有关。不同年度间甘肃省马铃薯晚疫病菌交配型组成不同,以定西地区为例,2007年-2012年以A1交配型为主(73.08%),2018年均为A2交配型,A2交配型菌株的增多可能意味着马铃薯晚疫病菌容易发生基因重组,可能形成致病力更强的菌系,从而增加抗性菌株、新生理小种出现的频率,马铃薯品种抗性丧失等等问题,造成马铃薯晚疫病的发生日趋严重。因此,应对甘肃省马铃薯晚疫病菌持续开展交配型、抗药性、生理小种等监测工作。
由于致病疫霉线粒体DNA结构相对简单且稳定性良好,因此被广泛用于致病疫霉起源和演化的研究。Day等[34]研究表明1995年-1998年苏格兰、英格兰、威尔士等地马铃薯晚疫病菌为Ⅰa和Ⅱa单倍型。Winton等[35]表明美国阿拉斯加晚疫病菌为Ⅱa单倍型。赵志坚等[36]发现2001年云南马铃薯晚疫病菌为Ⅰa单倍型。郭军等[37]研究表明内蒙古马铃薯晚疫病菌交配型为A1,群体mtDNA单倍型均为Ⅱa型。马云芳[38]研究表明2009年采集自甘肃的菌株中发现Ⅰa、Ⅱa单倍型,宁夏的菌株中发现Ⅰa、Ⅱa和Ⅱb,陕西的菌株中发现Ⅱa;2010年甘肃菌株为Ⅰa单倍型,宁夏的菌株中发现Ⅰa、Ⅱa和Ⅱb單倍型,陕西的菌株中发现Ⅱa。杨策[39]研究发现2010年-2012年贵州菌株发现Ⅰa和Ⅱb单倍型,云南菌株发现Ⅱa,福建、武汉菌株发现Ⅰa、Ⅱa和Ⅱb单倍型,宁夏菌株中发现Ⅰa和Ⅱa,甘肃菌株为Ⅰa型。Tian等[40]2016年报道了甘肃省马铃薯晚疫病菌的mtDNA单倍型为Ⅰa和Ⅱa单倍型,其中Ⅰa为优势基因型。李璐[23]研究表明黑龙江菌株为Ⅰa和Ⅱa单倍型,内蒙古菌株为Ⅱa单倍型。惠娜娜[41]对2007年-2012年采集自甘肃的45株晚疫病菌进行mtDNA单倍型检测,发现Ⅰa和Ⅱa 单倍型,其中Ⅰa比例高。本研究表明甘肃省马铃薯晚疫病菌检测到了Ⅰa、Ⅱa和Ⅱb 3种mtDNA单倍型,其中Ⅰa为优势基因型,在张掖市民乐县发现了Ⅱb单倍型。这一结果与国内学者对西北地区致病疫霉群体单倍型结构研究结果略有不同。据Fry等及Goodwin等的假说,致病疫霉“新”群体已成为甘肃省马铃薯产区的主导者,“新”群体对晚疫病的防治带来新的挑战。
甘肃省马铃薯晚疫病菌群体遗传结果或与种薯调运有关。定西市和陇南市等地以定西地区(渭源、安定)繁育种薯为主,各地晚疫病菌交配型和mt DNA单倍型相对一致,该地晚疫病菌以A2交配型,Ⅰa单倍型菌株为主,这与之前甘肃定西地区菌株交配型的结果略有不同,但mtDNA单倍型组成与之前结果基本一致;河西地区(张掖市)以自繁、内蒙古等地调种为主,该地晚疫病菌以A1交配型,Ⅰa、Ⅱ a和Ⅱb单倍型菌株组成,山丹县采集的菌株与郭军等[20,37]、李璐[23]对内蒙古马铃薯晚疫病菌(以A1交配型,Ⅱ a单倍型为主)的研究结果一致,mt DNAⅡb单倍型菌株采自于当地自繁种薯品种。本研究结果表明甘肃省部分马铃薯产区马铃薯晚疫病主要以种薯带菌和种薯调运为主要初侵染源和传播途径。因此,甘肃省对马铃薯晚疫病的防控应以种薯处理为主,通过对种薯进行药剂处理来消除或减少病原,以达到控制晚疫病的发生和流行,同时今后需要扩大晚疫病菌采集点,加强对不同生态区晚疫病菌群体遗传结构的监测,为下一步晚疫病的防控提供理论支撑。
参考文献
[1] JAMES W C. Estimated losses of crops from plant pathogens [M]∥ PIMENTEL D. CRC handbook of pest management in agriculture (USA), 1981.
[2] ERWIN D C, ROBERIO K. Phytophthora diseases worldwide [M]. Saint Paul, MN, USA: APS Press, 1996: 562.
[3] 张志铭, 李玉琴, 田世民, 等. 中国发生马铃薯晚疫病菌(Phytophthora infestans) A2交配型[J]. 河北农业大学学报, 1996, 19(4): 6265.
[4] 朱杰华, 张志铭, 李玉琴. 马铃薯晚疫病菌(Phytophthora infestans)A2交配型的分布[J]. 植物病理学报, 2000, 30(4): 375.
[5] 闵凡祥, 王晓丹, 胡林双, 等. 黑龙江省马铃薯晚疫病菌交配型的研究[J]. 中国马铃薯, 2010, 24(1): 4749.
[6] 朱杰华. 中国马铃薯晚疫病菌群体遗传结构研究[D]. 保定: 河北农业大学, 2004.
[7] 赵志坚, 曹继芬, 李灿辉, 等. 云南致病疫霉交配型、甲霜灵敏感性、mtDNA单倍型及其群体演替研究[J]. 中国农业科学, 2007, 40(4): 727734.
[8] GRIFFITH G W, SHAW D S. Polymorphisms in Phytophthora infestans: Four mitochondrial haplotypes are detected after PCR amplification of DNA from pure cultures or from host lesions [J]. Applied and Environmental Microbiology, 1998, 64(10): 40074014.
[9] FRY W E, GOODWIN S B. Resurgence of the Irish potato famine fungus [J]. Bioscience, 1997, 47(6): 363371.
[10]FRY W E, GOODWIN S B, DYER A T, et al. Historical and recent migrations of Phytophthora infestans: chronology, pathways, and implications [J]. Glia, 1993, 45(2):155169.
[11]GOODWIN S B. The population genetics of Phytophthora [J]. Phytopathology, 1997, 87(4): 462473.
[12]GOODWIN S B, COHEN B A, FRY W E. Panglobal distribution of a single clonal lineage of the Irish potato famine fungus [J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(24): 1159111595.
[13]何三信, 文国宏, 王一航, 等. 甘肃省马铃薯产业现状及提升措施建议[J]. 中国马铃薯, 2010, 24(1): 54 57.
[14]赵记军, 吴正强, 董博.甘肃马铃薯产业现状与发展对策[J].甘肃农业科技, 2021, 52(4):7782.
[15]GUO Liyun, YANG Yanli, LUO Wenfu. Mating type and biological characteristics of Phytophthora infestans isolates from Yunnan, China [J]. 植物病理学报, 2002, 32 (1): 4954.
[16]NIEDERHAUSER J S. Division of mycology: the blight, the blighter, and the blighted [J]. Transactions of the New York Academy of Sciences, 1956, 19(1):5563.
[17]VARGAS A M, OCAMPO L M Q, CSPEDES M C, et al. Characterization of Phytophthora infestans populations in Colombia: first report of the A2 mating type [J]. Phytopathology, 2009, 99 (1):8288.
[18]CASA-COILA V H, GOMES C B, LIMA-MEDINA I, et al. Characterization of mating type and the diversity of pathotypes of Phytophthora infestans isolates from Southern Brazil [J]. Journal of Plant Diseases and Protection, 2020, 127(1): 4354.
[19]LI Benjin, CHEN Qinghe, LV Xinin, et al. Phenotypic and genotypic characterization of Phytophthora infestans isolates from China [J]. Journal of Phytopathology, 2009, 157(9):558567.
[20]郭军, 屈冬玉, 巩秀峰, 等. 内蒙古马铃薯晚疫病菌交配型和生理小种研究[J]. 西北农林科技大学学报(自然科学版), 2007, 35(11): 120124.
[21]陈思慧. 中国马铃薯主产区晚疫病菌遗传变异研究[D]. 呼和浩特:内蒙古大学, 2017.
[22]敖翔. 黑龙江省马铃薯晚疫病菌群体结构及块茎晚疫病抗性分析[D].哈尔滨:东北农业大学,2018.
[23]李璐. 致病疫霉群体结构及诱导剂与杀菌剂对晚疫病防效研究[D].哈尔滨:东北农业大学,2019.
[24]张治斌. 中国马铃薯主产区晚疫病菌表型和SSR基因型分析[D].呼和浩特:内蒙古大学,2020.
[25]王英华, 国立耘, 梁德霖, 等. 马铃薯晚疫病菌在内蒙古和甘肃的交配型分布及对几种杀菌剂的敏感性[J]. 中国农业大学学报, 2003, 8(1): 7882.
[26]孙银银. 西北部分地区致病疫霉菌的交配型分布和遗传多样性初步分析[D]. 杨凌: 西北农林科技大学, 2010.
[27]惠娜娜, 李继平, 李青青, 等. 甘肃马铃薯晚疫病病菌交配型及对甲霜灵的敏感性[J]. 甘肃农业科技, 2010(10): 810.
[28]王生荣, 吕伟, 李惠霞. 甘肃马铃薯晚疫病菌交配型和对霜脲氰的敏感性测定 [C]∥ 2010年中国菌物学会学术年会论文摘要集. 长沙: 中国菌物学会, 2010: 89.
[29]杨海萍. 甘肃省马铃薯晚疫病菌的群体遗传多样性分析[D]. 杨凌: 西北农林科技大学, 2011.
[30]李继平. 甘肃马铃薯晚疫病菌群体结构及病害治理技术研究[D]. 兰州: 甘肃农业大学, 2013.
[31]李会平. 抗病性鉴定圃马铃薯晚疫病菌群体遗传多样性分析[D]. 杨凌: 西北农林科技大学, 2014.
[32]张大为, 惠娜娜, 王立, 等. 甘肃省马铃薯致病疫霉交配型组成及其对甲霜灵的抗药性[J]. 西北农业学报, 2014, 23(6): 184188.
[33]方治国. 中国马铃薯晚疫病菌交配型与无毒基因多样性分析[D].福州:福建农林大学, 2013.
[34]DAY J P,WATTIER R A M, SHAW D S, et al. Phenotypic and genotypic diversity in Phytophthora infestans on potato in Great Britain, 1995-1998 [J].Plant Pathology, 2004, 53(3):303315.
[35]WINTON L M, LEINER R H, KROHN A L, et al. Occurrence of late blight caused by Phytophthora infestans on potato and tomato in Alaska [J]. Plant Disease, 2007, 91(5):634.
[36]趙志坚,李先平,李成云,等.致病疫霉线粒体DNA单倍型的分子鉴别[J].云南农业大学学报, 2002(4):434435.
[37]郭军, 屈冬玉, 巩秀峰.内蒙古马铃薯晚疫病菌基因型多样性分析[J]. 西北农林科技大学学报(自然科学版), 2007, 35(4):120124.
[38]马云芳. 西北马铃薯主产区致病疫霉菌线粒体DNA单倍型分析[D]. 杨凌: 西北农林科技大学, 2012.
[39]杨策. 中国马铃薯晚疫病菌线粒体单倍型与温度适应性分析[D]. 福州: 福建农林大学, 2013.
[40]TIAN Y E, YIN J L, SUN J P, et al. Population genetic analysis of Phytophthora infestans in northwestern China [J]. Plant Pathology, 2016, 65 (1): 1725.
[41]惠娜娜. 甘肃省马铃薯晚疫病菌线粒体DNA单倍体型组成与分析[C]∥ 中国作物学会马铃薯专业委员会. 2015年中国马铃薯大会: 马铃薯产业与现代可持续农业, 2015: 426430.
(责任编辑:田 喆)
