甘肃省党参根腐病菌的分子生物学鉴定及区域分布
2022-04-04徐雪芬李惠霞倪春辉李文豪李焕宇陈垣胡芳弟
徐雪芬 李惠霞 倪春辉 李文豪 李焕宇 陈垣 胡芳弟






摘要 为明确甘肃省党参根腐病病原菌种类、优势种及病原菌种群在不同区域的分布差异,采用组织分离法对甘肃省陇西、渭源、临洮、岷县和宕昌等5个党参主产县的病样进行分离纯化和柯赫氏法则验证,通过rDNA-ITS、TEF-1α序列聚类分析鉴定不同区域病原菌种类及分离频率。结果发现,引起甘肃省党参根腐病的病原菌主要为镰孢属Fusarium真菌,分离频率为72.66%,包括尖镰孢F.oxysporum、锐顶镰孢F.acuminatum、茄镰孢F.solani、木贼镰孢F.equiseti和燕麦镰孢F.avenaceum等9个种,其中尖镰孢和锐顶镰孢为优势种,分离频率分别为41.80%和16.41%。5个主产县党参根腐病病原种类及其分离频率各不相同,但优势属均为镰孢属,优势种均为尖镰孢。其中渭源县分离的病原菌种类最多,分离到镰孢属的6个种;其次为岷县,分离到镰孢属的5个种;临洮县分离的病原菌种类最少。部分镰孢菌在甘肃省党参产区为首次发现。
关键词 党参; 党参根腐病; rDNA-ITS; TEF-1α; 地域性差异
中图分类号: S435.675
文献标识码: A
DOI: 10.16688/j.zwbh.2021003
Abstract To identify the species, dominant species and regional distribution of the root rot pathogens of Codonopsis pilosula in Gansu province, the tissue isolation method was used to isolate and purify the pathogens from diseased samples collected from five main producing counties in Gansu province, including Longxi county, Weiyuan county, Lintao county, Minxian county and Tanchang county, and verification test was carried out according to the Koch’s rule in this study. The pathogen species and isolation frequencies in different regions were determined by sequence cluster analysis of rDNA-ITS and TEF-1α. The results showed that Fusarium spp. was the main pathogen of C.pilosula root rot in Gansu province; its isolation frequency was 72.66%, including F.oxysporum, F.acuminatum, F.solani, F.equiseti and F.avenaceum. F.oxysporum and F.acuminatum were the dominant species, with an isolation frequency of 41.80% and 16.41%, respectively. The pathogen species and isolation frequency of C.pilosula root rot were different in five main producing counties, but the dominant genus and the dominant species in all regions were Fusarium and F.oxysporum. Among the counties, most species of pathogens were found in Weiyuan county, including six species of Fusarium, followed by Minxian county (five species), and the least species of pathogens were found in Lintao county. Some Fusarium species were found for the first time in C.pilosula planting areas in Gansu province.
Key words Codonopsis pilosula; root rot of C.pilosula; rDNA-ITS; TEF-1α; regional difference
黨参为桔梗科Campanulaceae党参Codonopsis pilosula (Franch.) Nannf.、素花党参C.pilosula Nannf.var. modesta (Nannf.) L. T. Shen或川党参C.tangshen Oliv.的干燥根[12]。党参为常用的大宗药材,在我国应用历史悠久[3],《神农本草经》中将其列为上品。党参味甘性平,具有补中益气,健脾益肺之功效[4],用于治疗脾肺虚弱、气短心悸、食少便溏、虚喘咳嗽及内热消渴等证,常用作人参的替代品,是中国最早规模种植和外销的著名药材之一[5]。近年来,随党参化学成分、作用机理研究的深入,党参的药用价值得到进一步开发,其经济价值也显著提高,发展前景广阔[3]。
据张向东等[3]对中药党参资源的调研,甘肃为中药党参的最大产区,主要分布在甘肃省定西和陇南地区。笔者2019年对甘肃省陇西、渭源、临洮、岷县及宕昌等地党参病害调查时发现,根腐病是发生最为普遍且危害最重的党参病害之一,不但导致药材产量降低,而且会影响其药用价值,给当地农户造成巨大的经济损失。经统计,根腐病在甘肃省5个党参主产县均有发生,一般田块病株率为10%~50%,重病田高达65%左右(待发表),严重制约了当地党参产业的可持续发展。根腐病是多种病原菌复合侵染导致的病害,病原种类繁杂,防治非常困难。
镰孢属Fusarium真菌是引起党参根腐病的主要类群,该属多个种可引起党参根腐病。然而由于地域环境、生态条件等的不同或变化,不同地区病原种类和优势种存在差异[6]。赵纯森等[7]研究发现,引起湖北党参根腐病的主要病原菌为尖镰孢F.oxysporum和柱孢菌Cylindrocarpon sp.。随后,相关研究[810]相继报道党参根腐病原为尖镰孢。龙合正等[11]发现贵州省毕节市威宁县的党参根腐病是由镰孢菌Fusarium、拟茎点霉Phomopsis等多种真菌和细菌单独或复合侵染造成的。孙新荣等[12]发现引起甘肃渭源党参根腐病的主要病原菌为尖镰孢F.oxysporum和锐顶镰孢F.acuminatum。2018年,本课题组从采集自渭源县的6份党参根腐病样中分离到尖镰孢和茄镰孢,其中茄镰孢为首次发现的党参根腐病病原[13]。
目前,甘肃省党参根腐病的病原菌种类和优势种尚不明确,尤其是病原菌在不同区域的分布差异未见报道。因此本试验从甘肃省不同地区采集了党参根腐病样品,通过病菌分离鉴定和分离频率分析,明确甘肃省党参主产区根腐病的病原菌种类、优势种及其在区域间的差异,以期为党参根腐病发生规律研究奠定基础,也为该病的有效防治提供依据。
1 材料与方法
1.1 材料
2019年10月,在党参Codonopsis pilosula大面积采收期间,对甘肃省定西市(陇西、渭源、临洮、岷县)和陇南市(宕昌)党参种植地的根腐病发病情况进行随机调查,参照孙新荣等[12]对党参根腐病两种症状的描述(维管束变色暂定为急性青枯;局部腐烂暂定为慢性黄萎),统计各地区不同症状的发病情况。采集党参根腐病样带回实验室直接分离或保存于4℃备用。新鲜健康党参采集于甘肃省渭源县新寨镇潞党参种植地。
1.2 方法
1.2.1 病原菌的分離纯化
采用组织分离法[14]从党参发病部位分离病原菌,并通过单孢分离法和菌丝尖端纯化法[1516]连续重复3次后,以菌饼保存于4℃冰箱,备用。
1.2.2 病原菌的分子生物学鉴定
DNA提取:刮取PDA上培养7 d的病原菌,采用真菌基因组DNA快速抽提试剂盒(生工生物工程(上海)股份有限公司)提取DNA,具体提取方法参照说明书。采用彭成彬等[17]及杨波等[18]报道的引物(表1)扩增病原菌的rDNA-ITS和TEF-1α序列。引物由西安擎科新业生物技术有限公司合成。参考郭炜等[19]的扩增体系并作优化:模板DNA 2 μL,10 μmol/L上、下游引物各2 μL,PCR Taq Mix(Taq polymerase、dNTPs、2×PCR buffer)13 μL,ddH2O 6 μL。扩增程序为:94℃预变性3 min;94℃变性30 s,52℃复性30 s,72℃延伸30 s,35个循环;72℃延伸10 min,4℃保存。PCR扩增产物经1%琼脂糖凝胶电泳检测后送西安擎科新业生物技术有限公司测序。将所得序列在GenBank(http:∥www.ncbi.nlm.nih.gov)核酸序列数据库中进行BLAST同源性比对,下载与本研究序列高度同源的rDNA-ITS序列及TEF-1α序列,利用MEGA 6.0软件对上述序列进行多重对位排列并进行人工校正,采用NJ法(neighbor-joining method)构建系统发育树,并进行1 000次bootstrap,检验系统进化树可靠性。分析病原菌菌株与数据库菌株的亲缘关系,进行近缘物种信息的确认[6]。
1.2.3 病原菌的致病性测定
参考黄亚萍的离体根部接种法[16],健康党参根消毒后,将7根5号昆虫针(0.71 mm×40 mm)捆绑在一起,在党参根表面扎出3个(直径2 mm×深3 mm)伤口,各伤口之间相距3~4 cm,接入直径为5 mm的菌饼。随后将其置于直径15 cm的培养皿中,皿内垫2层灭菌纱布,加无菌水保湿,培养箱恒温培养(25℃±1℃,L∥D=12 h∥12 h)。每株菌接种3个参根,以刺伤后接PDA培养基为对照。7 d后统计发病率及致病强度[6]。待植株发病后,观察发病症状,并从病部再分离病原菌,比较所分离病原菌与原接种病原菌是否一致。
1.2.4 病原菌的区域性差异
在明确代表性菌株分类地位和致病性的基础上,按照不同地区党参根腐病病原菌的种类、数量和致病症状类型,通过比较分离频率判断不同区域的优势病原菌群[6]。
分离频率=某种真菌的分离株数/分离的真菌总株数×100%[19]。
2 结果与分析
2.1 党参根腐病发病症状及其在各县的占比情况
根据采收调查情况和农户反映,根腐一般发生在党参移栽发芽后,4月-5月开始发病,6月-7月为发病盛期并且一直持续到采收期。根腐病症状有两种类型。类型一,发病初期地下部分维管束变黄,须根发红,主根停止生长,地上部分出现干枯萎蔫,维管束颜色逐渐加深至深褐色,农民称之为“黄心病”。在发病后期,病部由维管束向外扩散,根组织逐渐腐烂,最后仅剩几根维管束“细丝”和部分根的表皮;类型二,根外部出现腐烂症状,从外到内呈水渍状腐烂。两者在后期均有酸臭味,采集后保湿2~3 d,根茎上有白色菌丝附着。
2种发病症状在各县的占比情况见表2。从整体情况看,类型一占比高于类型二,其中临洮县类型一占76.47%,约为类型二的3倍;渭源县2种类型的占比基本相同;从平均值来看,类型一占60.16%,明显高于类型二(39.84%),二者的比例约为6∶4。
2.2 菌株的分离纯化
从甘肃省5个党参主产县共分离得到256株真菌分离物,由于采样时期为采收时期,病样中菌类较多,并且本研究采样地较广,分离菌株较多,对所有菌株进行分离鉴定比较困难,对两种症状分离菌株统计也较为困难,故根据菌落形态、菌丝生长状态、色素颜色和孢子形态,将这些菌株初步归为30组,每组类型选取1株代表菌株,开展后续试验。
2.3 分子生物学鉴定
利用真菌rDNA-ITS通用引物对代表菌株进行PCR扩增,结果从17个代表菌株中获得大小约为700 bp的片段,经BLAST比对和系统发育树分析表明,这17个代表菌株归属于10个属(图2),包括镰孢属Fusarium(F4、E10、B44和C15)、毛霉属Mucor(A40、C16)、小球壳属Plectosphaerella(B40、E6)、链格孢属Alternaria(D18、F5)、异茎点霉属Paraphoma(D31、D41)、红贝菌属Earliella(F6)、毛壳属Chaetomium(E25)、黑团孢属Periconia(D39)、格孢腔菌目Pleosporales(D30)及角担菌属Ceratobasidium(A32)。
利用镰孢属TEF-1α特异性引物对镰孢属的TEF区段进行PCR扩增,结果从13株菌中获得大小为700 bp的片段。序列分析表明,这13株菌可归属8个种(图3),包括尖镰孢F.oxysporum(A1、D6)、锐顶镰孢F.acuminatum(A18、A21、B21)、茄镰孢F.solani(A49、B42、C14)、木贼镰孢F.equiseti(A31)、燕麦镰孢F.avenaceum(B30)、拟轮枝镰孢F.verticillioides(B33)、芬芳镰孢F.redolens(B34)以及柔毛镰孢F.flocciferum(C12)。综合rDNA-ITS和TEF-1α的结果,镰孢属病原共有9个种。
2.4 致病性测定
致病性测定结果表明,接种代表菌株2 d后,党参根部均开始出现症状,刺伤接菌部位呈现萎缩、凹陷等症状,表皮颜色略有变褐。随着时间的延长,颜色逐渐加深。第7天时,症状表现不同,可以分为2类: 1)参根刺伤处外部表现为深褐色、凹陷的病斑,接种点周围出现菌丝,参根以刺伤处为中心,呈水渍状腐烂,从接种部位到组织内部的切面水渍状腐烂且向中心扩散(图4c,4f),主要由
锐顶镰孢、茄镰孢、拟轮枝镰孢、三线镰孢及链格孢属、小球壳属
真菌引起;2)参根接种处病斑为深褐色,横切病斑,可见自接种处至整个维管束颜色由深褐色逐渐变浅至黄色,形成纵向的变色条带(图4b,4e,4g),主要由
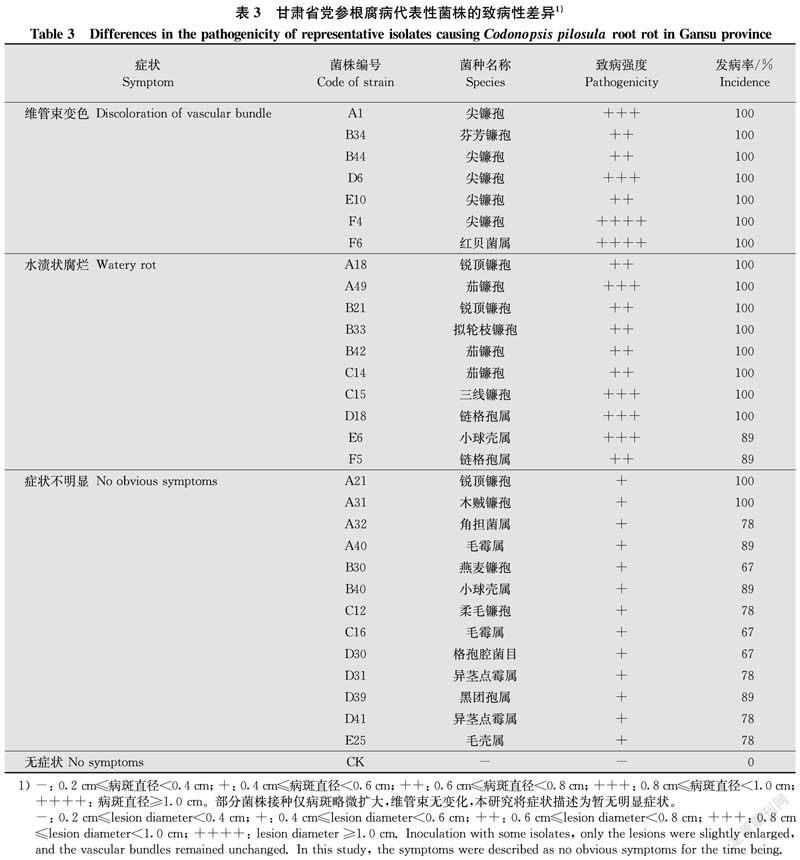
芬芳镰孢、尖镰孢和红贝属真菌引起。30株代表菌株接种党参后,发病率、致病强度及发病症状存在差异(表3),其中致病强度较低的菌株A21、A32、B30、B40、D30、D31、D39、E25等,接种部位组织机械损伤增大,其他部位无明显症状(图4d);菌株A31、A40、C12、C16、D41等,接种部位组织机械损伤增大,维管束变色(图4e)。从接种处分离病原,所得菌株的形态特征与接种菌株的形态特征基本一致,符合柯赫氏法则。可初步确定30株代表菌株中大部分对党参均具有一定致病性。
2.5 菌株区域性差异分析
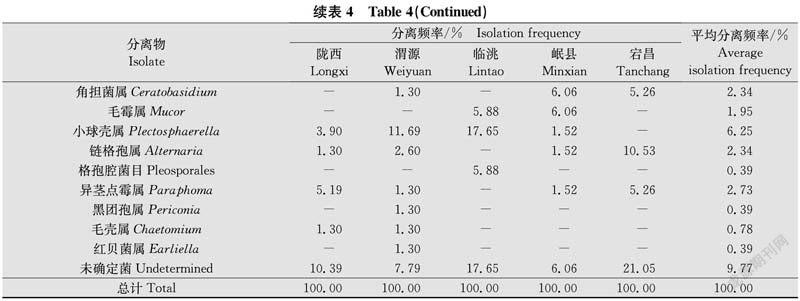
甘肃省党参根腐病的分離真菌在种类、分离频率及地域分布上呈现出明显差异性(表4)。从分离频率来看,镰孢属为优势属,其分离频率为72.66%,其余菌株分离频率均不足10%。
镰孢属菌株在种类、分离频率及地域分布方面不相同。从分离频率来看,尖镰孢和锐顶镰孢为甘肃省优势菌,其分离频率分别为41.80%、16.41%,其余病菌分离频率较低。尖镰孢在所有地区县均为第一优势种,分离频率均在31%以上;岷县的优势种还包括锐顶镰孢和木贼镰孢,分离频率依次为18.18%和12.12%;陇西和渭源的优势种还有锐顶镰孢,分离频率分别为22.08%和15.58%;宕昌的优势种还有燕麦镰孢,分离频率为15.79%;临洮县优势病原菌仅有尖镰孢。此外,部分镰孢菌为某些地区独有,如拟轮枝镰孢仅在陇西县被检出,芬芳镰孢和柔毛镰孢仅在渭源县被检出,三线镰孢仅在岷县被检出。
3 讨论
本研究从甘肃省定西市陇西县、渭源县、临洮县、岷县以及陇南市宕昌县的5个党参主产县分离得到256株真菌,经rDNA-ITS序列比对分析,分别属于镰孢属、异茎点霉属、毛霉属、小球壳属、链格孢属、红贝菌属、毛壳属、黑团孢属、格孢腔菌目和角担菌属。其中镰孢属为甘肃省党参根腐病病原优势属,共分离到186株,分离频率为72.66%;其他属菌株分离频率较低,均不足10%。经TEF-1α序列分析将镰孢属菌株进一步鉴定为尖镰孢、锐顶镰孢、木贼镰孢、茄镰孢、燕麦镰孢、拟轮枝镰孢、芬芳镰孢、柔毛镰孢、三线镰孢9个种,其中尖镰孢和锐顶镰孢为优势种。
已报道的党参根腐病病原主要有尖镰孢[78,10,12]、锐顶镰孢[1213]、茄镰孢[13]、三线镰孢[20]、柱孢菌[7]、拟茎点霉[11]及Pythium myriotyium[21]。本研究通过离体接种试验初步确定:芬芳镰孢、尖镰孢和红贝菌属真菌主要引起急性青枯;锐顶镰孢、茄镰孢、拟轮枝镰孢、三线镰孢,以及链格孢属、小球壳属真菌主要引起慢性黄萎。尖镰孢在各县分离频率均为最高,这与田间调查急性青枯发病率较高相对应。但由于为离体接种,此结果还需进一步验证。镰孢属中除燕麦镰孢(B30)外,其余8种对党参均有不同程度的致病性;除镰孢属外,毛霉属、链格孢属、红贝菌属的代表菌株对党参也有一定致病性,可能为党参根腐病的病原菌。但燕麦镰孢为宕昌县优势菌,是否为致病菌有待进一步验证。毛霉属(A40、C16)、异茎点霉属(D31、D41)、毛壳属(E25)、黑团孢属(D39)、格孢腔菌目(D30)和角担菌属(A32)真菌回接后7 d,接菌部位病斑略有扩大,但切开后发现内部变化不明显,致病强度均为“+”,且分离频率均<3%,故这些分离物可能不是党参根腐病病原;链格孢属(D18、F5)和红贝菌属(F6)虽致病强度为“++”及以上,但分离频率<3%,是否为党参根腐病病原菌有待进一步验证;小球壳属(B40的致病强度为“+”,E6的致病强度为“+++”)分离频率6.25%,回接后致病强度明显不同,表明不同地理来源病原菌株可能存在致病力分化。综上所述,本研究分离得到党参根腐病原菌主要为镰孢属真菌,包括9个种,除了尖镰孢、锐顶镰孢、茄镰孢和三线镰孢已有报道,其余5个种为首次在中国甘肃省党参产区分离得到的根腐病菌。由此表明,党参根腐病为多种病原侵染的复合型病害,且病原菌种类丰富多样。
目前除甘肃外,对党参根腐病的研究主要集中在湖北[7]、重庆[8]及贵州[11]等地。由于地区不同,分离到的病原菌不同;并且采集地块、采集时间不同,病原菌的种类也有所不同[18]。本研究发现镰孢属的多个种都可引起党参根腐,且不同地区分布种类不同,甘肃渭源县最多,有6个种;临洮县最少,仅有1个种。此外,尖镰孢为甘肃省的优势病原菌并在离体致病性的研究中表现出强致病性,这与赵纯森等[7]、余中莲等[8]、王艳等[10] 和孙新荣等[12]的研究结果一致。该菌也是多种植物根腐病的主要病原菌[22]。因此,在党参根腐病的防治中,应该主要針对尖镰孢,并兼顾其他病原菌进行防治。
根腐病是一种真菌性土传病害,甘肃省党参主产区已普遍发生,造成不同程度经济损失。根腐病病原菌以伤口侵染为主,而党参种苗在移栽的过程中根部经常会受到损伤,在生长过程中植物线虫和地下害虫为害根系也会造成伤口,为病原菌侵入创造了条件。病原菌从根部侵入植物,引起维管束病变后造成植株枯死。本研究通过大量采样和鉴定,明确了甘肃省党参根腐病主要是由镰孢属为主的真菌侵染引起的,并可能存在多种病原菌复合侵染,这为该地区党参根腐病的有效防治提供了理论依据。但有关该病病原菌地域性的发生规律、侵染过程及其致病机理等方面还需进一步研究。
参考文献
[1] 侯嘉, 郭鸿儒, 赵磊. 党参食用价值的开发及前景展望[J]. 中兽医医药杂志, 2019, 38(3): 2023.
[2] 杨慧珍, 陈垣, 郭凤霞, 等. 甘肃省宕昌县党参野生资源调查研究[J]. 中国中药杂志, 2016, 41(2): 186191.
[3] 张向东, 高建平, 曹铃亚, 等. 中药党参资源及生产现状[J]. 中华中医药学刊, 2013, 31(3): 496498.
[4] 李聪, 张红, 彭莉, 等. 党参中挥发性化学成分的研究[J]. 云南大学学报(自然科学版), 1993(S2): 8690.
[5] 赵云生, 李占林, 田洪岭, 等. 党参种质资源生态多样性研究[J]. 中国农学通报, 2007(11): 361366.
[6] 高芬, 赵晓霞, 秦雪梅, 等. 山西省蒙古黄芪根腐病优势致病菌群分析[J]. 植物保护学报, 2018, 45(4): 878885.
[7] 赵纯森, 李德望, 卫扬斗, 等. 党参根腐病病株上分离的几种病原真菌的致病性及其生物学特性——党参根腐病研究续报Ⅰ[J]. 湖北农业科学, 1989(6): 2325.
[8] 余中莲, 雷美艳, 蒲盛才, 等. 重庆党参真菌病害种类调查及病原鉴定[J]. 中药材, 2015, 38(6): 11191122.
[9] 傅俊范. 中草药病害防治系列(5)——党参病害防治[J]. 新农业, 2000(10): 4243.
[10]王艳, 陈秀蓉, 王引权, 等. 甘肃省党参病害种类调查及病原鉴定[J]. 山西农业科学, 2011, 39(8): 866868.
[11]龙合正, 安勇. 浅析威宁县党参根腐病的发生及防治[J]. 山西农经, 2018(9): 78.
[12]孙新荣, 仲彩萍, 张西梅, 等. 甘肃定西地区党参根腐病病原鉴定与防治研究[J]. 植物保护, 2020, 46(5): 290 297.
[13]徐雪芬, 倪春辉, 李惠霞, 等. 党参根腐病病原菌鉴定及其室内毒力测定[J]. 浙江农业学报, 2021, 33(1): 96103.
[14]方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1988: 4650.
[15]于晶, 周峰, 陈君, 等. 肉苁蓉内生真菌多样性研究[J]. 中国中药杂志, 2011, 36(5): 542546.
[16]黄亚萍. 当归根腐病病原物研究[D]. 兰州: 甘肃农业大学, 2011.
[17]彭成彬, 柯栋贤, 陈美霞, 等. 茶树镰刀菌的分离鉴定和遗传多样性研究[J]. 中国茶叶, 2018, 40(8): 2429.
[18]杨波, 郭成瑾, 王喜刚, 等. 新疆马铃薯镰刀菌根腐病发生危害调查及病原菌鉴定[J]. 西北农业学报, 2019, 28(12): 20692077.
[19]郭炜, 李雪萍, 漆永红, 等. 西北地区冬小麦茎基腐病原假禾谷镰刀菌的鉴定及种质资源抗性筛选[J]. 甘肃农业大学学报, 2018, 53(6): 164170.
[20]漆永红, 李敏权, 曹素芳, 等. 一种新的党参根腐病害镰孢菌鉴定[J]. 甘肃科技, 2021, 37(1): 4346.
[21]KIM J W, CHANG S W, KIM S K. Root rot of Codonopsis pilosula caused by Pythium myriotylum [J]. The Korean Journal of Mycology, 2001, 29(2): 127130.
[22]伍晓丽, 王钰, 刘飞, 等. 黄连根腐病镰刀菌属病原真菌鉴定[J]. 中国中药杂志, 2020, 45(6): 13231328.
(责任编辑:杨明丽)
