黄瓜抗细菌性角斑病诱抗药剂的筛选及抗性机制研究
2022-04-04张胜平程颖石朝阳贾文章孟祥龙曹克强
张胜平 程颖 石朝阳 贾文章 孟祥龙 曹克强



摘要 为筛选诱导黄瓜抗细菌性角斑病(angular leaf spot,ALS)的最佳诱抗药剂,选取11种商品诱抗剂,研究其室内诱导黄瓜抗细菌性角斑病的作用效果。结果显示11种诱抗剂的预处理均能有效提高黄瓜植株的长势,提高黄瓜对细菌性角斑病的抗性,表现为叶片病斑面积显著下降。其中药剂信号施康乐(SK)能有效减小叶片病斑面积,防效最好,而药剂顶花增瓜嫩直长(DH)处理的植株叶片病斑面积最大。为了进一步明确诱抗剂的作用机制,对诱抗剂SK和DH处理后的抗性相关基因SOD、SSU以及PR1-1a的相对表达量进行了初步分析。结果表明,SK和DH处理后3个基因的相对表达量均显著提高,SK处理的相对表达量显著高于DH处理。综上所述,合理施用信号施康乐可以诱导黄瓜幼苗提高对细菌性角斑病的抗性,对于黄瓜细菌性角斑病的早期预防和减少农药使用具有重要意义。
关键词 细菌性角斑病; 诱抗剂; 诱导抗性; 丁香假单胞菌流泪致病变种
中图分类号: S436.421.1
文献标识码: A
DOI: 10.16688/j.zwbh.2020688
Abstract In order to screen effective inducers to bacterial angular leaf spot (ALS) of cucumber, 11 commercial inducers were selected to investigate the inducing resistance to ALS in cucumber plants. Results showed that commercial inducers treatment improved the resistance of cucumber seedlings to ALS. The growth of plants treated with commercial inducers was improved and the lesion area of cucumber leaves inoculated with Pal was significantly decreased. Among the commercial inducers, signal-shikangle (SK) treatment has the best control effect with the smallest leaf lesion area, and inducer of plants (DH) treatment had relative low control effect. In order to further clarify the mechanism of inducers, the relative expression levels of SOD, SSU and PR1-1a genes which related to resistance were preliminarily analyzed after treatment with SK and DH. The results showed that the relative expression levels of above three genes were significantly increased after treated with SK and DH, and that treated with SK was significantly higher than that treated with DH. In conclusion, reasonable application of SK may induce cucumber seedlings to improve the resistance to ALS, which is of great significance for the early prevention of ALS and the reduction of pesticide application.
Key words angular leaf spot (ALS); inducers; induced resistance; Pseudomonas amygdali pv. lachrymans (Pal)
丁香假單胞菌流泪致病变种Pseudomonas amygdali pv. lachrymans (Pal)侵染黄瓜叶片引起的细菌性角斑病(angular leaf spot,ALS)在黄瓜苗期和成株期均可发生,该病害具有发病时间短,扩展蔓延速度快,危害严重等特点,是黄瓜生产中常见的病害[14]。Pal可在种子或病残体中过冬躲避不利环境,并通过种子、水滴、昆虫、农具、气溶胶等多种途径传播[511]。细菌性角斑病发生的温度范围在10~30℃之间,最适温度为25~28℃,空气湿度大利于病害的发生和蔓延,相对湿度高于70%更容易导致病害的大面积扩散[12]。近年来,我国北方地区冬季黄瓜设施栽培面积日益增加,设施结构密闭的环境、较高的温度和湿度导致细菌性角斑病呈逐年上升的趋势,已成为黄瓜安全生产的重大威胁[13]。
长期以来,对细菌性角斑病的防控主要以化学防治为主,且尚无有效防控细菌性角斑病的抗性品种。植物诱抗剂可以激活植物的免疫系统,调节植物的新陈代谢,增强植物抗病和抗逆能力[14]。植物诱抗剂对植物病原物没有直接的杀灭作用,而是由外源生物或分子诱导或激活植物产生抗性物质使植物对病原物产生抗性或抑制病菌的生长,具有在提高农作物抗性和有效防控植物病害的同时,从源头上减少农药对环境和农产品污染的作用,更符合当今食品安全和农业可持续发展的要求[14],并广泛应用于生产中。当前,商品化的诱抗药剂种类繁多,其成分主要为激活蛋白质类、寡糖类、植物生长调节剂类、拮抗微生物类以及微量元素叶面肥[1415]。利用诱抗剂诱导黄瓜产生抗性来减轻病害的发生已有报道[1618],而有效诱导黄瓜抗细菌性角斑病的商品药剂种类及诱导后黄瓜中响应Pal侵染的特异基因的相对表达水平研究罕有报道。
本研究选取11种商品药剂,室内开展不同药剂诱导黄瓜抗细菌性角斑病的试验,研究不同药剂的诱抗效果,筛选有效诱导黄瓜抗细菌性角斑病的商品药剂种类,验证药剂诱导后黄瓜中响应Pal侵染的特异基因的相对表达水平,为实际生产中选用有效的商品诱抗药剂防控细菌性角斑病和深入研究黄瓜抗Pal侵染机制奠定理论基础。
1 材料与方法
1.1 供试材料
黄瓜品种:‘先优达’,天津先优达种子有限公司。基质:草炭、蛭石、珍珠岩按1∶1∶1配比,于180℃烘箱灭菌6 h后备用。供试菌株:Pal 分离自黄瓜细菌性角斑病叶片,保存于-80℃。
供试商品药剂(表 1):信号施康乐(SK),四川海博氏生物科技有限公司;阿泰灵(AT),北京中保绿农科技集团有限公司;植物免疫诱抗剂(MY),沃宝生物科技有限公司;正业海岛素氨基寡糖素(HD),海南正业中农高科技有限公司;枯草芽胞杆菌(KC),北京中保绿农科技集团有限公司;艾护植物疫苗(AH),南京锐迈特科技股份有限公司;优得列(YD),河北木美土里科技股份有限公司;超敏蛋白(CM),湖南农大哥科技开发有限公司;碧护(BH),德国阿格福莱农林环境生物科技有限公司;S-诱抗素(SY),陕西杨凌奥邦生物科学有限公司;顶花增瓜嫩直长(DH),山东四海汇农生物科技有限公司。
1.2 黄瓜植株
黄瓜种子用无菌水冲洗干净,55℃温水中浸泡2.5 h。无菌水浸润8层灭菌纱布包裹的种子置于30℃催芽,36 h后播种于营养钵(直径10 cm),每钵1粒,置于河北农业大学智能温室(L∥D=16 h∥8 h,28℃,相对湿度80%)培养。
1.3 药剂配制及施药方法
无菌水溶解药剂配制母液(表1),-4℃保存备用。使用时按照推荐浓度,用无菌水稀释到终浓度(表1)。药剂喷淋诱导系统抗性的方法参照李玉红等[19],并稍加修改:喷淋时先用纸板盖住营养钵中的基质,第2片真叶伸展后喷淋第1次,喷淋范围为纸板至第2片真叶;第3片叶子伸展后喷淋第2次,喷淋范围为纸板至第3片真叶。喷淋药剂时用锡纸包裹住所喷淋叶片的植株上部至生长点,避免药剂滴入栽培基质和接触喷淋叶片的植株上部及生长点,每次每株喷施15 mL,每种药剂喷施5株黄瓜幼苗,使用无菌水喷淋10株黄瓜幼苗作为对照(CK)。
1.4 黄瓜角斑病菌的接种
取出保存于-80℃的菌株,冰上融化,于LB固体培养基上划线后置于培养箱,28℃黑暗培养16 h。挑取单菌落,接种于150 mL LB液体培养基中,在28℃,220 r/min培养16 h,OD600为1时备用。第2次药剂喷淋后6 d,喷雾接种Pal 菌液。接种方法:纸板盖住营养钵中的基质,锡纸包裹第2片真叶及下部植株,Pal菌液均匀喷雾接种于第3片真叶至植株生长点,菌液均匀展布于叶片,避免菌液滴入基质或接触植株其他部位,所有药剂处理的黄瓜幼苗,每株接种30 mL菌悬液;喷施无菌水的10株黄瓜幼苗中,5株喷施30 mL的Pal菌悬液,作为清水对照,5株喷施30 mL不含Pal的LB培养液作为空白对照。每个试验重复3次。
1.5 植株长势调查
接种Pal菌悬液前1 d调查植株长势。选取5株植株,测定植株高度(营养钵基质表面至顶端生长点)和植株茎粗(茎基部直径),每株测3次,计算平均值,SPSS软件(Version 12.0)进行显著性分析。
1.6 病症调查及Pal检测
接种Pal菌悬液后21 d,选取植株的第4片真叶进行研究。1)观察叶片症状;2)随机选择4片叶利用硫酸纸方格法测定叶片病斑面积并计算病斑面积比例,SPSS软件进行显著性分析;3)依据叶片病斑面积选择以下植株开展研究:i) 叶片病斑面积比例最大的药剂处理植株,ii) 叶片病斑面积比例最小的药剂处理植株,iii) 无药剂处理接种Pal的植株,iv) 无菌水处理未接种Pal的植株;每组随机选择3片叶子,75%乙醇冲洗叶片后无菌水冲洗叶片正反面3遍,吸水纸吸干叶片表面残留水滴,锡纸包裹置于液氮,-80℃保存。
Pal侵染检测:液氮研磨整片叶片,取研磨的叶片样品10 mg,用改良CTAB方法提取样品总DNA,对Pal的甘油醛三磷酸脱氢酶(gap1)基因片段(162 bp)进行PCR检测[20]。PCR反应体系(25 μL):PCR mix(天根生化科技有限公司,KT201-02,成分:Taq DNA聚合酶、dNTPs、MgCl2、反应缓冲液、PCR反应增强剂、PCR反应优化剂及PCR反应稳定剂)12.5 μL,上、下游引物各0.6 μL,模板1 μL, ddH2O 10.3 μL。Pal菌液总DNA提取参照TIANamp Bacteria DNA Kit DP302(天根生化科技有限公司)操作步骤,菌液PCR反应体系同叶片总DNA中检测gap1基因。PCR反应程序均为:95℃预变性10 min;95℃变性30 s,60℃退火30 s,72℃延伸15 s,35个循环;72℃延伸10 min;4℃保存。
1.7 特异基因相对表达水平
各取1.6中 i)、ii) 和 iii) 液氮研磨的叶片样品20 mg,用RNA提取试剂盒(新海基因检测有限公司)提取样品总RNA,无RNA酶水溶解RNA。NanoDrop 2000測定RNA浓度(A260/280范围2.0~2.2),无RNA酶水调整RNA浓度至相同浓度(70 ng/μL),置于-80℃保存。用反转录试剂盒(北京全式金生物技术有限公司)反转录成cDNA。
特异基因选用SOD[21]、SSU和PR1-1a[22],内参基因选用18S rRNA[23](表 2)。qRT-PCR反应体系(20 μL):PCR mix 12.5 μL,上、下游引物各0.5 μL,cDNA模板1 μL,ddH2O 5.5 μL。qRT-PCR三步法反应程序:95℃预变性10 min;95℃变性30 s,56℃退火30 s,72℃延伸15 s,45个循环。仪器自动获得Ct值。2-ΔΔCt法计算基因的相对表达量[24],SPSS软件进行差异显著性分析。
2 结果与分析
2.1 不同药剂对黄瓜植株长势的作用效果
药剂处理的黄瓜植株长势明显强于无药剂处理的对照組(图1a),但不同药剂提高植株长势的效果不同。显著性分析表明,S-诱抗素(SY)处理促进植株伸长与植株增粗的效果最佳,顶花增瓜嫩直长(DH)处理提高植株长势的效果弱于其他10种药剂(图1b, c)。
2.2 不同药剂诱导黄瓜抗细菌性角斑病效果
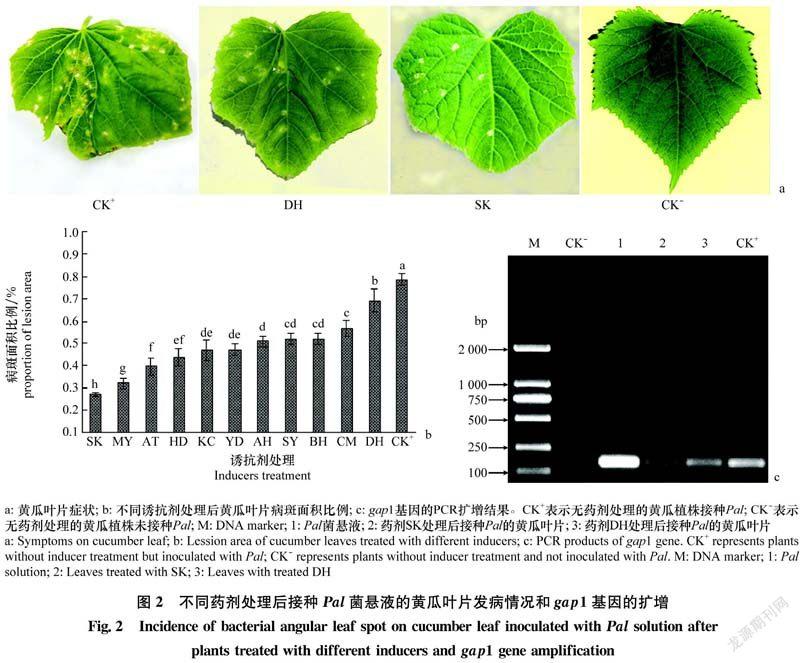
接种Pal的叶片均表现出干枯病斑、叶片边缘的锯齿状结构受损、黄化等症状。无药剂处理接种Pal的叶片(CK+)表现出干枯病斑、背面卷曲、边缘锯齿状结构受损、叶片不能正常伸展等明显症状。诱抗剂顶花增瓜嫩直长(DH)和信号施康乐(SK)处理植株后接种Pal的叶片也表现出干枯病斑和边缘锯齿状结构受损等症状,但病斑数量和受损程度显著低于CK+;DH处理植株后接种Pal的叶片病斑数量明显少于SK处理植株后接种Pal的叶片(图2a)。
显著性分析表明,11种药剂处理植株后接种Pal的叶片病斑面积比例显著低于无药剂处理接种Pal的叶片(CK+);信号施康乐(SK)处理植株后接种Pal的叶片病斑面积比例显著低于其他药剂处理的植株;顶花增瓜嫩直长(DH)处理植株后接种Pal的叶片病斑面积比例是11种药剂处理植株中最高的(图2b),表明11种诱抗剂均能诱导黄瓜抗细菌性角斑病,信号施康乐诱导黄瓜抗细菌性角斑病效果最佳。
PCR琼脂糖凝胶电泳显示,接种Pal的叶片和Pal菌液均出现阳性条带(162 bp),而未接种Pal的叶片无阳性条带,表明Pal侵染叶片并出现症状(图2c)。
2.3 特异基因相对表达水平的qRT-PCR验证
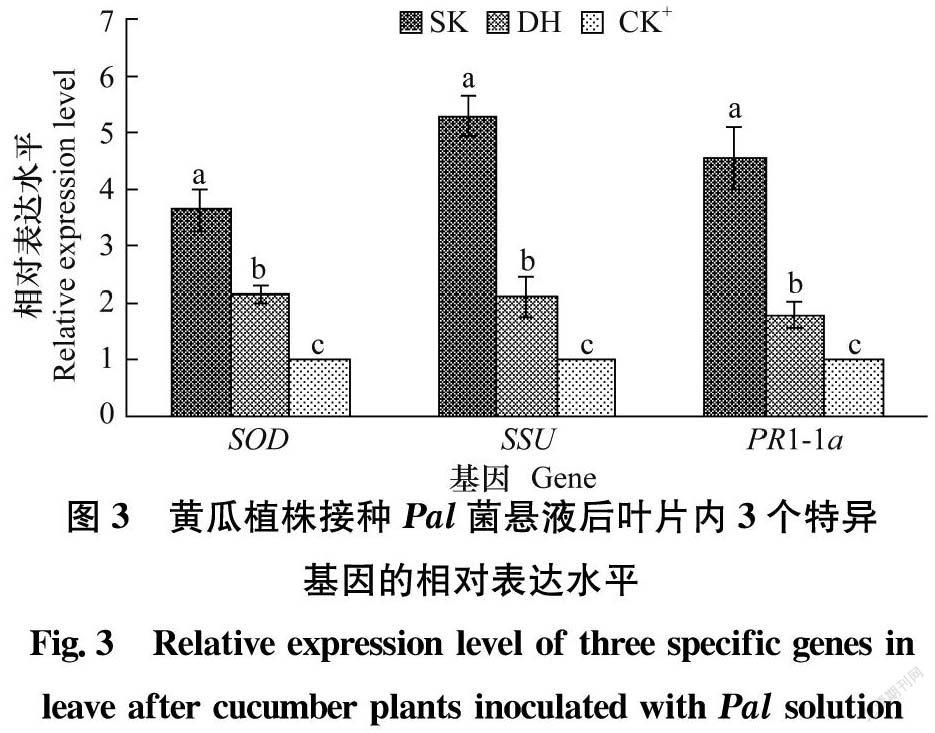
选取信号施康乐(SK)和顶花增瓜嫩直长(DH)处理植株后接种Pal的叶片和无药剂处理接种Pal的叶片(CK+)进行特异基因相对表达量分析。药剂处理植株后接种Pal的叶片中特异基因SOD、SSU和PR1-1a相对表达水平均显著高于无药剂处理接种Pal的叶片;SK处理植株后接种Pal的叶片中3个基因相对表达水平均显著高于DH处理的植株(图3)。表明3个特异基因的相对表达水平提高与药剂诱导黄瓜抗细菌性角斑病相关。
3 讨论
11种不同成分的商品诱抗剂室内诱导黄瓜抗细菌性角斑病的研究结果表明,药剂处理的黄瓜植株长势均显著好于无药剂处理的黄瓜植株,表明11种商品药剂均具有提高黄瓜植株长势的效果。药剂处理植株后接种Pal菌悬液的叶片均出现症状,其中信号施康乐处理植株的叶片发病最轻,抗细菌性角斑病效果最佳,顶花增瓜嫩直长处理植株抗细菌性角斑病效果相对最弱。顶花增瓜嫩直长的主要成分为微量元素并未标注含有诱抗成分,但仍能诱导黄瓜抗细菌性角斑病,表明其处理后植株长势的增强能提高黄瓜抗细菌性角斑病效果。尽管S-诱抗素提高黄瓜植株长势的效果最佳,但诱导黄瓜植株抗细菌性角斑病效果不及信号施康乐,表明药剂中添加的诱抗成分诱导黄瓜抗细菌性角斑病的效果优于植株长势增强带来的抗细菌性角斑病效果。
信号施康乐为2种产品组合(SK-α和SK-β)。SK-α的主要成分为微量元素和游离氨基酸,具有促进植物光合作用、营养吸收和营养平衡,迅速开启植物生长系统的功能。SK-β的主要成分为Harpin蛋白家族同源物HarpinEcc蛋白和HarpinEac蛋白。Harpin蛋白是梨火疫病病原菌中产生的一类超敏蛋白,它能引发植物识别病原菌的侵染而做出反应进而诱导植株产生系统抗性,Harpin Ea(Harpin蛋白家族成员)是最早分离的由hrpN基因编码能诱导植物抗性反应、促进植株生长发育的一种超敏蛋白[25]。SK-β中含有的HarpinEcc蛋白和HarpinEac蛋白是从白菜软腐病菌变种CSDS008菌株中获取的hrpN编码的超敏蛋白同源物,具有诱导植物产生抗病信号,激活植物抗性基因表达的功能。此外,协同产生的酶可提高植物营养吸收能力和生长发育能力。顶花增瓜嫩直长的主要成分为微量元素,微量元素易被植物吸收,具有快速补充植物体内缺少的元素,修复叶绿体结构,加快叶绿素的形成,提高光合作用等功能。
正常条件下,植物自由基的产生和清除是平衡的,但当碰到胁迫时这种平衡被打破[2627]。植物病原物侵染寄主植物后导致活性氧(reactive oxygen species, Ros)积累。大量活性氧的积累会损害植物细胞,间接引发抗氧化酶产生变化。研究表明,植物遭到病原物入侵后体内抗病相关的酶迅速转化,在抗病过程中发挥的作用与其变化密切相关[2832]。清除Ros的反应中第一个起作用的抗氧化酶是SOD,它是所有生物体在有氧情况下抗氧化应激反应的第一道防线[33]。甜瓜接种蔓枯病菌之前抗病和感病材料的SOD活性基本相同,而接种后抗病品种中SOD活性快速增强,而感病品种中SOD活性较弱,随着时间的延长,抗病品种中SOD活性始终大于感病品种,因此SOD活性变化与植物抗病性存在联系[34]。本试验中信号施康乐处理植株的叶片中SOD相对表达水平显著高于顶花增瓜嫩直长处理植株,而顶花增瓜嫩直长处理植株的叶片中SOD相对表达水平又显著高于无药剂处理的植株,表明SOD相对表达量增加表现出抗Pal侵染的反应。
植物病原细菌侵染寄主植物后影响植物光合作用[3536]。SSU是编码rubisco小亚基的基因,而rubisco小亚基与大亚基结合形成的rubisco(8L/8S)是参与光合作用暗反应的关键催化酶[37]。本试验中信号施康乐处理植株的叶片中SSU相对表达水平显著高于顶花增瓜嫩直长处理的植株,而顶花增瓜嫩直长处理植株的叶片中SSU相对表达水平又显著高于无药剂处理的植株,表明接种Pal后药剂处理的植株能提高光合作用速率以响应Pal侵染。
PR1蛋白通常被认为与植物抗病性密切相关,PR1蛋白的产生是系统获得抗性的标志[38]。qRT-PCR结果表明,诱抗剂处理黄瓜植株的叶片接种Pal后PR1-1a相对表达水平依次为信号施康乐>顶花增瓜嫩直长>清水对照处理,推断PR1蛋白是引发黄瓜抗细菌性角斑病的重要物质,信号施康乐处理黄瓜植株诱导产生的PR1抗Pal侵染的效果更强。
综上,11种药剂均具有效促进黄瓜抗细菌性角斑病的作用,信号施康乐诱导黄瓜抗细菌性角斑病效果最佳,表现为响应Pal侵染的SOD、SSU和PR1-1a的相對表达量显著提高,在生产中可选为预防黄瓜细菌性角斑病的诱抗药剂。试验中采用黄瓜植株底部叶片喷淋诱抗剂而上部叶片接种Pal菌悬液的方法,其目的在于研究诱抗剂提高黄瓜植株系统抗性的作用效果,以此避免商品诱抗剂中含有的杀菌剂接触Pal带来的影响。尽管田间生产中难以实现此操作,但使用诱抗药剂能有效提高植株的系统抗性,此外多数商品诱抗剂中含有抑制植物病原菌的成分,如:枯草芽胞杆菌,因此,生产中使用诱抗药剂喷淋植株不仅可有效提高植株的抗性还能达到抑制或杀灭植物病原菌的目的,其预防效果更佳。试验还发现植株长势强也有助于抗细菌性角斑病,而单一依靠提高植株长势诱导产生抗性水平显著低于诱抗成分带来的诱抗效果,可解释实际生产中同一栽培条件下长势强的植株较长势弱的植株发病轻,但并不能完全杜绝发病这一现象。
参考文献
[1] 崔彦, 王树桐, 曹露, 等. 几种中草药提取物对黄瓜细菌性角斑病菌的抑制作用[J]. 中国农学通报, 2008, 24(5): 308312.
[2] UNDERWOOD W, ZHANG S, HE S. The Pseudomonas syringae type Ⅲ effector tyrosine phosphatase HopAO1 suppresses innate immunity in Arabidopsis thaliana [J]. The Plant Journal, 2007, 52(4): 658672.
[3] XIANG Tingting, ZONG Na, ZOU Yan, et al. Pseudomonas syringae effector AvrPto blocks innate immunity by targeting receptor kinases [J]. Current Biology, 2007, 18(1): 7480.
[4] 王平, 樊金娟, 刘长远, 等. 黄瓜细菌性角斑病的分子检测[J]. 中国农学通报, 2012, 28(25): 150153.
[5] CARSNER E. Angular-leaf spot of cucumber: dissemination, overwintering and control [J]. Journal of Agricultural Research, 1918, 3: 210220.
[6] HANSEN M A. Angular leaf spot of cucumber [J]. Plant Pathology, 2009, 7: 255259.
[7] ELWAKIL M A, FARAG A, NABIL S, et al. Court of infection with Pseudomonas syringae pv. lachrymans in cucumber [J]. Pakistan Journal of Biological Sciences, 2001, 4: 635638.
[8] KRITZMAN R, ZURTRA D. Systemic movement of Pseudomonas syringae pv. lachrymans in the stem, leaves, fruits, and seeds of cucumber [J]. Canadian Journal of Plant Pathology, 1983, 5(4): 273278.
[9] SMITH E F, BRYAN M K. Angular leaf-spot of cucumbers [J]. Journal of Agricultural Research, 1915, 5: 465476.
[10]VAN-GUNDY S D, WALKER D W. Seed transmission, overwintering, and host range of cucurbit angular leaf spot pathogen [J]. Plant Disease Report, 1957, 41: 137140.
[11]CHAI Ali, YUAN Lifang, LI Lei, et al. Aerosol transmission of Pseudomonas amygdali pv. lachrymans in greenhouses [J/OL]. Science of the Total Environment, 2020, 748: 141433. DOI: 10.1016/j.scitotenv.2020.141433.
[12]孟祥龙. 黄瓜细菌性流胶病的病原鉴定、检测技术及应用[D]. 北京: 中国农业大学, 2017.
[13]孔维文, 李云龙, 王敬琦, 等. 黄瓜细菌性角斑病PMA-qPCR检测方法的建立和应用[J]. 生物技术通报, 2016, 32(2): 7075.
[14]邱德文. 植物免疫诱抗剂的研究进展与应用前景[J]. 中国农业科技导报, 2014, 16(1): 3945.
[15]张振华. 生防多粘芽孢杆菌SQR-21的定殖与诱导植物系统抗性研究[D]. 南京: 南京农业大学, 2011.
[16]杨文飞. 黄瓜根结线虫病的生物防治及其生态有机药肥研制[D]. 南京: 南京农业大学, 2011.
[17]于力, 郭世荣, 阎君, 等.亚精胺诱导黄瓜幼苗对白粉病抗性的研究[J]. 西北植物学报, 2012, 32(7): 13841389.
[18]孙明娜, 张勇, 马严明, 等. OS-诱抗剂诱导植物抗病性的作用探讨[J].植物保护, 2005, 31(1): 3739.
[19]李玉红, 程智慧, 陈鹏, 等.苯并噻二唑(BTH)诱导黄瓜幼苗对霜霉病抗性的研究[J].园艺学报, 2006, 33(2): 278282.
[20]MENG Xianglong, CHAI Ali, CHEN Lu, et al. Rapid detection and quantification of viable Pseudomonas syringae pv. lachrymans cells in contaminated cucumber seeds using propidium monoazide and a real-time PCR assay [J]. Canadian Journal of Plant Pathology, 2016, 38(3): 111.
[21]马伟荣, 单春会, 童军茂, 等. 哈密瓜铜锌超氧化物歧化酶(Cu/Zn-SOD)基因的克隆及生物信息学分析[J]. 食品工业科技, 2014, 35(13): 181185.
[22]毛伟华, 龚亚明, 宋兴舜, 等. CMV侵染胁迫下黄瓜重要功能基因表达及代谢响应的研究[J]. 中国农业科学, 2008, 41(11): 36913697.
[23]WAN Hongjian, ZHAO Zhenguo, QIAN Chuntao, et al. Selection of appropriate reference genes for gene expression studies by quantitative real-time polymerase chain reaction in cucumber [J]. Analytical Biochemistry, 2010, 399(2): 257261.
[24]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method [J]. Methods, 2002, 25(4): 402408.
[25]WEI Zhongmin, LABY R J, ZUMOFF C H, et al. Harpin, elicitor of the hypersensitive response produced by the plant pathogen Erwinia amylovora [J]. Science, 1992, 257(5066): 8588.
[26]武孟祥, 贾建兵, 张宇, 等. 植物低温保护剂对番茄幼苗抗寒力的影响[J]. 西北植物学报, 1994(5): 9698.
[27]王建华, 刘鸿先, 徐同. 超氧物歧化酶(SOD)在植物逆境和衰老生理中的作用[J]. 植物生理学通讯, 1989(1): 17.
[28]程智慧, 李玉红, 孟焕文, 等. BTH诱导黄瓜幼苗对霜霉病的抗性与细胞壁HRGP和木质素含量的关系[J]. 中国农业科学, 2006, 39(5): 935940.
[29]王建明, 郭春绒, 张作刚, 等. 西瓜不同品种苗期感染枯萎病菌后的生理生化变化[J]. 中国农业科学, 2002, 35(11): 13431348.
[30]董毅敏, 徐建华, 郭季芳. 抗病和感病黄瓜品种感染白粉病菌后几种酶活性的变化[J]. 植物学报, 1990, 32(2): 160164.
[31]李明巖, 屈淑平, 崔崇士. 利用酶活性鉴定南瓜对白粉病菌抗病性的研究[J]. 东北农业大学学报, 2007, 38(6): 737741.
[32]李惠霞, 王蒂. 马铃薯晚疫病抗性反应种木质素及防御酶的活性变化[J]. 甘肃农业大学学报, 2006, 41(3): 5256.
[33]马伟荣. 青霉菌侵染哈密瓜前后超氧化物歧化酶(SOD)的克隆和表达[D]. 石河子: 石河子大学, 2014.
[34]周晓慧, JOSEPH N W, 李英, 等. 甜瓜蔓枯病抗性与SOD、CAT和POD活性变化的关系[J]. 中国瓜菜, 2007(2): 46.
[35]杨柳, 董浚键, 陈文利. 病原菌Pst DC3000侵染拟南芥导致自噬和光合作用的抑制[J]. 生物物理学报, 2011, 27(6): 517527.
[36]程丹丹, 孙剑萍, 柴源, 等. 光照或黑暗条件下野火病菌侵染对烟草光合机构的影响[J]. 应用生态学报, 2016, 27(8): 26552662.
[37]朱磊, 杨景华, 张明方. 芥菜Rubisco小亚基的基因克隆及其在芜菁花叶病毒侵染后的表达分析[J]. 核农学报, 2011, 25(5): 945950.
[38]SAROWAR S, KIM Y J, KIM E N. Over expression of a pepper basic pathogenesis-related protein 1 gene in tobacco plants enhances resistance to heavy metal and pathogen stresses [J]. Plant Cell Reports, 2005, 24(4): 216224.
(责任编辑:杨明丽)
