江苏省水稻恶苗病菌种群鉴定及抗药性检测
2022-04-04陈宏州周晨庄义庆姚克兵杨红福徐超侯毅平朱凤
陈宏州 周晨 庄义庆 姚克兵 杨红福 徐超 侯毅平 朱凤





摘要 由藤倉赤霉复合种Gibberella fujikuroi species complex引起的恶苗病(rice bakanae disease)是严重危害水稻的种传病害。为探明江苏省水稻恶苗病菌的种群结构及对多菌灵、咪鲜胺和氰烯菌酯的抗药性现状,分别对2019年江苏省13个县(市)和2020年18个县(市)采集的恶苗病植株样本的123株和182株单孢菌株进行了形态学初步鉴定,并基于翻译延伸因子1-α(translation elongation factor 1-α, TEF1-α)序列对其进行了分子鉴定和系统发育分析;采用区分剂量法分别检测了菌株对多菌灵、咪鲜胺和氰烯菌酯的抗药性。结果表明,2019年和2020年收集的菌株均被鉴定为藤仓镰孢Fusarium fujikuroi、 拟轮枝镰孢F.verticillioides、层出镰孢F.proliferatum和新知镰孢F.andiyazi,分别占比为87.80%、4.07%、5.69%、2.44%和90.11%、1.65%、2.75%、5.49%;基于TEF1-α序列的系统发育分析,镰孢菌可清晰分为4个不同种群,菌株间具遗传多样性。2019年和2020年菌株对多菌灵、咪鲜胺和氰烯菌酯的总抗性频率分别为67.48%、23.58%、9.76%和41.21%、43.96%、29.12%。依据菌株对3种杀菌剂的抗药性表现,可分为7种表现型,其中2019年和2020年对多菌灵、咪鲜胺和氰烯菌酯有抗性的菌株分别占4.07%和1.65%;对多菌灵、咪鲜胺和氰烯菌酯敏感的菌株分别占28.46%和17.58%。江苏省恶苗病菌优势种为藤仓镰孢,病菌对多菌灵和咪鲜胺抗性频率较高,对氰烯菌酯抗性已逐渐扩展。研究结果可为镰孢菌分类鉴定及水稻恶苗病综合防治提供理论依据。
关键词 水稻恶苗病; 镰孢菌; TEF1-α; 系统发育分析; 抗药性
中图分类号: S435.11
文献标识码: A
DOI: 10.16688/j.zwbh.2021581
Abstract Rice bakanae disease (RBD) caused by Gibberella fujikuroi species complex (GFSC) is a serious seed-borne disease of rice (Oryza sativa L.). In order to investigate the population structure and the resistance of the pathogen of RBD to carbendazim, prochloraz and phenamacril in Jiangsu province, 123 and 182 single-spore strains collected from RBD-infected rice plants in 13 and 18 counties (cities) in Jiangsu province in 2019 and 2020 were preliminarily identified by morphology, respectively, and then molecular identification and phylogenetic analysis based on translation elongation factor 1-α (TEF1-α) sequences were conducted, and their resistance to carbendazim, prochloraz and phenamacril was detected by using a distinguishing dosage method. The results showed that the strains collected in 2019 and 2020 were identified as Fusarium fujikuroi, F.verticillioides, F.proliferatum and F.andiyazi, accounting for 87.80%, 4.07%, 5.69%, 2.44% and 90.11%, 1.65%, 2.75%, 5.49%, respectively. Phylogenetic analysis based on TEF1-α sequences showed abundant inter-and intra-specific genetic variations among the strains, which were clearly grouped into four different populations. The total resistance frequency of different strains to carbendazim, prochloraz and phenamacril were 67.48%, 23.58%, 9.76% and 41.21%, 43.96%, 29.12% in 2019 and 2020, respectively. According to the resistance phenotypes of all strains to three fungicides, seven resistance types were identified. In 2019 and 2020, the strains resistant to carbendazim, prochloraz and phenamacril accounted for 4.07% and 1.65%, respectively, and the strains sensitive to carbendazim, prochloraz and phenamacril accounted for 28.46% and 17.58%, respectively. The dominant population of the pathogens of RBD in Jiangsu province was F.fujikuroi. The pathogens of RBD in Jiangsu province had relatively high resistance frequencies to carbendazim and prochloraz, and their resistance to phenamacril was gradually expanding. These results provided a theoretic and scientific basis for Fusarium taxonomy and integrated control of RBD.
Key words rice bakanae disease; Fusarium; translation elongation factor 1-α; phylogenetic analysis; resistance
由藤仓赤霉复合种Gibberella fujikuroi species complex引起的水稻恶苗病(rice bakanae disease)是危害严重的水稻种传病害[1]。该病害于1828年在日本首次被发现[2],现在全球水稻种植区域均有发生[3],可造成水稻减产3.0%~95.4%,甚至完全绝收[4]。此外,还因藤仓赤霉复合种菌株产生伏马毒素等毒素污染而威胁人类和动物健康[5]。
水稻恶苗病病原菌种类鉴定对稻种带菌率检测、病害药剂防治、抗药性治理以及病害综合防治决策制定等方面均有重要意义。相关研究表明,水稻恶苗病病原包括藤仓赤霉复合种的藤仓镰孢 Fusarium fujikuroi、拟轮枝镰孢 F.verticillioides和层出镰孢 F.proliferatum[69]。近年来,首次在非洲高粱上鉴定出的新知镰孢F.andiyazi[10]也可引起水稻恶苗病[1115]。我国对该菌引起的水稻恶苗病也有相关报道[1415]。藤仓赤霉复合种的种群鉴定已报道了多种方法,如:形态学鉴定、交配型检测、真菌毒素检测、营养体亲和性分类、随机扩增多态DNA(random amplification of polymorphic DNA, RAPD)和扩增片段长度多态性(amplified fragment length polymorphism, AFLP)分析等,但这些方法大多费时费力,甚至不能准确鉴定[16]。翻译延伸因子1-α(translation elongation factor 1-α, TEF1-α)基因的表達及调控具有高度保守性,常应用于研究物种间的亲缘关系;作为分子标记,TEF1-α序列已被广泛用于镰孢菌的种群鉴定,并且在镰孢菌种级水平进行系统发育分析时,TEF1-α序列可以准确地鉴别出镰孢菌种[1718]。
由于缺乏有效的抗病品种,水稻恶苗病的防治仍以化学药剂进行种子处理为主[19]。在我国,自20世纪70年代以来,多菌灵等苯并咪唑类杀菌剂被广泛应用于水稻恶苗病防治,但因病菌产生抗药性其药效大大降低[20]。20世纪80年代,咪唑类杀菌剂,尤其是咪鲜胺,对水稻恶苗病防效优良且与多菌灵无交互抗性,在生产中应用广泛,但随着药效下降,田间病原菌菌株的抗性频率(MIC>3.125 μg/mL)竟高于80%[21]。氰基丙烯酸酯类杀菌剂——氰烯菌酯,由江苏省农药研究所1998年合成,具有极高的选择性和镰孢菌专化性,与多菌灵和咪鲜胺等无交互抗性,对水稻恶苗病防效优良[22]。因肌球蛋白-5点突变而产生的病原抗性,导致浙江省(金华市、绍兴市和嘉兴市)水稻恶苗病菌对氰烯菌酯抗性频率由2017年的18%上升至2018年的47%;氰烯菌酯使用未超过10年,但多个区域水稻恶苗病菌已产生明显抗性并且抗性种群还在迅速扩展[23]。目前,农业农村部农药检定所登记用于水稻恶苗病防治的药剂有将近170个(包括单剂和复配剂)(http:∥www.chinapesticide.org.cn/hysj/index.jhtml),但按制剂有效成分约85%为咪鲜胺、咯菌腈、多菌灵或福美双,制剂有效成分种类较少,水稻恶苗病有效防控及抗性治理的形势仍十分严峻。
为探明江苏省水稻恶苗病菌种群结构以及病菌种群对多菌灵、咪鲜胺和氰烯菌酯抗药性发展现状,笔者对2019年和2020年采自江苏省水稻恶苗病植株样本的123株和182株单孢菌株进行了形态学初步鉴定以及基于TEF1-α序列的分子鉴定和系统发育分析,并采用区分剂量法分别检测了其对多菌灵、咪鲜胺和氰烯菌酯的抗药性,以期为水稻恶苗病菌种群分类鉴定以及药剂防治与抗药性治理提供理论依据。
1 材料与方法
1.1 材料
供试菌株:2019年在江苏省阜宁县等13个县(市),2020年在仪征市等18个县(市)采集水稻恶苗病样品,每田块采1个病样。将病样晾干后,单孢分离获取菌株,纯培养后编号保存备用[19]。
供试药剂:95%多菌灵原药、98%咪鲜胺原药,江苏辉丰生物农业股份有限公司;95%氰烯菌酯原药,江苏省农药研究所股份有限公司。将95%多菌灵原药用适量0.1 mol/L盐酸溶液溶解,其他原药分别用适量丙酮溶解后用无菌水定容至一定体积,并加入5%的吐温80作为乳化剂,各药剂均配制成50 000 μg/mL的母液冷藏备用。
供试培养基:马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g、葡萄糖20 g、琼脂18 g、蒸馏水1 L;PDA液体培养基:PDA培养基中不添加琼脂。
供试试剂盒:Omega真菌DNA提取试剂盒,Omega Bio-Tek公司;R011 PCR扩增试剂盒,宝生物工程(大连)有限公司。
1.2 方法
1.2.1 供试菌株的形态学鉴定
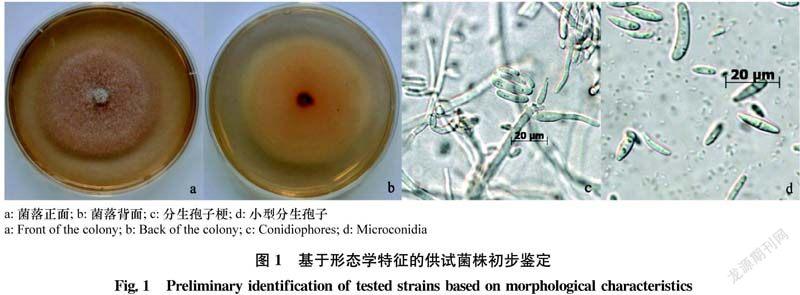
将供试单孢菌株分别移植到PDA平皿上,26℃暗培养并观察菌落大小及菌落正反面颜色变化,大、小型分生孢子和厚垣孢子形状及着生方式、产孢细胞形态特点以及分生孢子座产生情况,并根据镰孢菌的形态特征进行菌株形态学鉴定[15,24]。
1.2.2 供试菌株的分子鉴定与系统发育分析
将形态学鉴定后的单孢菌株分别转移到PDA平皿上,26℃暗培养7 d,收集菌丝并于鼓风干燥箱75℃烘干约12 h,取10~50 mg干燥菌丝磨成粉末后装入1.5 mL 离心管中,按照Omega真菌DNA提取试剂盒说明提取各菌株DNA。采用TEF1-α引物:ef1 (5′-ATGGGTAAGGAAGACAAGAC-3′)和ef2 (5′-GGAAGTACCAGTGATCATGTT-3′)进行PCR[25]。PCR 反应体系(50 μL): 5 μL 10×Taq DNA 聚合酶 PCR buffer,1 μL dNTPs (10 mmol/L),3 μL MgCl2 (25 mmol/L),1 μL 引物 (10 μmol/L), 0.5 μL Taq 聚合酶(5 U/μL),1 μL真菌基因组DNA和 37.5 μL ddH2O。PCR反应程序:94℃预变性2 min;94℃变性1 min,55℃退火1 min,72℃延伸1 min,35个循环;72℃延伸10 min,4℃保存。PCR扩增产物经1.7%琼脂糖凝胶电泳分离并拍照分析条带后,由生工生物工程(上海)股份有限公司进行扩增产物的纯化及双向测序。
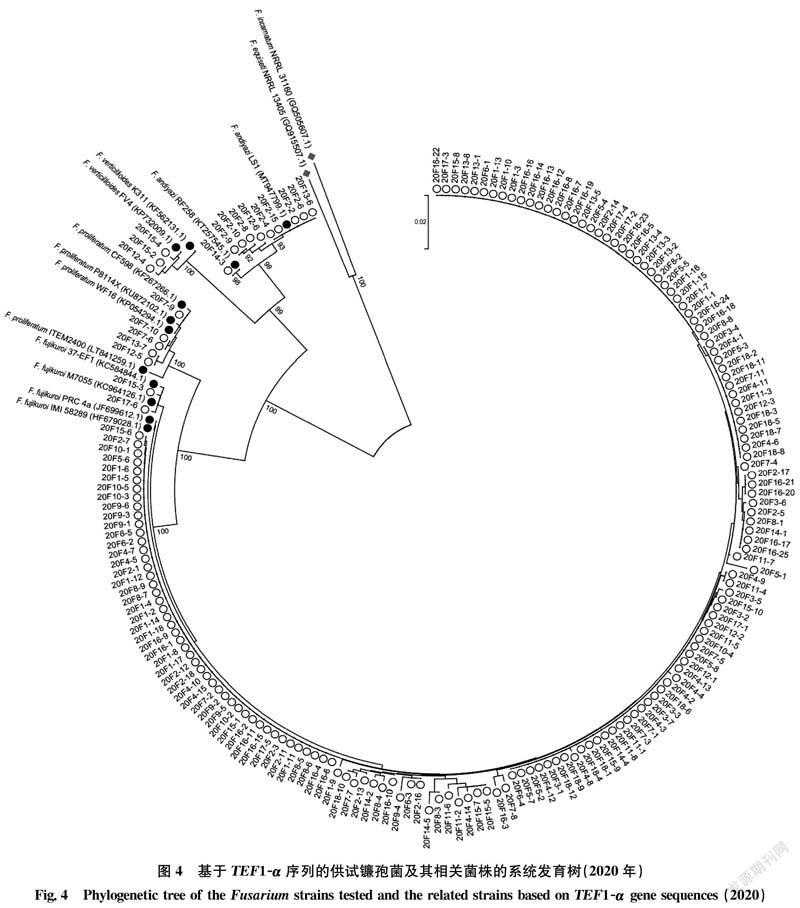
登录NCBI网站(http:∥www.ncbi.nih.gov/index.html)对供试菌株TEF1-α序列进行BLAST比对分析,完成菌株比对鉴定。利用MEGA 5.0软件分别对2019年和2020年供试菌株TEF1-α序列及GenBank下载的藤仓镰孢F.fujikuroi IMI 58289(HF679028.1)、F.fujikuroi PRC4a(JF699612.1)、F.fujikuroi 37-EF1(KC584844.1)、F.fujikuroi M7055(KC964126.1)、层出镰孢F.proliferatum ITEM2400(LT841259.1)、F.proliferatum WF16(KP054294.1)、F.proliferatum P8114X(KU872102.1)、F.proliferatum CF598(KF267266.1)、拟轮枝镰孢F.verticillioides K311(KF562131.1)、F.verticillioides FV4(KP732009.1)、新知镰孢F.andiyazi LS1(MT947799.1)和F.andiyazi RF258(KT257545.1)等12株标准参照菌株TEF1-α序列,以木贼镰孢F.equiseti NRRL 13405(GQ915507.1)和变红镰孢F.incarnatum NRRL 31160(GQ505607.1)为外群,采用邻接法(neighbor-joining, NJ)构建系统发育树[15]。
1.2.3 供试菌株对多菌灵、咪鮮胺和氰烯菌酯的抗药性检测
采用区分剂量法检测菌株对各药剂的抗性。多菌灵、咪鲜胺和氰烯菌酯的鉴别剂量分别设置为10.0、3.0 μg/mL和5.0 μg/mL。配制含药培养基,以不加药剂为对照[26]。将待测菌株分别转移到PDA平皿上,26℃暗培养4 d后取直径为5 mm的菌饼移至各含药和对照平皿中,26℃暗培养3 d,每个处理重复3次。不能或几乎不能在鉴别剂量平皿上生长的为敏感菌株,能生长的为抗性菌株。
2 结果与分析
2.1 供试菌株的形态学鉴定结果
依据水稻恶苗病植株样本上有橘黄色至浅橙色的分生孢子堆,分离菌株在PDA培养基上初为白色然后变成红色或紫红色的菌落、气生菌丝初为白色然后变成浅灰色或浅粉色、小型分生孢子大多在单瓶梗或多瓶梗的分生孢子梗上链状排列等镰孢菌形态特征初步将其鉴定为镰孢菌(图1),2019年从江苏省阜宁县等13个县(市),2020年从仪征市等18个县(市)采集的水稻恶苗病植株样品中各获得123株和182株供试单孢镰孢菌。
2.2 供试菌株的分子鉴定与系统发育分析结果
从2019年的123株
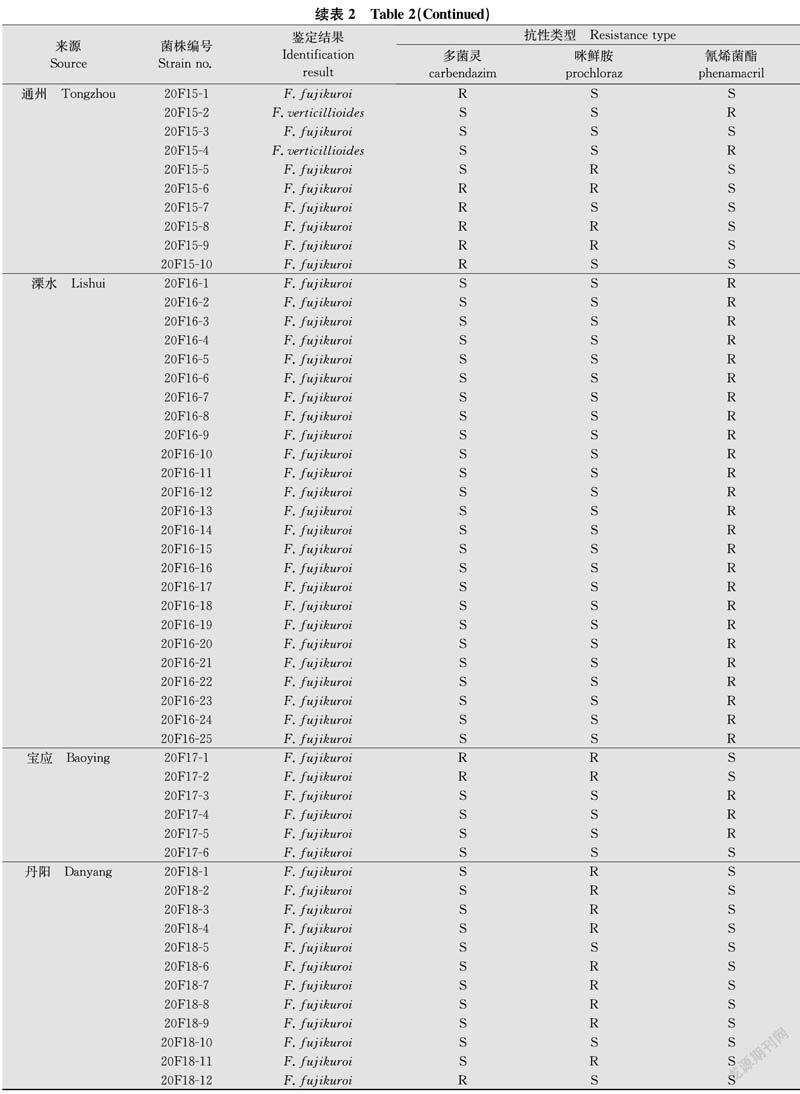
和2020年的182株供试镰孢菌DNA中均扩增出约700 bp TEF1-α片段,不同种间扩增出的片段长度没有明显差异(图2)。将PCR产物纯化及双向测序所得序列提交至GenBank并进行BLAST比对分析得出,2019年和2020年供试菌株均分别为藤仓镰孢F.fujikuroi、 拟轮枝镰孢F.verticillioides、层出镰孢F.proliferatum和新知镰孢F.andiyazi。2019年的123株菌株中,藤仓镰孢占比87.80%(108/123),为优势种群,拟轮枝镰孢占比4.07%(5/123),层出镰孢占比5.69%(7/123),新知镰孢占比2.44%(3/123);2020年的182株菌株中,藤仓镰孢占比90.11%(164/184),也为优势种群,拟轮枝镰孢占比1.65%(3/182),层出镰孢占比2.75%(5/182),新知镰孢占比5.49%(10/182)(表1~2)。
基于2019年(123株)和2020年(182株)供试镰孢菌以及GenBank中12株标准参照菌株的TEF1-α序列并以木贼镰孢F.equiseti NRRL 13405(GQ915507.1)和变红镰孢F.incarnatum NRRL 31160(GQ505607.1)为外群,分别进行了系统发育分析,构建的系统发育树显示供试镰孢菌株具有广泛的遗传多样性,并且这些菌株被清晰地分为4个不同的类群,即藤仓镰孢、层出镰孢、拟轮枝镰孢和新知镰孢(图3~4)。这表明,TEF1-α序列在水稻恶苗病病原镰孢菌种群鉴定中具有较好的效果。
2.3 水稻恶苗病病原菌株对多菌灵、咪鲜胺和氰烯菌酯的抗药性
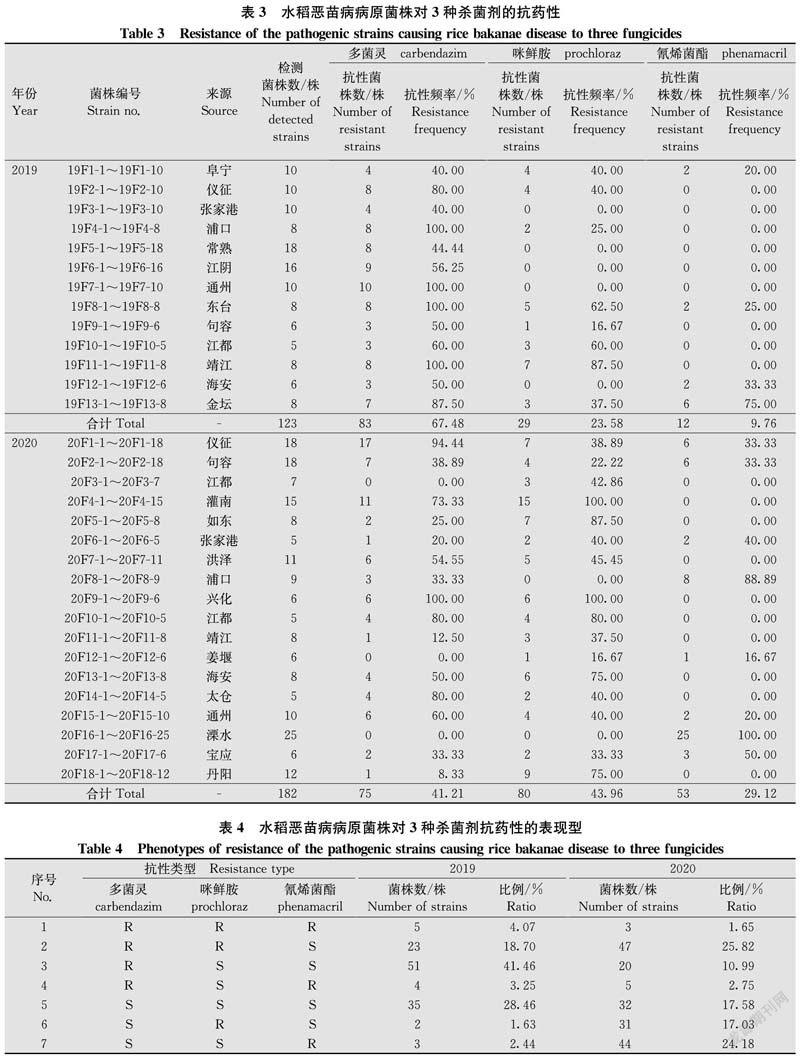
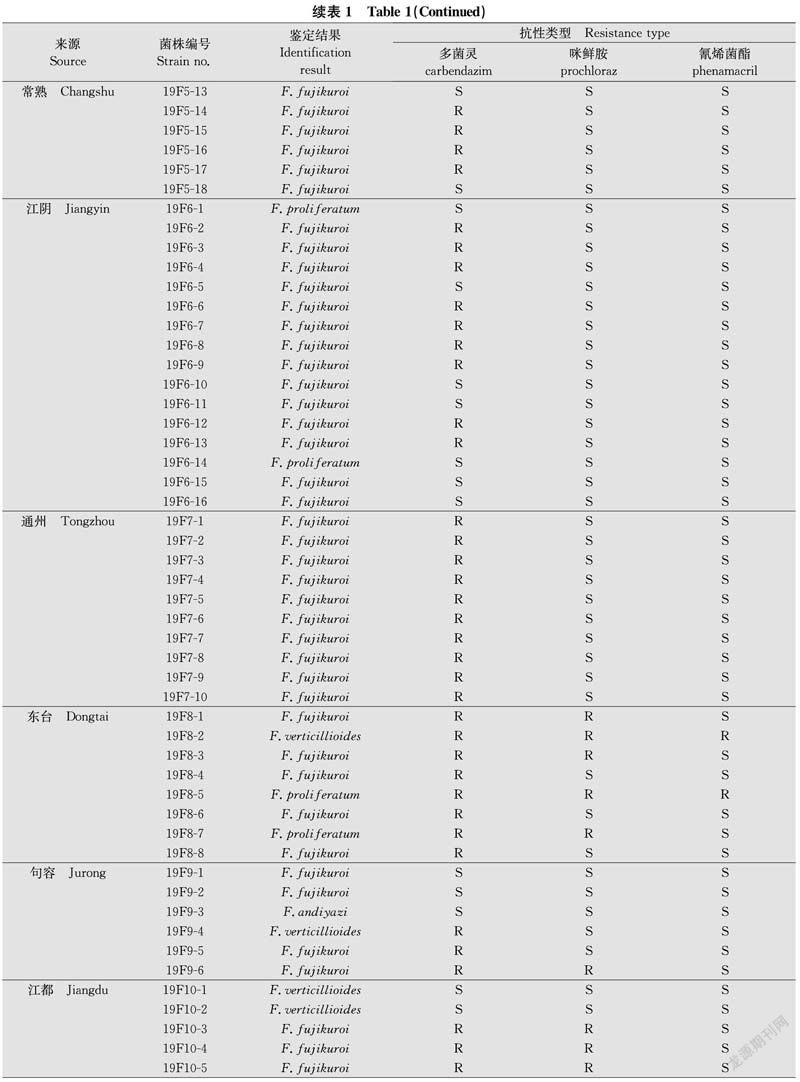
抗药性检测结果得出,2019年采自阜宁县等13个县(市)的123株恶苗病菌株对多菌灵、咪鲜胺和氰烯菌酯的总抗性频率分别为67.48%、23.58%和9.76%,2020年采自仪征市等18个县(市)的182株菌株对多菌灵、咪鲜胺和氰烯菌酯的总抗性频率分别为41.21%、43.96%和29.12%,恶苗病菌株对多菌灵、咪鲜胺和氰烯菌酯的抗性频率在不同地区间差异较大(表1~3)。结果表明,江苏省水稻恶苗病菌对多菌灵和咪鲜胺的抗性频率整体仍较高,局部地区抗氰烯菌酯菌株高发。
2.4 水稻恶苗病病原菌株对多菌灵、咪鲜胺和氰烯菌酯抗药性的表现型
依据菌株对多菌灵、咪鲜胺和氰烯菌酯的抗、感程度,可将2019年的123株菌株和2020年的182株菌株分为7种表现型(表4)。2019年和2020年对多菌灵、咪鲜胺和氰烯菌酯均有抗性的菌株分别占4.07%和1.65%,对多菌灵和咪鲜胺抗药而对氰烯菌酯敏感的菌株分别占18.70%和25.82%,对多菌灵抗药而对咪鲜胺和氰烯菌酯敏感的菌株分别占41.46%和10.99%,对多菌灵和氰烯菌酯抗药而对咪鲜胺敏感的菌株分别占3.25%和2.75%,对多菌灵、咪鲜胺和氰烯菌酯均敏感的菌株分别占28.46%和17.58%,对多菌灵和氰烯菌酯敏感而对咪鲜胺抗药的菌株分别占1.63%和17.03%,对多菌灵和咪鲜胺敏感而对氰烯菌酯抗药的菌株分别占2.44%和24.18%。
3 讨论
我国是全球水稻产销第一大国,其中江苏省水稻年种植面积达220万hm2以上,但对多个区域水稻恶苗病菌种群尤其是病菌种群结构知之甚少。国内对水稻恶苗病菌种群的研究报道中,大多沿用国内外业界均已建议废弃的种名“串珠镰孢F.moniliforme”[2730]。在镰孢菌的鉴定中,通常基于传统形态学特征的鉴定仅作为镰孢菌的预判或菌种鉴定的辅助措施[15],而TEF1-α基因序列是镰孢菌分子鉴定中高效且应用广泛的鉴别基因序列[31]。本研究对采自江苏省不同县(市)水稻恶苗病植株样本的单孢菌株进行基于形态特征的初步鉴定后,基于TEF1-α序列进行分子鉴定与系统发育分析,结果表明TEF1-α序列在水稻恶苗病菌种群分子鉴定及系统发育分析中具有较好效果,同时藤仓镰孢是江苏省水稻恶苗病菌种群中的优势种群,这一研究结果与世界多个研究报道相似[8,12,16,19,32]。
2007年,陈夕军等[33]报道,江苏省水稻恶苗病菌对多菌灵总抗性频率达95.8%,而对咪鲜胺总抗性频率为1.5%,抗性菌株频率低且不够稳定,加之竞争力较弱,病菌对咪鲜胺的田间抗性可能增长缓慢。2013年,杨红福等[34]报道,江苏由于长期单一使用咪鲜胺浸种防治水稻恶苗病,导致水稻恶苗病菌对咪鲜胺总抗性频率达82.14%,抗性菌株成为田间优势种群,并导致田间咪鲜胺对水稻恶苗病丧失防效。据报道,2016年采自江苏省16个县(市)的202株藤仓赤霉菌对多菌灵、咪鲜胺和氰烯菌酯的总抗性频率分别为77.72%、67.33%和0%[26];2018年采自浙江省嘉兴市某些田块的水稻恶苗病菌对氰烯菌酯抗性频率达100%[23]。本研究中,2019年采自江苏省13个县(市)的123株和2020年采自18个县(市)的182株水稻恶苗病菌对多菌灵、咪鲜胺和氰烯菌酯的总抗性频率分别为67.48%、23.58%、9.76%和41.21%、43.96%、29.12%;依据菌株对多菌灵、咪鲜胺和氰烯菌酯的抗、感性程度,可将菌株分为7种表现型,未检测到对多菌灵敏感而对咪鲜胺和氰烯菌酯抗药的菌株。不同年份间,水稻恶苗病菌对多菌灵和咪鲜胺抗性频率有一定波动,这可能是检测样本差异导致的,但田间菌株对多菌灵和咪鲜胺的抗性频率整体仍较高。水稻恶苗病菌对氰烯菌酯抗性从未检测到抗性菌株,发展至总抗性频率达29.12%,2020年采自江苏溧水某些田块菌株对氰烯菌酯抗性频率甚至达100%。可见,江苏省水稻恶苗病菌对氰烯菌酯抗性也已逐渐扩展,并且局部地区对氰烯菌酯抗性高发。鉴于水稻恶苗病菌抗药性发展现状,在江苏省水稻生产中,不宜继续使用多菌灵、咪鲜胺和氰烯菌酯作为主效成分的单剂或复配剂防治水稻恶苗病。
本研究中,由于采集的水稻惡苗病样本偏少,江苏省水稻恶苗病菌种群结构鉴定结果未能完全反映现状,层出镰孢、拟轮枝镰孢和新知镰孢在大田实际危害及病菌种群占比情况还有待进一步研究。在水稻恶苗病防治中,需综合应用选育无病种子、催芽及秧苗期加强栽培管理及调优种子处理药剂与方法相结合的多项防控措施,坚持“预防为主,综合防治”的策略,以保障水稻高产稳产及粮食安全。
参考文献
[1] O’DONNELL K, CIGELNIK E, NIRENBERG H I. Molecular systematics and phylogeography of the Gibberella fujikuroi species complex [J]. Mycologia, 1998, 90(3): 465493.
[2] ITO S, SHIMADA S. On the nature of growth promoting substance excreted by the “bakanae” fungus [J]. Annals of the Phytopathological Society of Japan, 1931, 2(4): 322378.
[3] SINGH R, SUNDER S. Foot rot and bakanae of rice: retrospects and prospects [J]. International Journal of Tropical Plant Diseases, 1997, 15: 153176.
[4] KABILAN G, HARITHA D, CHOUDHURY D. Review on bakanae disease of rice and management [J]. The Pharma Innovation Journal, 2021, 10(5): 12671273.
[5] PROCTOR R H, PLATTNER R D, BROWN D W, et al. Discontinuous distribution of fumonisin biosynthetic genes in the Gibberella fujikuroi species complex [J]. Mycological Research, 2004, 108(7): 815822.
[6] DESJARDINS A E, MANANDHAR H K, PLATTNER R D, et al. Fusarium species from Nepalese rice and production of mycotoxins and gibberellic acid by selected species [J]. Applied and Environmental Microbiology, 2000, 66(3): 10201025.
[7] CARTER L L A, LESLIE J F, WEBSTER R K. Population structure of Fusarium fujikuroi from California rice and water grass [J]. Phytopathology, 2008, 98(9): 992998.
[8] AMATULLI M T, SPADARO D, GULLINO M L, et al. Molecular identification of Fusarium spp.associated with bakanae disease of rice in Italy and assessment of their pathogenicity [J]. Plant Pathology, 2010, 59(5): 839844.
[9] HSUAN H M, SALLEH B, ZAKARIA L. Molecular identification of Fusarium species in Gibberella fujikuroi species complex from rice, sugarcane and maize from peninsular Malaysia [J]. International Journal of Molecular Sciences, 2011, 12(10): 67226732.
[10]MARASAS W F O, RHEEDER J P, LAMPRECHT S C, et al. Fusarium andiyazi sp.nov., a new species from sorghum [J]. Mycologia, 2001, 93(6):12031210.
[11]PR M D, TONTI S, PANCALDI D, et al. First report of Fusarium andiyazi associated with rice bakanae in Italy [J]. Plant Disease, 2010, 94(8): 1070.
[12]WULFF E G, SRENSEN J L, LBECK M, et al. Fusarium spp.associated with rice bakanae: ecology, genetic diversity, pathogenicity and toxigenicity [J]. Environmental Microbiology, 2010, 12(3): 649657.
[13]CHOI H W, HONG S K, LEE Y K, et al. Taxonomy of Fusarium fujikuroi species complex associated with bakanae on rice in Korea [J]. Australasian Plant Pathology, 2018, 47(1): 2334.
[14]戎振洋, 袁詠天, 曾丹丹, 等. 基于环介导等温扩增技术快速诊断由Fusarium andiyazi引起的水稻恶苗病[J]. 植物病理学报, 2018, 48(2): 256262.
[15]陈宏州, 杨红福, 姚克兵, 等. 水稻恶苗病病原菌鉴定及室内药剂毒力测定[J]. 植物保护学报, 2018, 45(6): 13561366.
[16]KIM J H, KANG M R, KIM H K, et al. Population structure of the Gibberella fujikuroi species complex associated with rice and corn in Korea [J]. The Plant Pathology Journal, 2012, 28(4): 357363.
[17]O’DONNELL K, NIRENBERG H I, AOKI T, et al. A multigene phylogeny of the Gibberella fujikuroi species complex: detection of additional phylogenetically distinct species [J]. Mycoscience, 2000, 41(1): 6178.
[18]GEISER D M, JIMNEZ-GASCO M M, KANG S, et al. FUSARIUM-ID v.1.0: a DNA sequence database for identifying Fusarium [J]. European Journal of Plant Pathology, 2004, 110(5/6): 473479.
[19]CHEN Hongzhou, YANG Hongfu, YAO Kebing, et al. Molecular identification of the Gibberella fujikuroi species complex associated with rice bakanae and its management in Jiangsu province, China [J]. International Journal of Agriculture and Biology, 2019, 21(2): 409415.
[20]CHEN Zihao, GAO Tao, LIANG Shuping, et al. Molecular mechanism of resistance of Fusarium fujikuroi to benzimidazole fungicides [J]. FEMS Microbiology Letters, 2014, 357(1): 7784.
[21]CHEN Yu, HUANG Tingting, CHEN Changjun, et al. Sensitivity of Fusarium verticillioides isolates from rice to a novel cyanoacrylate fungicide [J]. Crop Protection, 2012, 39: 106109.
[22]刁亚梅, 倪珏萍, 马亚芳, 等. 创造杀菌剂氰烯菌酯的应用研究[J]. 植物保护, 2007, 33(4): 121123.
[23]WU Jianyan, SUN Yanan, ZHOU Xiaojun, et al. A new mutation genotype of K218T in myosin-5 confers resistance to phenamacril in rice bakanae disease in the field [J]. Plant Disease, 2020, 104(4): 11511157.
[24]LESLIE J F, SUMMERELL B A. The Fusarium laboratory manual [M]. USA: Blackwell Publishing, 2006: 87278.
[25]O’DONNELL K, KISTLER H C, CIGELNIK E, et al. Multiple evolutionary origins of the fungus causing panama disease of banana: concordant evidence from nuclear and mitochondrial gene genealogies [J]. Proceedings of the National Academy of Sciences, 1998, 95(5): 20442049.
[26]陳宏州, 杨红福, 姚克兵, 等. 藤仓赤霉菌的抗药性及对不同杀菌剂敏感性的相关分析[J]. 中国农学通报, 2017, 33(33): 135141.
[27]王拱辰, 陈鸿逵, 徐沛生, 等. 水稻恶苗病病原菌的研究[J]. 植物病理学报, 1990, 20(2): 9397.
[28]罗俊国. 水稻恶苗病致病镰孢种类及菌系研究[J]. 中国水稻科学, 1995, 9(2): 119122.
[29]陈夕军, 卢国新, 童蕴慧, 等. 江苏水稻恶苗病病原菌研究[J]. 扬州大学学报(农业与生命科学版), 2008, 29(3): 8890.
[30]吕国忠, 赵志慧, 孙肖东, 等. 串珠镰孢菌种名的废弃及其与腾仓赤霉复合种的关系[J]. 菌物学报, 2010, 29(1): 143151.
[31]LEYVA-MADRIGAL K Y, LARRALDE-CORONA C P, CALDERN-VZQUEZ C L,et al. Genome distribution and validation of novel microsatellite markers of Fusarium verticillioides and their transferability to other Fusarium species [J]. Journal of Microbiological Methods, 2014, 101: 1823.
[32]MOHD ZAINUDIN N A I, SALLEH B. Variability of Fusarium species associated with bakanae disease of rice based on virulence, vegetative and biological compatibility [J]. Sydowia, 2010, 62(1): 89104.
[33]陈夕军, 卢国新, 童蕴慧, 等. 水稻恶苗病菌对三种浸种剂的抗性及抗药菌株的竞争力[J]. 植物保护学报, 2007, 34(4): 425430.
[34]杨红福, 吉沐祥, 姚克兵, 等. 水稻恶苗病对咪鲜胺的抗性研究及治理[J]. 江西农业学报, 2013, 25(6): 9496.
(责任编辑:杨明丽)
