禾谷镰刀菌甾醇14α脱甲基酶基因cDNA克隆及生物信息学分析
2016-05-03孙晓梅黄金光
孙晓梅+黄金光
摘要: 克隆获得禾谷镰刀菌(Fusarium graminearum)2个甾醇14α脱甲基酶CYP51蛋白(CYP51A、CYP51B)基因cDNA序列,明确其氨基酸序列典型特征,为研究蛋白质结构及其抗药性机制奠定基础。采用RT-PCR技术,克隆2个CYP51蛋白基因cDNA序列,利用相关生物信息软件对其序列进行生物信息学分析。结果克隆到2条cDNA序列,长度分别为1 524、1 581 bp,分别编码507、526个氨基酸;2个蛋白分子量分别为57.5、59.3 ku,等电点分别为693、7.08,不稳定系数分别为49.43、39.05;2个蛋白均含有细胞色素P450家族成员典型的保守结构域;不具有信号肽的属于非分泌性蛋白,具有跨膜结构域,是亲水性蛋白;蛋白质二级结构最主要的结构元件是α螺旋、无规则卷曲,并散布于整个蛋白中;亚细胞定位预测显示,CYP51A蛋白主要位于内质网及高尔基体等细胞器中,而CYP51B主要位于细胞质中。研究结果将为进一步研究CYP51蛋白生物学功能及其蛋白结构生物学提供参考。
关键词: 禾谷镰刀菌;甾醇14α脱甲基酶;基因克隆;抗药性;生物信息学分析;cDNA
中图分类号: S182;Q785 文献标志码: A 文章编号:1002-1302(2016)03-0031-05
小麦赤霉病(fusarium head blight,FHB)是我国小麦生产中最主要的病害之一,由镰刀菌属(Fusarium spp.)多种真菌引起[1]。在全世界范围内,禾谷镰刀菌(Fusarium graminearum)是小麦赤霉病主要的病原菌,在2012年Molecular Plant Pathology上发表的十大病原真菌中,由于其发生的普遍性和重要性,居于第4位[2]。使用杀菌剂是控制赤霉病发生和危害的主要手段,通常用于防治小麦赤霉病的杀菌剂为苯并咪唑类杀菌剂多菌灵[3]。但是长期、单一、大量使用,使其产生了严重的抗药性,造成防效显著下降。因此,明确禾谷镰刀菌对唑类杀菌剂产生抗性机制具有重要的理论、生产实践价值。杀菌剂作用于甾醇生物合成中的14α脱甲基酶(CYP51),CYP51属于细胞色素P450(Cytochrome P450,简称CYP)家族第5类中唯一的一个家族,与P450其他家族相比,CYP51功能非常保守,作用于移除甾醇前体14α位的甲基,又称为甾醇14α脱甲基酶,催化酵母、真菌羊毛甾醇或齿孔醇,植物钝叶醇和哺乳动物二氢羊毛甾醇的14α位脱甲基反应,具有较强的底物特异性[4-6]。病原真菌中含有多个CYP51基因,对唑类药剂产生抗性的病原菌中,CYP51基因点突变是病原菌对唑类杀菌剂产生抗性的主要机制[7-9]。由于唑类杀菌剂中均含有1个含氮杂环,杂环上的氮原子可以与CYP51蛋白血红素-铁活性中心以配位键结合,竞争底物的结合位点,使酶的活性受到抑制。当唑类杀菌剂结合区域的氨基酸位点发生突变后,使药剂与CYP51蛋白的结合能力下降,引起病原菌的抗药性。在人类病原菌白色念珠菌(Candida albicans)点突变研究中已经证实了上述假设,如F145L[10]、Y132H、R467K[11]等突变。迄今为止,CYP51突变引起抗药性报道最多的真菌是C. albicans,其引起抗性的突变位点多达50个。对已报道的突变位点的位置进行分析,大部分突变位点集中在2个区域,分别为CYP51蛋白的N端、C端,这可能与蛋白折叠后的二级结构、三级结构中底物和药剂的结合位点有关[12]。CYP51蛋白N端包括α螺旋B、B′、C及其中间的Loop连接部分,在这个区域的点突变中,尤其以位于α螺旋B′和C之间的1个酪氨酸突变引起的抗性报道最多,包括C. albicans中CYP51的Y132F位点突变[13],以及其他真菌斐济球腔菌(Mycosphaerella fijiensis)、白粉病菌(Blumeria graminis f. sp.)中的Y136F[14-15],禾生球腔菌(Mycosphaerella graminicola)中的Y137F[16],以及叶锈菌(Puccinia triticina)中的Y134F位点突变等[17]。M. graminicola中的Y137F突变使三唑醇不能够再与酶结合,引起抗性的发生[18]。第2个突变区域为 CaCYP51 蛋白氨基酸序列的428~459位或MgCYP51蛋白氨基酸序列的438~463位[19]。MgCYP51中保守位点Y459、G460及Y461的突变或/和缺失都能够引起唑类杀菌剂敏感性下降[20]。可见,CYP51蛋白氨基酸突变使病原菌对药剂产生抗药性。CYP51功能非常保守,但是不同生物中CYP51氨基酸序列的同源性不高,生物界之间其氨基酸的相似性只有 22%~30%;而同一生物界中,其氨基酸序列的同源性较高,在动物、植物、真菌中CYP51的相似性分别为64%、41%、42%[21]。禾谷镰刀菌含有3个CYP51基因FGCYP51A、FGCYP51B、FGCYP51C,这3个基因虽然序列同源性较高,却发挥着不同的功能。Fan等对这3个基因的功能进行了遗传学研究,发现FGCYP51A与FGCYP51B编码甾醇14α脱甲基酶,与病原菌对唑类杀菌剂的敏感性密切相关[22]。
目前,病原真菌中CYP51蛋白三维结构未见报道,且有关CYP51抗药性机制研究集中在基因遗传突变研究。因此,有必要从CYP51的蛋白结构入手研究其抗药性机制。解析蛋白质结构首先要对蛋白质进行分析,构建包含主要功能域的表达载体,进而体外纯化出高质量的目标蛋白,为后续生物学功能及生化功能试验奠定基础。本研究采用RT-PCR技术,克隆2个CYP51蛋白基因cDNA序列,利用生物信息学方法,对禾谷镰刀菌FGCYP51A、FGCYP51B基因编码的蛋白质进行分析,包括氨基酸组成、预测保守结构域、信号肽及跨膜结构域及亚细胞定位等,以期为进一步研究CYP51蛋白晶体结构及其生物学功能奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌种 本试验菌种为禾谷镰刀菌(F. graminearum)PH-1[23]。
1.1.2 主要试剂 总RNA提取试剂(Trizol Reagent)、总反转录酶(M-MLV)、DNase,购自Promega公司;PCR克隆试剂盒TaKaRa RNA PCR Kit、SMARTTMRACE cDNA Amplification Kit、质粒提取试剂盒(TaKaRa MiniBEST Plasmid Purification Kit)、Taq酶、pMD18-T,购自宝生物工程(大连)有限公司。
1.2 试验方法
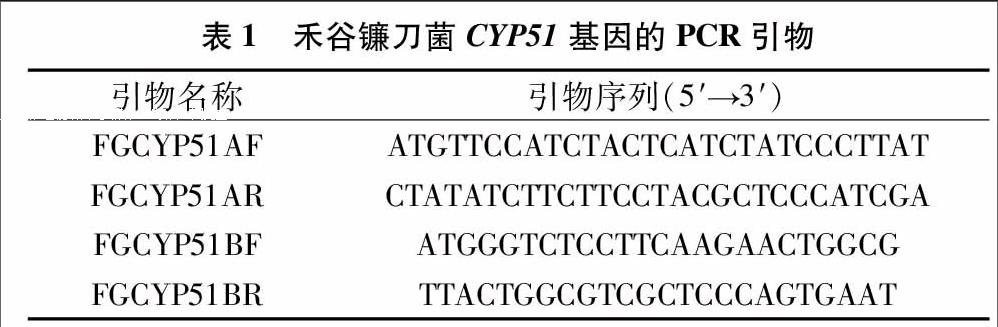
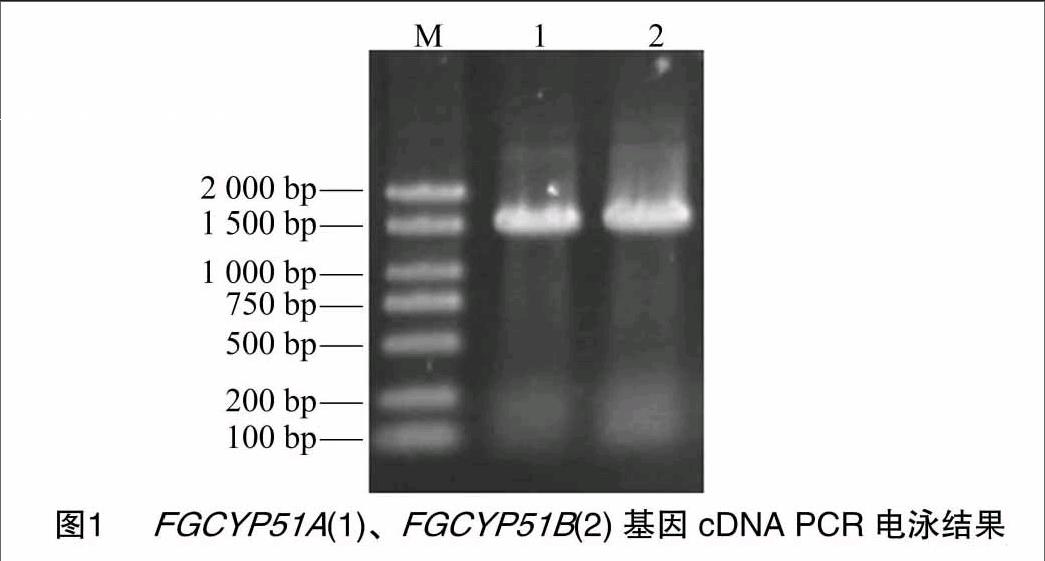
1.2.1 RNA提取和RT-PCR 收集禾谷镰刀菌菌丝体,抽干后置于液氮中速冻并转移,于-80 ℃备用。从液氮中取出冷冻抽干的菌丝约100 mg,置于预冷的研钵中,磨成粉末,并迅加入1 mL Trizol。总RNA抽提步骤按Trizol Reagent说明书进行,所提取的总RNA用2%的琼脂糖电泳检验其分子的完整情况,并用分光光度法检测其浓度。以Oligo(dT)18为引物、1 μg总RNA为模板,按照反转录试剂盒SMARTTMRACE cDNA Amplification Kit操作说明书合成第1链 cDNA。通过国际禾谷镰刀菌网站(http://www.broadinstitute.org/annotation/genome/fusarium_graminearum/MultiHome.html)查找CYP51蛋白2个基因,分别为FGCYP51A、FGCYP51B,根据此序列设计引物(表1),并通过 PCR 克隆2个基因的cDNA片段(图1)。引物序列由上海英骏生物技术有限公司合成。PCR 扩增条件均为:94 ℃预变性3 min;94 ℃30 s,55 ℃ 40 s,72 ℃ 90 s,共35个循环;72 ℃延伸7 min。PCR产物经1.0%琼脂糖电泳检测后,回收目的片段,纯化后克隆至载体pMD18-T,转化感受态细胞E. coli JM109。所筛选的阳性克隆经检测后由上海英骏生物技术有限公司进行测序。
1.2.2 分析方法 利用在线软件protparam(http://web.expasy.org/protparam/)分析CYP51蛋白氨基酸序列[24];用NCBI网站在线软件Conserved Domains(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测保守结构域[25];用在线软件NetPhos(http://www.cbs.dtu.dk/services/NetPhos/)分析磷酸化位点;用protscale(http://web.expasy.org/protscale/)分析氨基酸序列的疏水性/亲水性;利用PSORT Ⅱ(http://psort.hgc.jp/form2.html)进行亚细胞定位的预测;利用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)预 测 信 号肽;利用TMHMM Server v. 2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测跨膜结构域;利用在线软件sopma(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)预测二维结构。
2 结果与分析
2.1 cDNA的克隆及序列分析
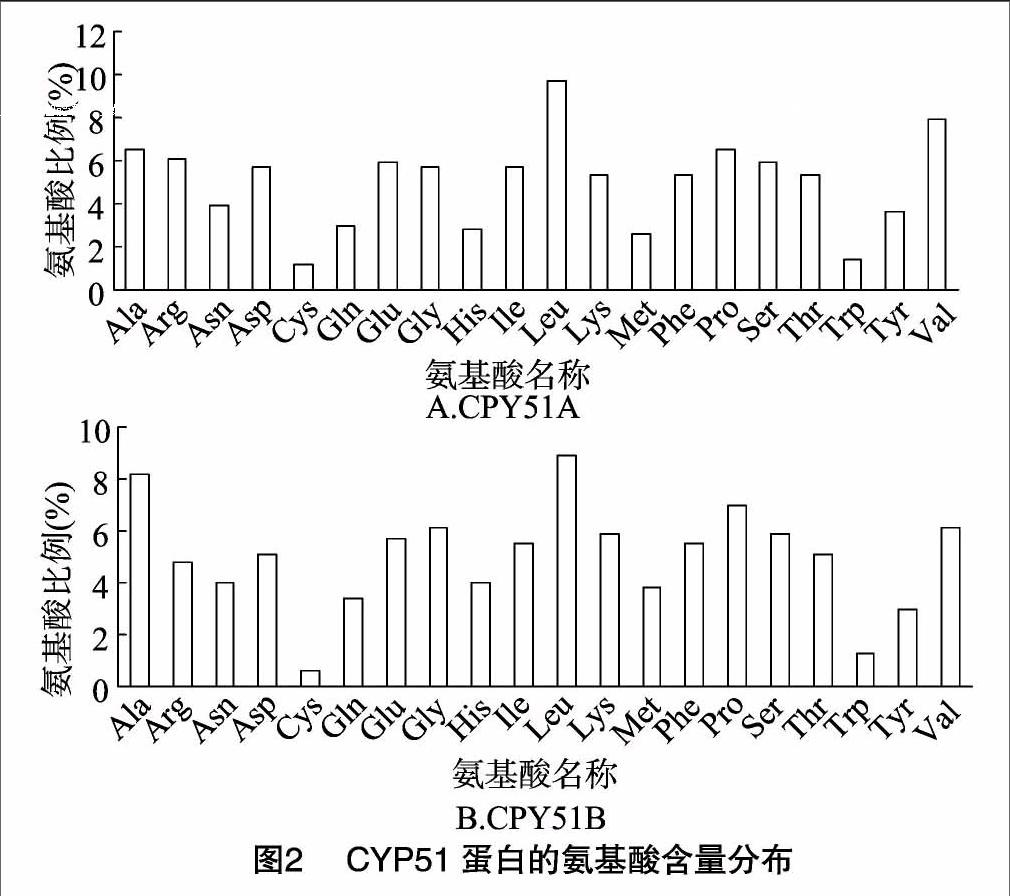
采用RT-PCR方法获得FGCYP51A、FGCYP51B 2个基因,其cDNA序列全长分别为1 524、1 581 bp(图1)。推测其蛋白质分别有507、526个氨基酸残基,通过在线软件 protparam 对禾谷镰刀菌CYP51蛋白理化性质进行分析,CYP51A蛋白的分子式为C2606H4053N697O736S19,总计由8 111个原子组成,分子量约为57 533.2 u,等电点为6.93,不稳定系数为49.43(40以下为稳定蛋白),推测其为不稳定蛋白。该蛋白中亮氨酸、丙氨酸、精氨酸、天冬氨酸、谷氨酸、甘氨酸、缬氨酸、脯氨酸、丝氨酸等含量相对较多,而半胱氨酸、色氨酸含量相对较少(图2-A)。CYP51B蛋白的分子式为 C2680H4144N720O754S23,总计由8 321个原子组成,分子量约为 59 252.1 u,等电点为7.08,不稳定系数为39.05(40以下为稳定蛋白),推测其为稳定蛋白。该蛋白中丙氨酸、谷氨酸、甘氨酸、亮氨酸、赖氨酸、脯氨酸、缬氨酸、丝氨酸等含量相对较多,而半胱氨酸、色氨酸含量相对较少(图2-B)。
2.2 CYP51蛋白保守结构域分析
利用Conserved Domains程序对CYP51蛋白进行结构域分析,从图3可以看出,CYP51A蛋白第36~499位氨基酸和CYP51B蛋白第72~525位氨基酸分别组成了细胞色素P450家族成员典型的保守结构域。
2.3 CYP51蛋白氨基酸序列翻译后的磷酸化修饰
预测细胞内蛋白质磷酸化在信号转导中发挥着重要的作用,研究报道共有3种主要的磷酸化部位——丝氨酸、苏氨酸和酪氨酸结合位点。大多数蛋白质是在丝氨酸、苏氨酸残基上磷酸化,而许多与信号转导有关的蛋白质还在酪氨酸位置上被磷酸化。利用在线软件NetPhos分析可看出,在CYP51A中含有11个丝氨酸磷酸化位点,9个苏氨酸磷酸化位点,13个酪氨酸磷酸化位点(图4-A);在CYP51B中含有14个丝氨酸磷酸化位点,3个苏氨酸磷酸化位点,9个酪氨酸磷酸化位点(图4-B)。CYP51蛋白磷酸化后,改变蛋白质的活性,这种改变可能为激活,也可能是抑制作用。
2.4 CYP51蛋白二级结构预测
多肽链借助氢键排列成沿一维方向而呈现有规则的重复构象的二级结构,是氨基酸顺序与三维构象之间的桥梁。二级结构借助范德华力、氢键、静电和疏水等相互作用形成蛋白质的三级结构,从而发挥正常的生物学功能。利用SOPMA软件对CYP51蛋白的氨基酸序列的二维结构进行预测,由图5可知,CYP51A、CYP51B均含有α螺旋、无规则卷曲、β折叠延伸链、β转角结构,其中α螺旋结构部分较多,分别占37.08%、4125%,其次为无规则卷曲,分别占36.09%、36.50%,β折叠片层结构分别占19.13%、15.40%,最少的是β转角,分别占7.69%、6.84%。可见α螺旋、无规卷曲是CYP51A、CYP51B的最主要二级结构,分布于整条肽链中。
2.5 CYP51蛋白的信号肽和跨膜结构域分析
利用相关软件对CYP51蛋白的信号肽和跨膜域进行预测,由图6-A可知,CYP51A的C值最大切割点在第22个氨基酸位置,分值为0.392,综合剪切点分值(Y值)最高也在第22个氨基酸位置,为0.412,信号肽最大分值(S值)在第2个氨基酸位置,为0.666,因此判断CYP51A没有信号肽,属于非分泌性蛋白。CYP51B的C值最大切割点在第16个氨基酸位置,分值为0.111,综合剪切点分值(Y值)最高在第25个氨基酸位置,为0.131,信号肽最大分值(S值)在第19个氨基酸位置,为0.202,因此判断CYP51B没有信号肽(图6-B),属于非分泌性蛋白。由图6-C可知,CYP51A蛋白30~507位氨基酸在膜外,1~6位氨基酸在膜内,7~29位氨基酸(YPLWVLVALFAVIIANLLYQQLP)组成跨膜结构域。CYP51B蛋白有2个跨膜结构域,分别为20~42位氨基酸(PLGQQVGIGFAVFLVLSVVLNVL)、55~77位氨基酸(MVFHWFPFVGSTITYGMDPPTFF),1~19、78~526位氨基酸在膜外,43~54位氨基酸在膜内(图6-D)。
2.6 CYP51蛋白氨基酸序列疏水性/亲水性分析
蛋白质结构的特征是疏水/亲水间的平衡,了解氨基酸序列疏水性/亲水性对蛋白质的结构和功能预测有一定的作用。用protscale分析CYP51蛋白氨基酸序列的疏水性/亲水性,根据氨基酸分值越高疏水性越强、得分越低亲水性越强的规律,从图7-A可以看出CYP51A在30、60、230、250、410位氨基酸附近分别包含1个亲水头部,亲水性区域超过疏水性区域,属于亲水性蛋白。可以看出CYP51B在80、170、250、270、420、440位氨基酸附近分别包含1个亲水头部,亲水性区域超过疏水性区域,也属于亲水性蛋白(图7-B)。
2.7 CYP51蛋白的亚细胞定位预测
了解蛋白的亚细胞定位可为蛋白功能预测提供基础。利用在线软件PSORT Ⅱ对CYP51蛋白的亚细胞定位进行预测,结果表明,CYP51A蛋白分布在内质网概率为55.6%,高尔基体为33.3%,细胞质膜为11.1%。CYP51B蛋白分布在细胞质中概率为39.1%,细胞核及线粒体均为17.4%,内质网为13.0%,囊泡分泌系统、高尔基体及过氧化物酶体均占4.3%。
3 讨论与结论
CYP51被认为是细胞色素P450超级家族中最古老的家族,存在于几乎所有的生物中,包括动物、植物、酵母、真菌等真核生物以及原生动物和细菌等原核生物,因此推测其在主要的真核生物族群分化之前就已经形成[26-27]。虽然CYP51的功能非常保守,但是不同生物中CYP51氨基酸序列的同源性并不相同。Lepesheva 等对180多个已知的CYP51氨基酸序列,包括原核、真核生物中的CYP51进行比对,结果发现在所有生物中都保守的氨基酸有15个,所有真核生物中都保守的氨基酸有24个[6]。此外,真菌 CYP51 中还含有1个真菌特异性 C端结构域,其中包括1段只在真菌中保守的序列 DF/YGF/YG[19]。因此,以病原真菌的CYP51为靶标而开发的杀真菌剂,对真菌具有特异性。
Becher等对38个子囊菌中的CYP51基因进行分析,其中18个种的真菌中含有1个CYP51基因,15种真菌中包括2个CYP51基因,其他5种真菌中含有3个CYP51基因,其中含有2个及以上CYP51基因的真菌数量在总数的50%以上[28]。真菌CYP51蛋白序列系统进化树分析表明,CYP51分为3支,分别为CYP51A、CYP51B、CYP51C。在所有比对序列中,单一CYP51基因都聚类为CYP51B;而除镰刀菌属之外,含有2个以上CYP51基因的真菌,其CYP51基因聚类为CYP51A或者CYP51B。禾谷镰刀菌(F. graminearum)含有3个CYP51基因FGCYP51A、FGCYP51B、FGCYP51C,它们分别编码507、526、517个氨基酸,蛋白序列间的一致性为6165%。其中FGCYP51A、FGCYP51B基因编码甾醇14α脱甲基酶,与禾谷镰刀菌抗药性产生有关。本研究对这2个蛋白进行了生物信息学分析,CYP51蛋白没有信号肽,具有跨膜结构域,属于亲水性蛋白;二者具有细胞色素P450家族成员典型的保守结构域;具有多个丝氨酸、苏氨酸和酪氨酸的磷酸化修饰位点,可能与其表达的生物学功能相适应;二级结构预测表明,CYP51蛋白以无规卷曲和α螺旋为主,推测与其活性位点形成有关。
本研究克隆了FGCYP51A、FGCYP51B基因的cDNA,为进一步构建蛋白表达载体进行蛋白表达纯化,进而开展蛋白结构生物学研究。利用生物信息学方法预测了CYP51蛋白的理化性质、结构域和亚细胞定位等基本信息,这些结果也为构建不同长度及功能域的表达载体提供了线索,为后期蛋白纯化提供了依据。
参考文献:
[1]张洪滨,柳金伟,刘秉江,等. 山东省小麦赤霉病菌种群组成及其致病力分化[J]. 植物保护学报,2013,40(1):27-32.
[2]Dean R,van Kan J A,Pretorius Z A,et al. The top 10 fungal pathogens in molecular plant pathology[J]. Molecular Plant Pathology,2012,13(4):414-430.
[3]龚双军,杨立军,向礼波,等. 2013年湖北省小麦赤霉病菌对多菌灵和戊唑醇的敏感性[J]. 农药学学报,2014,16(5):610-613.
[4]Alcazar-Fuoli L,Mellado E,Garcia-Effron G,et al. Ergosterol biosynthesis pathway in Aspergillus fumigatus[J]. Steroids,2008,73(3):339-347.
[5]Bean T P,Cools H J,Lucas J A,et al. Sterol content analysis suggests altered eburicol 14α-demethylase (CYP51) activity in isolates of Mycosphaerella graminicola adapted to azole fungicides[J]. FEMS Microbiol Lett,2009,296(2):266-273.
[6]Lepesheva G I,Waterman M R. Sterol 14α-demethylase cytochrome P450(CYP51),a P450 in all biological kingdoms[J]. Biochim Biophys Acta,2007,1770(3):467-477.
[7]Ghosoph J M,Schmidt L S,Margosan D A,et al. Imazalil resistance linked to a unique insertion sequence in the PdCYP51 promoter region of Penicillium digitatum[J]. Postharvest Biology and Technology,2007,44(1):9-18.
[8]Mellado E,Garcia-Effron G,Alcázar-Fuoli L,et al. A new Aspergillus fumigatus resistance mechanism conferring in vitro cross-resistance to azole antifungals involves a combination of cyp51A alterations[J]. Antimicrobial Agents and Chemotherapy,2007,51(6):1897-1904.
[9]Snelders E,van der Lee H A L,Kuijpers J,et al. Emergence of azole resistance in Aspergillus fumigatus and spread of a single resistance mechanism[J]. PLoS Medicine,2008,5(11):e219.
[10]Kudo M,Ohi M,Aoyama Y,et al. Effects of Y132H and F145L substitutions on the activity,azole resistance and spectral properties of Candida albicans sterol 14-demethylase P450 (CYP51):a live example showing the selection of altered P450 through interaction with environmental compounds[J]. Journal of Biochemistry,2005,137(5):625-632.
[11]Park H G,Lee I S,Chun Y J,et al. Heterologous expression and characterization of the sterol 14α-demethylase CYP51F1 from Candida albicans[J]. Archives of Biochemistry and Biophysics,2011,509(1):9-15.
[12]Becher R,Wirsel S G. Fungal cytochrome P450 sterol 14α-demethylase (CYP51) and azole resistance in plant and human pathogens[J]. Applied Microbiology and Biotechnology,2012,95(4):825-840.
[13]Morio F,Loge C,Besse B,et al. Screening for amino acid substitutions in the Candida albicans Erg11 protein of azole-susceptible and azole-resistant clinical isolates:new substitutions and a review of the literature[J]. Diagnostic Microbiology and Infectious Disease,2010,66(4):373-384.
[14]Caas-Gutiérrez G P,Angarita-Velásquez M J,Restrepo-Flórez J M,et al. Analysis of the CYP51 gene and encoded protein in propiconazole-resistant isolates of Mycosphaerella fijiensis[J]. Pest Management Science,2009,65(8):892-899.
[15]Wyand R A,Brown J K. Sequence variation in the CYP51 gene of Blumeria graminis associated with resistance to sterol demethylase inhibiting fungicides[J]. Fungal Genetics and Biology,2005,42(8):726-735.
[16]Leroux P,Walker A S. Multiple mechanisms account for resistance to sterol 14α-demethylation inhibitors in field isolates of Mycosphaerella graminicola[J]. Pest Management Science,2011,67(1):44-59.
[17]Stammler G,Cordero J,Koch A,et al. Role of the Y134F mutation in cyp51 and overexpression of cyp51 in the sensitivity response of Puccinia triticina to epoxiconazole[J]. Crop Protection,2009,28(10):891-897.
[18]Mullins J G L,Parker J E,Cools H J,et al. Molecular modelling of the emergence of azole resistance in Mycosphaerella graminicola[J]. PLoS One,2011,6(6):e20973.
[19]Podust L M,Stojan JPoulos T L,Waterman M R. Substrate recognition sites in 14α-sterol demethylase from comparative analysis of amino acid sequences and X-ray structure of Mycobacterium tuberculosis CYP51[J]. J Inorg Biochem,2001,87(4):227-235.
[20]Cools H J,Fraaije B A. Update on mechanisms of azole resistance in Mycosphaerella graminicola and implications for future control[J]. Pest Management Science,2013,69(2):150-155.
[21]Lepesheva G I,Waterman M R. Structural basis for conservation in the CYP51 family[J]. Biochimica et Biophysica acta,2011,1814(1):88-93.
[22]Fan J,Urban M,Parker J E,et al. Characterization of the sterol 14α-demethylases of Fusarium graminearum identifies a novel genus-specific CYP51 function[J]. The New Phytologist,2013,198(3):821-835.
[23]Cuomo C A,Güldener U,Xu J R,et al. The fusarium graminearum genome reveals a Link between localized polymorphism and pathogen specialization[J]. Science,2007,317(5843):1400-1402.
[24]Gasteiger E,Hoogland C,Gattiker A,et al. The proteomics protocols handbook[M]. Totowa,New Jersey:Humana Press,2005:571-607.
[25]Marchler-Bauer A,Lu S,Anderson J B,et al. CDD:a conserved domain database for the functional annotation of proteins[J]. Nucleic Acids Research,2011,39:D225-D229.
[26]Aoyama Y,Noshiro M,Gotoh O,et al. Sterol 14-demethylase P450 (P45014DM*) is one of the most ancient and conserved P450 species[J]. Journal of Biochemistry,1996,119(5):926-933.
[27]Werck-Reichhart D,Feyereisen R. Cytochromes P450:a success story[J]. Genome Biology,2000,1(6):1-9.
[28]Becher R,Weihmann F,Deising H B,et al. Development of a novel multiplex DNA microarray for Fusarium graminearum and analysis of azole fungicide responses[J]. BMC Genomics,2011,12(1):52.
