苯和甲醛复合污染对室内植物MDA和的影响
2022-03-02鲁敏吴天缘李文月程正渭周智敏
鲁敏吴天缘李文月程正渭周智敏
(1.山东建筑大学 风景园林科学研究中心,山东 济南250101;2.山东建筑大学 艺术学院,山东 济南250101)
0 引言
当今社会已经进入了以“室内化学污染”为标志的第三污染时期[1]。苯和甲醛作为室内化学污染中“三大隐形杀手”之二,同时又是挥发性有机物(Volatile Organic Compounds,VOCs)的重要组成部分,严重威胁着人类的健康和生命安全,受到专家学者的广泛关注[2-3]。苯和甲醛具有挥发周期长、监测难度大、累积效应强等特点,如何快速、高效的监测室内苯和甲醛复合污染是当前研究的难点[4-5]。室内观赏植物对室内化学污染不仅具有安全稳定、持续高效的净化效果,还具有较强的敏感监测能力,已成为目前研究的前沿和热点[6-7]。植物监测是室内苯和甲醛复合污染监测的重要手段,也是构建室内生态环境至关重要的一环。
植物监测即利用敏感植物反映室内污染物质量浓度,当污染胁迫程度超过植物的适应上限,植物会通过其生长状况或外部形态变化表现出不同程度的伤害,根据植物生理生化指标的变化,可以快速、简便地筛选出对室内化学污染敏感的植物[8-9]。研究表明,植物在苯和甲醛污染环境中时,污染物通过叶片上的气孔进入植物体,其体内的多种酶、非酶物质的含量或活性以及植物叶片的结构、性能和植物的多种生命活动如蒸腾、光合、呼吸作用都会产生一系列的变化,而变化的强弱能够体现植物对苯和甲醛的敏感监测能力[10-14]。
细胞内参与酶促或非酶促反应的氧分子,当其只接受一个电子时就会转变为超氧阴离子自由基(Superoxide Anion,O·2-)。 O·2-能歧化或被催化为过氧化氢、羟基自由基、单线态氧等[15-17]。羟基自由基会导致膜脂过氧化,产生一系列自由基和活性氧,正常情况下,植物为了维持体内自由基与活性氧产生和清除的动态平衡,会通过自身的抗氧化保护系统将其转化为活性较低的物质[18-19];而污染胁迫下,产生和清除的代谢系统失调,导致自由基和活性氧在体内大量积累,对植物造成伤害;丙二醛(Malondialdehyde,MDA)是膜脂过氧化的最终分解产物,其含量可以反映植物污染胁迫下的伤害程度[20-21]。植物对污染的抗性强弱是决定其是否能够持续稳定发挥敏感监测能力的基础和前提,测定苯和甲醛复合污染胁迫后植物体内MDA含量和产生速率,是评定植物敏感监测能力的重要依据,植物体内MDA含量和产生速率变化率越大,其敏感监测能力越强。
以往相关研究多集中在苯或甲醛单一污染下室内的吸收净化及抗性能力等方面[22-25],关于苯和甲醛复合污染的研究多集中在植物的吸收净化等方面[26-28],对苯和甲醛复合污染下植物的敏感监测能力研究则少见报道。
研究选取5种室内植物,经熏气实验后,分析苯和甲醛污染胁迫后植物体内MDA含量和产生速率变化,综合评定5种室内植物的敏感监测能力,为今后室内复合污染的植物优选及净化修复等相关研究提供科学依据。
1 材料与方法
1.1 实验材料
以5种常见的室内植物为实验材料,在实验开始前1周送入实验室进行驯化,并且保证实验植物栽培养护基质、花盆材料以及规格保持一致,实验植物生长状况良好。具体植物材料如下:
微型月季(Rosa chinensis minima),属蔷薇科蔷薇属,别名“小月季”。花期较长,对环境适应性强,生长土壤要求不严。微型月季在单一苯和甲醛污染中敏感监测能力表现较强[29]。
猫眼竹芋(Calathea veitchiana)属竹芋科肖竹芋属。在室内阴暗环境可长期生长且装饰美化作用较好。猫眼竹芋在单一苯污染中敏感监测能力表现较强[29]。
彩虹竹芋(Calathea sanderiana)属竹芋科肖竹芋属,别名“大孔雀竹芋”“红背竹芋”。彩虹竹芋叶色美丽且管理较为粗放,因此大型盆栽可用于宾馆、商场等,小型的可放于客厅、卧室。彩虹竹芋在单一甲醛污染中敏感监测能力表现较强[29]。
双线竹芋(Maranta arundinacea),属竹芋科肖竹芋属。双线竹芋株型美观,叶色五彩斑斓,是世界著名观叶植物之一。双线竹芋在单一甲醛污染中敏感监测能力表现较强[29]。
新飞羽竹芋(Calathea roseopicta),属竹芋科竹芋属。新飞羽竹芋叶片清新悦目,株型高雅耐观,常用于装饰客厅、走廊。新飞羽竹芋在单一甲醛污染中敏感监测能力表现较强[29]。
1.2 实验设计
1.2.1 实验设备与环境
实验方法采用模拟舱密闭熏气法[30-31]。准备4个相同的熏气箱(玻璃材质,其厚度为8 mm,边长均为80 cm),分别标记为1~4号,熏气箱除上盖能够移动外,其他部分用玻璃胶密封完全;将熏气箱内的相对湿度控制为60%,温度控制在25℃±0.5℃。为促进苯和甲醛溶液的挥发,在各熏气箱角落里放置一个小型风扇(安装功率80 W、额定电压220 V),以保证4个熏气箱内基本环境一致。
1.2.2 植物处理方法
研究团队前期发现,当苯质量浓度设置为20、40、60 mg/m3时,室内植物MDA含量和产生速率的变化率显著[5];当甲醛质量浓度设置为3、6、9 mg/m3时,室内植物MDA和的变化率也显著。为研究不同质量浓度复合污染胁迫下室内植物MDA含量和产生速率的变化,设立3个苯和甲醛复合污染的质量浓度梯度,分别为N1、N2、N3(见表1),将准备好的实验植物分成4组,在1号熏气箱内放入1盆受试植物但不注入苯和甲醛溶液,作为空白对照组,标号为CK;另取3盆植物分别放入2~4号熏气箱,并注入定量的苯和甲醛溶液,使其舱内质量浓度达到既定要求,随后将熏气箱密封,对植物进行24 h熏气处理,熏气结束后,对实验植物的叶片进行随机采样,测定实验植物的生理生化指标变化,并记录所测得数据,实验重复3次。

表1 实验质量浓度设置表 单位:mg·m-3
1.3 指标测定方法
1.3.1 MDA含量测定
(1)配制0.6%的硫代巴比妥酸(Thiobarbituric Acid,TBA)溶液和5%的三氯乙酸(Trichloroacetic Acid,TCA)溶液备用[32]。
(2)对实验植物叶片进行随机采样,将样品用去离子水冲洗干净后擦干剪碎,取1.0 g叶片放入研钵中研磨,研磨过程中少量多次地加入TCA溶液10 mL,以帮助叶片研磨充分,将研磨后的混合物分别装入离心管,放入离心机离心10 min,并设置转速为4 000 r/min,抽取离心后的上清液。
(3)抽取2 mL离心所得上清液放置于试管中,加入已配好的TBA溶液2 mL,将试管放入水浴锅中水浴至沸腾,再分别转入离心管中,离心15 min,设置转速3 000 r/min。
(4)抽取3 mL上清液放置于比色皿中,读取其在600、532和450 nm的波长下的吸光光度值。
(1)配置足量的pH为7.8的50 mmol/L的磷酸盐缓冲液备用[33]。
(2)随机采取适量的叶片剪碎,称取3份1.0 g的样品研磨,在其过程中分次加入总量10 mL的磷酸盐缓冲液帮助研磨,将研磨后的混合物装入离心管,放入离心机离心10 min,设置离心机转速为5 000 r/min,吸取离心后的上清液。
(3)取4个10 mL的小试管并编号1~4,将1号试管设置为对照组,加入蒸溜水1 mL,2~4号试管作为实验组,各加提取液1 mL;随后分别向4个试管用加入0.1 mL的盐酸羟胺和0.9 mL的磷酸盐缓冲液,摇匀后固定好瓶塞,放入25℃恒温水浴锅水浴60 min。
(4)另取4个10 mL的小试管并编号1~4,分别加入经水浴处理后的溶液1 mL,随后加入对氨基苯磺酸与萘胺各1 mL,摇匀后放入水浴锅,在25℃下水浴20 min后,向试管中加正丁醇3 mL,摇匀并静置直至试管内溶液出现上、下层分离现象,用移液枪抽取上层溶液3 mL,用紫外分光光度计测定其在波长为620 nm下的吸光光度值,依据标准曲线(如图1所示)计算出浓度,进而计算产生速率。
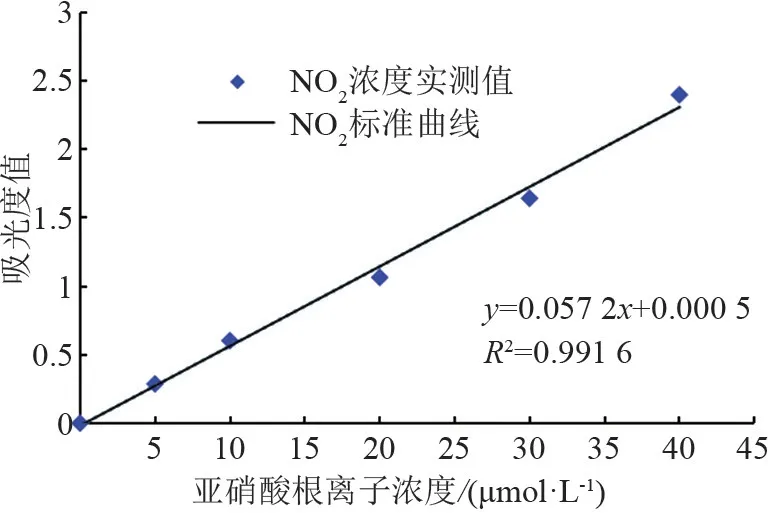
图1 亚硝酸根离子标准曲线图
1.4 统计分析方法
将实验测得的指标数据整理后导入电子表格软件进行计算,并通过统计产品与服务解决方案(Statistical Product and Service Solutions,SPSS)软件对计算后的数据进行方差分析和差异显著性水平为0.05的多重比较(最小显著性差异法),综合评定5种室内植物的敏感监测能力[29]。
2 结果与分析
2.1 MDA含量变化
在3种不同质量浓度苯和甲醛复合污染下,相较于对照组,5种室内植物体内的MDA含量均有不同程度的升高,其具体变化情况见表2。
由表2可知,5种室内植物在3种不同质量浓度苯和甲醛复合污染下,体内MDA含量较对照组均有不同程度升高,并且不同植物体内MDA含量变化率各不相同。将植物体内MDA含量变化率设定为因变量,植物种类与胁迫质量浓度设为固定因素,对5种植物体内MDA含量变化率进行双因素方差分析,分析结果见表3。
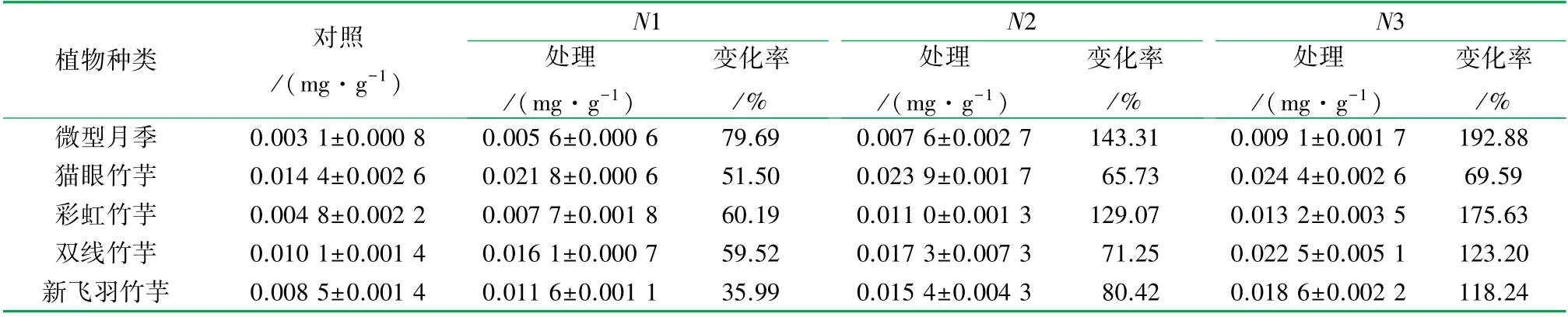
表2 不同质量浓度苯和甲醛复合污染下5种植物MDA含量变化表

表3 不同质量浓度苯和甲醛胁迫下5种室内植物MDA变化率方差分析表
由表3可知,胁迫质量浓度、植物种类以及二者交互作用对实验植物体内MDA含量影响皆达极显著水平,并且胁迫质量浓度的均方比远大于植物种类的均方比(14.476>5.713),表明胁迫质量浓度对植物体内MDA含量变化的影响大于植物种类;MDA变化率数据分析拟合优度R-Sq为66.1%,调整后其值为60.3%。
对3种质量浓度的苯和甲醛复合污染下5种室内植物体内MDA含量变化进行方差分析和多重比较,多重比较结果见表4。
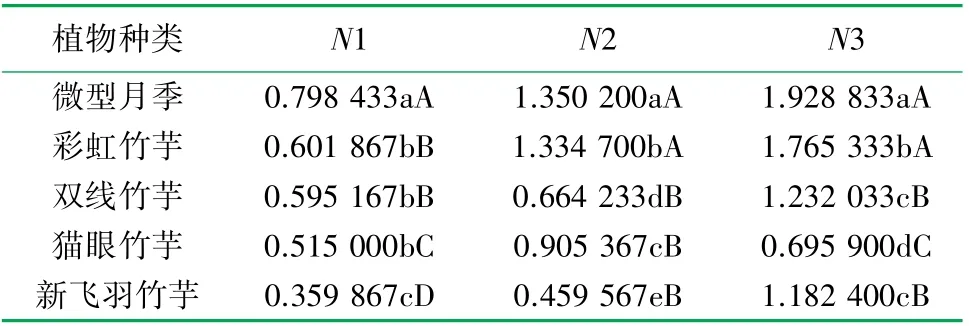
表4 3种质量浓度下5种室内植物MDA变化率多重比较分析表
5种室内植物MDA变化率方差分析显示,N1质量浓度下植物种类F值为2.370,N2质量浓度下植物种类F值为1.713,N3质量浓度下植物种类F值为4.015,表明3种质量浓度苯和甲醛复合污染下,植物种类对5种室内植物体内MDA含量变化影响均达极显著水平。
2.1.1N1质量浓度苯和甲醛复合污染下5种室内植物体内MDA含量变化
由表4可知,在N1质量浓度苯和甲醛复合污染下,微型月季体内MDA含量变化率与新飞羽竹芋、猫眼竹芋、双线竹芋、彩虹竹芋之间的差异皆达极显著水平;彩虹竹芋体内MDA含量变化率与新飞羽竹芋之间的差异达极显著水平,与猫眼竹芋之间的差异达显著水平,与双线竹芋之间差异不显著;双线竹芋体内MDA含量变化率与新飞羽竹芋之间的差异达极显著水平,与猫眼竹芋之间的差异达显著水平;猫眼竹芋体内MDA含量变化率与新飞羽竹芋之间的差异达极显著水平。
在N1质量浓度苯和甲醛复合污染下,5种实验植物体内MDA含量变化相较于对照组皆有所上升。微型月季体内MDA含量变化率最大,其值为79.84%,表明在N1质量浓度苯和甲醛复合污染下其敏感监测能力最强;其次为彩虹竹芋,其变化率为60.18%,敏感监测能力较强;新飞羽竹芋体内MDA含量变化率最小,其值为35.98%,表明在N1质量浓度苯和甲醛复合污染下其敏感监测能力最弱。
通过分析N1质量浓度苯和甲醛复合污染下5种室内植物体内MDA含量变化率可知,5种室内植物对苯和甲醛复合污染的敏感监测能力为微型月季>彩虹竹芋>双线竹芋>猫眼竹芋>新飞羽竹芋。
2.1.2N2质量浓度苯和甲醛复合污染下5种室内植物体内MDA含量变化
由表4可知,在N2质量浓度苯和甲醛复合污染下,微型月季体内MDA含量变化率与新飞羽竹芋、双线竹芋、猫眼竹芋之间的差异皆达极显著水平,与彩虹竹芋之间的差异达显著水平;彩虹竹芋体内MDA含量变化率与新飞羽竹芋、双线竹芋、猫眼竹芋之间的差异达极显著水平;猫眼竹芋体内MDA含量变化率与新飞羽竹芋之间的差异达极显著水平,与双线竹芋之间的差异达显著水平;双线竹芋体内MDA含量变化率与新飞羽竹芋之间的差异达显著水平。
在N2质量浓度苯和甲醛复合污染下,5种室内植物体内MDA含量变化相较于对照组均有所上升。微型月季体内MDA含量的变化率最大,其值为135.02%,表明在N2质量浓度苯和甲醛复合污染下其敏感监测能力最强;其次为彩虹竹芋,其变化率为133.47%,敏感监测能力较强;新飞羽竹芋体内MDA含量变化率最小,其值为45.95%,表明在N2质量浓度苯和甲醛复合污染下,其敏感监测能力最弱。
通过分析N2质量浓度苯和甲醛复合污染下5种室内植物体内MDA含量变化率可知,其对苯和甲醛复合污染的敏感监测能力为微型月季>彩虹竹芋>猫眼竹芋>双线竹芋>新飞羽竹芋。
2.1.3N3质量浓度苯和甲醛复合污染下5种室内植物体内MDA含量变化
由表4可知,在N3质量浓度苯和甲醛复合污染下,微型月季体内MDA含量变化率与猫眼竹芋、新飞羽竹芋、双线竹芋之间的差异皆达极显著水平,与彩虹竹芋之间的差异达显著水平;彩虹竹芋体内MDA含量变化率与猫眼竹芋、新飞羽竹芋、双线竹芋之间的差异达极显著水平;双线竹芋体内MDA含量变化率与猫眼竹芋之间的差异达极显著水平,与新飞羽竹芋之间的差异不显著;新飞羽竹芋体内MDA含量变化率与猫眼竹芋之间的差异达极显著水平。
在N3质量浓度苯和甲醛复合污染下,5种室内植物体内MDA含量变化相较于对照组皆有所上升。微型月季体内MDA含量的变化率最大,其值为192.88%,表明在N3质量浓度苯和甲醛复合污染下其敏感监测能力最强;其次为彩虹竹芋,其变化率为176.53%,敏感监测能力较强;猫眼竹芋体内MDA含量变化率最小,其值为69.59%,表明在N3质量浓度苯和甲醛复合污染下,其敏感监测能力最弱。
通过分析N3质量浓度苯和甲醛复合污染下5种室内植物体内MDA含量变化率可知,其对苯和甲醛复合污染的敏感监测能力为微型月季>彩虹竹芋>双线竹芋>新飞羽竹芋>猫眼竹芋。
综合3种不同质量浓度苯和甲醛复合污染胁迫下5种室内植物体内MDA含量变化率情况,微型月季MDA含量总变化率为407.75%,对苯和甲醛复合污染的敏感监测能力最强;其次彩虹竹芋MDA含量总变化率为370.19%,对苯和甲醛复合污染的敏感监测能力次之,猫眼竹芋MDA含量总变化率为211.63%,对苯和甲醛复合污染的敏感监测能力也较弱;新飞羽竹芋MDA含量总变化率为200.18%,对苯和甲醛复合污染的敏感监测能力最弱。
5种室内植物在3种不同质量浓度的苯和甲醛复合污染下,植物体内的产生速率相较于对照组均有不同程度的上升,其具体变化情况见表5。
表5 不同质量浓度的苯和甲醛复合污染下5种植物产生速率变化表

表5 不同质量浓度的苯和甲醛复合污染下5种植物产生速率变化表
植物种类 对照/(mg·g-1)N1 N2 N3处理/(mg·g-1)变化率/%处理/(mg·g-1)变化率/%处理/(mg·g-1)变化率/%微型月季 0.010 9±0.000 6 0.016 7±0.001 2 53.17 0.021 5±0.001 7 97.49 0.027 1±0.000 4 148.76猫眼竹芋 0.009 9±0.001 1 0.013 2±0.000 4 33.06 0.016 7±0.000 8 68.16 0.021 3±0.002 1 114.63彩虹竹芋 0.008 9±0.000 7 0.014 5±0.000 8 61.95 0.017 2±0.001 1 92.47 0.023 4±0.001 7 161.97双线竹芋 0.009 4±0.000 4 0.016 1±0.000 8 70.67 0.018 4±0.000 6 95.38 0.021 8±0.001 3 131.19新飞羽竹芋 0.003 1±0.001 0 0.004 4±0.000 9 41.94 0.005 7±0.000 9 81.68 0.006 7±0.001 0 114.60
由表5可知,5种室内植物在3种不同质量浓度的苯和甲醛复合污染下,产生速率均有所升高,且不同植物,其产生速率也不同,以植物体内产生速率为因变量,将植物种类与胁迫质量浓度设为固定因素,对5种植物体内产生速率进行双因素方差分析,分析结果见表6。
由表6可知,胁迫质量浓度、植物种类以及二者交互作用对植物体内产生速率影响皆达极显著水平,并且胁迫质量浓度的均方比90.474远大于植物种类的均方比6.794,表明胁迫质量浓度对植物体内产生速率的影响大于植物种类;产生速率数据分析拟合优度R-Sq为87.8%,调整后其值为82.1%。
表6 不同质量浓度苯和甲醛胁迫下5种室内植物产生速率方差分析表

表6 不同质量浓度苯和甲醛胁迫下5种室内植物产生速率方差分析表
来源 自由度 离差平方和SS 均方MS 均方比F胁迫质量浓度 2 5.090 2.545 90.474**植物种类 4 0.764 0.191 6.794**植物×质量浓度 8 0.214 0.027 0.952**误差 30 0.844 0.028校正总计 44 6.912
表7 3种质量浓度下5种室内植物产生速率多重比较分析表
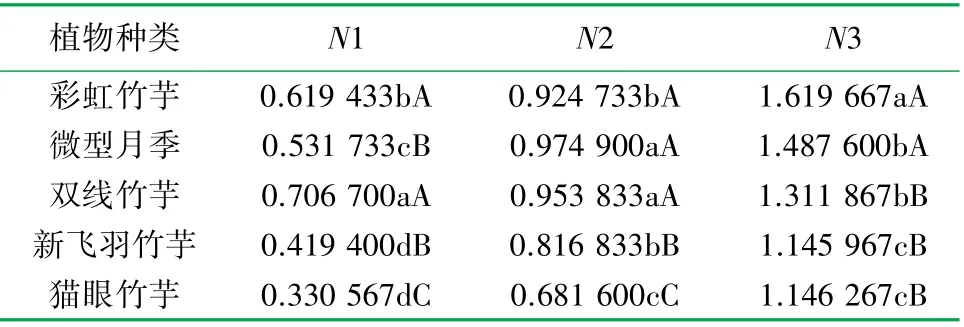
表7 3种质量浓度下5种室内植物产生速率多重比较分析表
植物种类 N1 N2 N3彩虹竹芋 0.619 433bA 0.924 733bA 1.619 667aA微型月季 0.531 733cB 0.974 900aA 1.487 600bA双线竹芋 0.706 700aA 0.953 833aA 1.311 867bB新飞羽竹芋 0.419 400dB 0.816 833bB 1.145 967cB猫眼竹芋 0.330 567dC 0.681 600cC 1.146 267cB
2.2.1N1质量浓度苯和甲醛复合污染下5种室内植物体内产生速率变化
由表7可知,在N1质量浓度苯和甲醛复合胁迫下,双线竹芋产生速率与猫眼竹芋、新飞羽竹芋、微型月季之间的差异达极显著水平,与彩虹竹芋之间的差异达显著水平;彩虹竹芋体内产生速率与猫眼竹芋、新飞羽竹芋之间的差异达极显著水平,与微型月季之间的差异达显著水平;微型月季体内产生速率与猫眼竹芋之间的差异达极显著水平,与新飞羽竹芋之间的差异达显著水平;新飞羽竹芋体内产 生速率与猫眼竹芋之间的差异达显著水平。
在N1质量浓度苯和甲醛复合污染下,5种室内植物体内产生速率相较于对照组皆有所上升。双线竹芋体内产生速率的增幅最大,其值为70.67%,表明在N1质量浓度苯和甲醛复合污染下,其敏感监测能力最强;其次为彩虹竹芋,其变化率为61.94%,敏感监测能力较强;猫眼竹芋体内产生速率增幅最小,其值为33.05%,表明在N1质量浓度苯和甲醛复合污染下其敏感监测能力最弱。
通过分析N1质量浓度苯和甲醛复合污染下5种室内植物体内产生速率可知,其对苯和甲醛复合污染的敏感监测能力为双线竹芋>彩虹竹芋>微型月季>新飞羽竹芋>猫眼竹芋。
2.2.2N2质量浓度苯和甲醛复合污染下5种室内植物体内产生速率变化
由表7可知,在N2质量浓度苯和甲醛复合污染下,微型月季产生速率与猫眼竹芋、新飞羽竹芋之间的差异达极显著水平,与彩虹竹芋之间的差异达显著水平,与双线竹芋之间的差异不显著;双线竹芋体内产生速率与猫眼竹芋、新飞羽竹芋之间的差异达极显著水平,与彩虹竹芋与之间差异显著;彩虹竹芋体内产生速率与猫眼竹芋之间的差异达极显著水平,与新飞羽竹芋之间的差异达显著水平;新飞羽竹芋体内产生速率与猫眼竹芋之间的差异达极显著水平。
在N2质量浓度苯和甲醛复合污染下,5种室内植物体内产生速率相较于对照组均有所上升。微型月季体内产生速率的增幅最大为97.49%,表明在N2质量浓度苯和甲醛复合污染下其敏感监测能力最强;其次为双线竹芋,其变化率为95.38%,敏感监测能力较强;猫眼竹芋体内产生速率增幅最小,其值为68.16%,表明在N2质量浓度的苯和甲醛复合污染下,其敏感监测能力最弱。
通过分析N2质量浓度苯和甲醛复合污染下5种室内植物体内产生速率可知,5种室内植物对苯和甲醛复合污染的敏感监测能力为微型月季>双线竹芋>彩虹竹芋>新飞羽竹芋>猫眼竹芋。
2.2.3N3质量浓度苯和甲醛复合污染下5种室内植物体内产生速率变化
由表7可知,在N3质量浓度苯和甲醛复合污染下,彩虹竹芋体内产生速率与新飞羽竹芋、猫眼竹芋、双线竹芋之间的差异达极显著水平,与微型月季之间的差异达显著水平;微型月季体内产生速率与新飞羽竹芋、猫眼竹芋之间的差异达极显著水平,与双线竹芋之间的差异达显著水平;双线竹芋体内产生速率与新飞羽竹芋、猫眼竹芋之间差异达显著水平;猫眼竹芋体内产生速率与新飞羽竹芋之间的差异不显著。
在N3质量浓度苯和甲醛复合污染下,与对照组相比,5种植物体内产生速率皆有所上升。彩虹竹芋体内产生速率增幅最大,其值为161.96%,表明在N3质量浓度苯和甲醛复合污染下,其敏感监测能力最强;其次为微型月季,其变化率为148.76%,敏感监测能力较强;新飞羽竹芋体内产生速率增幅最小,其值为145.96%,表明在N3质量浓度苯和甲醛复合污染下其敏感监测能力最弱。
通过分析N3质量浓度苯和甲醛复合污染下5种室内植物体内产生速率可知,5种室内植物对苯和甲醛复合污染的敏感监测能力为彩虹竹芋>微型月季>双线竹芋>猫眼竹芋>新飞羽竹芋。
综合3种不同质量浓度的苯和甲醛复合污染胁迫下5种室内植物体内产生速率情况,彩虹竹芋产生速率总变化率为316.38%,对苯和甲醛复合污染的敏感监测能力最强,微型月季产生速率总变化率为299.42%,对苯和甲醛复合污染的敏感监测能力次之;新飞羽竹芋产生速率总变化率为238.22%,对苯和甲醛复合污染的敏感监测能力较弱;猫眼竹芋产生速率总变化率为215.84%,对苯和甲醛复合污染的敏感监测能力最弱。
2.3 5种室内植物敏感监测能力综合评定
综合3种不同质量浓度的苯和甲醛复合污染胁迫下5种室内植物体内MDA含量和产生速率情况,计算其总变化率可知,微型月季总变化率为707.17%,对苯和甲醛复合污染的敏感监测能力最强,彩虹竹芋总变化率为686.57%,对苯和甲醛复合污染的敏感监测能力次之;新飞羽竹芋总变化率为438.40%,对苯和甲醛复合污染的敏感监测能力较弱;猫眼竹芋总变化率为427.47%,对苯和甲醛复合污染的敏感监测能力最弱。5种室内植物敏感监测能力排序为微型月季>彩虹竹芋>双线竹芋>新飞羽竹芋>猫眼竹芋。
3 结论
通过上述研究可知:
(1)根据植物体内MDA含量变化率,微型月季对苯和甲醛复合污染的敏感监测能力最强;其次是彩虹竹芋和猫眼竹芋;最弱的是新飞羽竹芋。
