丁苯酞联合TLR4抗体鼓室给药小鼠梅尼埃病模型的实验研究
2022-02-28张静婧李姝睿王琼刘乃嘉文新
张静婧李姝睿王琼刘乃嘉文新
甘肃中医药大学附属医院(兰州 730000)
梅尼埃病(Meniere’s Disease,MD),由法国医生Prosper Meniere于1861年首次提出并命名。是一种特发性内耳疾病。临床表现为发作性眩晕、波动性听力下降、耳鸣和/或耳胀满感[1]。2020年AAO-HNS学会报道MD患病率为(50-200)/10万,常见于40-60岁[2-4]。病理特征为内淋巴积水(en‐dolymphatic hydrops,ELH)。病因迄今不明,目前公认的发病机制主要有内淋巴管机械阻塞与内淋巴吸收障碍学说、免疫反应学说、内耳缺血学说等[5]。1938年,Hallpike和Cairns[6]首次描述MD患者迷路的典型组织病理学变化,发现ELH与MD有关,通过两例病理切片资料证实球囊和蜗管扩大,前庭和前庭阶的外淋巴间隙消失。此后关于ELH在MD中的重要性逐渐被众多研究者所证实。有学者认为MD是免疫相关性内耳疾病(autoimmune inner ear disease,AIED),这其中涉及多个基因,如群体凝血因子C同源物、水通道蛋白、离子通道蛋白、人类白细胞抗原等。研究发现,内耳并非免疫“豁免"器官,它具有免疫防御系统的解剖学组成和细胞免疫与体液免疫的特性[7-9]。国内外先后报道,在AIED中检测出不同的非内耳组织特异性抗原[10-17],主要有:热休克蛋白,Raf-I蛋白,Po蛋白,D肌动蛋白等,而对热休克蛋白(heat shock proteins,HSP)的研究尤其成为焦点和热点。有文献表明,Toll样受体4(TLR4)可能介导 Hsp70的信号传导,Hsp70是TLR4的内源性配体[18]。本研究拟建立一种内淋巴积水小鼠模型,经鼓室注射TLR4受体阻断剂(TLR4抗体)低、中、高剂量,并联合丁苯酞不同浓度灌胃给药,探讨TLR4抗体、Hsp70与梅尼埃病的关系,阐明TLR4/Hsp70在MD病因学的地位和重要性,进一步探讨其可能的发病机制,为MD的临床治疗和预防提供新的治疗策略。
1 资料与方法
1.1 实验动物
选取耳廓反应正常的SPF级雌性BALB/c小鼠50只,体质量16-20g。购自中国农业科学院兰州兽医研究所,于甘肃省中医药大学科研实验动物中心饲养。根据Konishi创立的后颅窝硬膜外入路内淋巴囊阻塞术[19],制备内淋巴积水动物模型。随机分为对照组10只、模型组10只和实验组(A组10只,B组10只,C组10只)。分笼后作适应性喂养1周。
1.2 主要试剂
TLR4抗体(PE anti-human Toll-like receptor 4)购自美国eB ioscience公司,Hsp70蛋白购自晶美公司,鼠抗Hsp70 mAb氟氏完全佐剂(CFA)购自美国Sigma公司。TNF-αELISA试剂盒购自南京建成生物工程研究所。二氨基联苯胺(DAB)显色系列购自北京中山公司。丁苯酞(tylphthalide,NBP),由石药集团恩必普药业有限公司生产,批号:国药准字H20100041,丁苯酞含量98.6%(HPLC法),使用前以0.5%聚山梨酯80为乳化剂配置成乳剂。
1.3 方法
1.3.1 内耳膜迷路积水模型制备
小鼠40只,以盐酸氯胺酮10mg/kg大腿内侧肌肉注射,1%戊巴比妥钠30mg/kg背部皮下注射,全麻后,术野脱毛,1%普鲁卡因2ml切口处注射,安尔碘消毒,动物仰卧位,术耳选右侧,枕颈部旁正中切口,经后颅窝硬膜外径路暴露枕骨横嵴、枕骨上嵴和枕骨髁三个标志,将三者围成区域的枕骨骨质磨薄,可见暗红色乙状窦,继续磨薄颞骨外侧缘,推乙状窦至中线,暴露其后下方内淋巴囊和前庭导水管所在的龛,用金光钻磨除内淋巴囊所在位置,用骨蜡填塞,缝合伤口。术后第3周起予腹腔注射醛固酮(0.1mg/0.1kg.d),连续 5d,3周后诱导出膜迷路积水(MD)小鼠模型。
1.3.2 造模结果
对照组耳蜗前庭膜与基底膜约呈45°角(图1A);模型组耳蜗病理改变主要为耳蜗各回产生不同程度内淋巴积水(图1B);造模3周后前庭膜向前庭阶轻微膨隆(图1C);造模6周后前庭膜明显膨隆(图1D)。造模成功。

图1 A:造模前,正常小鼠耳蜗(4×10);B:造模后,内淋巴积水小鼠耳蜗(4×10);C:造模后3周,耳蜗前庭膜轻度肿胀;D:造模后6周,前庭膜明显肿胀。Fig.1 A:Before modeling,normal mouse cochlea(4×10);B:After modeling,cochlea of mice with endolymphatic hydro‐cephalus(4×10);C:Vestibular membrane was slightly swollen 3w after modeling;D:Vestibular membrane was significantly expanded 6w after modeling.
1.3.3 内耳石蜡切片制作
将小鼠麻醉后快速断头,取出听泡,充分暴露鼓室内壁,经40mg/L多聚甲醛固定在4℃冰箱中24小时以上,5%三氯醋酸脱钙,梯度脱水,浸蜡,包埋,切片,常规HE染色。
1.3.4 动物分组
将小鼠随机分为对照组10只、模型组10只和实验组(A组10只,B组10只,C组10只)。对照组:不予任何处理;模型组:予内耳膜迷路积水造模;实验组在模型组基础上2天后:A组予以鼓室注射TLR4抗体50μg+丁苯酞25mg/kg灌胃干预;B组予以鼓室注射TLR4抗体100μg+丁苯酞100mg/kg灌胃干预;C组予以鼓室注射TLR4抗体200μg+丁苯酞100mg/kg灌胃干预。1次/周,连续4周。
1.3.5 检测指标
1.3.5.1 行为学观察
观察模型组及实验组小鼠在药物干预前后有无逃跑反应,及活动过程中有无步态不稳、头左右晃动等行为。
1.3.5.2 耳蜗电图测试
检测设备为美国Bio-logic公司听觉诱发电位仪,对模型组、实验组药物干预前、4周后、对照组小鼠均行耳蜗电图测试。全麻状态后耳镜检查并清洁双侧外耳道,在安静屏蔽室(噪声小于20dB‐SPL),记录电极置于给声侧鼓膜表面,接地电极置于颅顶,参考电极置于对侧耳后乳突。电极电阻10kΩ,click刺激声,持续时间0.1ms,刺激强度为90dB nHL,每条曲线叠加1000次。记录动作电位(AP)、和电位(SP)及耳蜗微音电位(CM)的振幅,计算SP/AP比值。SP、AP振幅测量方法:从起始基线开始,出现的第一个正波振幅最大值为SP,第二个正波振幅最大值为AP,以μv为单位分别进行测量,-SP/AP≥0.4判为ECoG阳性。
1.3.5.3 耳蜗Hsp70表达
分别随机选取各组小鼠10耳,耳蜗切片作免疫组化染色,经0.3ml/L Methanol-H2O2(甲醇-过氧化氢)液处理,山羊血清封闭;加一抗(鼠抗HSP70 mAb 1:100)37°孵育1h,用普通小鼠IgG(1:100)取代一抗作阴性对照;滴加二抗(生物素化羊抗小鼠IgG即用型)在37℃反应,待30min,加二氨基联苯胺(DAB)显色,常规脱水、中性树胶封片,细胞核及细胞质染色为棕黄色为阳性。在上述各组的切片中,每耳分别随机抽出1张近中轴的切片,做统计学分析.每张切片计数300个螺旋神经节细胞和血管纹细胞,依照阳性细胞百分比判断,阳性<10%(-)、阳性率 10%~25%(+)、阳性率 26%~50%(++)、阳性率>50%(+++)。
1.3.5.4 采用免疫印迹方法检测
MD小鼠模型组及实验组药物干预前后血清中Hsp70水平;用ELISA试剂盒及酶标仪,检测内耳TNF-α和IL-6炎性细胞因子的表达。
1.3.5.5 统计学处理
所有数据输入SPSS10.0统计软件,所有分组均进行正态性检验和方差齐性分析,多个样本均数的比较用单因素方差分析,均数两两比较用Student-New-Keuls-q检验。
2 结果
2.1 小鼠行为改变结果(表1)
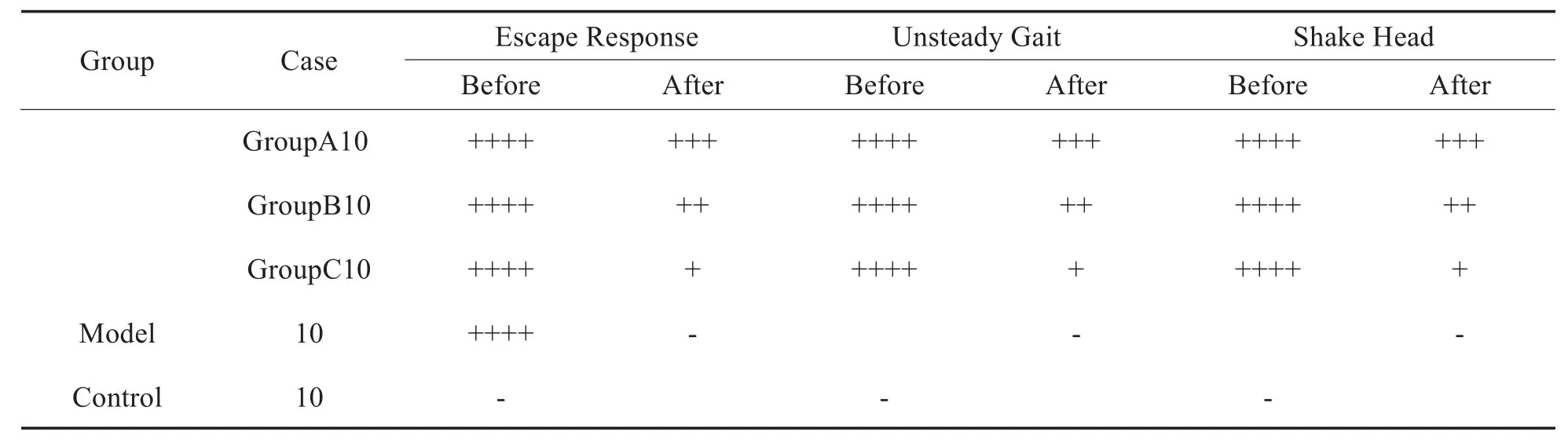
表1 三组小鼠行为改变对比Table 1 Comparison of behavioral changes of Mice in three Groups(n=30)
模型组小鼠诱发了外周前庭症状,表现为明显逃跑反应,步态不稳及头部频繁失衡晃动,符合MD动物造模改变;对照组无明显行为学变化;实验组3个亚组比较可见,经给予TLR4鼓室注射及丁苯酞灌胃干预后,3组小鼠的外周前庭反应都较前减轻,且随鼓室给药剂量及丁苯酞药物浓度提升,前庭反应缓解程度增强。
2.2 耳蜗电图(ECochG)结果
2.2.1 AP反应阈
对照组、模型组及实验组全部小鼠的非手术耳,其AP反应阈均为20dB SPL。模型组中,10只小鼠听阈值升高,其中7只为50dB,2只为60dB,1只达65dB;实验组中,8只小鼠听阈值较模型组降低,其中6只为30dB,2只40dB,1只25dB。
2.2.2 SP及AP振幅
模型组SP振幅明显高于对照组,实验组4周后SP振幅较模型组下降,SP/AP比值也较模型组下降。模型组、实验组与对照组差异均有统计学意义(P<0.05),而模型组与实验组差异无统计学意义(P>0.05)。3组 SP/AP比值分别为0.0665±0.04,0.4169±0.13,0.3271±0.12,耳蜗电图波形(图2A、B、C)。可见内淋巴积水小鼠模型,SP/AP>0.4;随TLR4抗体联合丁苯酞干预4周后,内淋巴水肿及耳蜗毛细胞变性减轻,SP/AP比值回落。

图2 A:对照组;B:模型组;C:实验组(4周后)。Fig.2 A:Control Group;B:Model Group;C:Test Group(after 4w).
2.3 小鼠耳蜗Hsp70表达(表2)
模型组耳蜗螺旋韧带和血管纹呈棕黄色强阳性染色,对照组呈弱阳性染色,两者之间有统计学意义(P<0.01,表2),实验组呈较强阳性染色,与模型组有统计学意义(P<0.05),与对照组无统计学差异(P>0.05)(图3 A、B)。通过三组切片染色对比,可见Hsp70样蛋白主要分布在耳蜗细胞核及胞浆,模型组呈免疫强阳性表达,对照组呈免疫弱阳性表达,表明TLR4/Hsp70信号传导通路在小鼠内淋巴积水模型中发挥调控作用;经鼓室注射TLR4抗体后的实验组,Hsp70的表达减弱,呈较强阳性反应,提示Toll样受体4(TLR4)抗体参与下调Hsp70在梅尼埃小鼠模型中的表达。
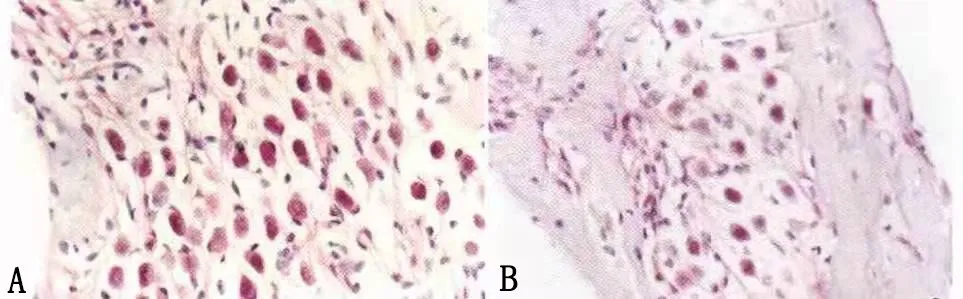
图3 A:模型组螺旋神经节细胞数量明显增加,染色较强;B:实验组耳蜗螺旋神经节细胞数量随脱髓鞘改变而减少,呈强染色(HE染色×200)。Fig.3 A:The number of spiral ganglion cells in the model group increased significantly,showing stronger staining;B:The number of helical ganglion cells in the cochlea of the ex‐perimental group decreased with demyelination changes,showing strong staining(HE staining×200).

表2 各组耳蜗hsp70样蛋白表达情况Table 2 Expression of Hsp70-like protein in cochlea of each group(n=30)
2.4 血清中Hsp70水平
用酶联免疫印迹法检测小鼠血清Hsp70水平,ELISA试剂盒及酶标仪检测小鼠内耳TNF-α和IL-6炎性因子水平(表3)。模型组小鼠血清中Hsp70、TNF-α及IL-6浓度增加,与对照组比较有统计学意义(P<0.05);实验组中三者表达水平较模型组降低,与模型组比较有统计学差异(P<0.05)。且随鼓室给药剂量及丁苯酞药物浓度提升,小鼠血清Hsp70、TNF-α及IL-6表达水平逐渐下降。与对照组比较无统计学意义(P>0.05)。表明TLR4抗体阻断Hsp70在小鼠内耳的传导通路,当TLR4抗体鼓室注射浓度为200μg,联合丁苯酞100mg/kg灌胃给药时,对血清Hsp70表达及减轻炎性因子表达的干预作用最大。
表3 小鼠血清中Hsp70、TNF-α和IL-6的表达Table 3 Expressions of Hsp70,TNF-α and IL-6 in serum of mice(n=30,±s)

表3 小鼠血清中Hsp70、TNF-α和IL-6的表达Table 3 Expressions of Hsp70,TNF-α and IL-6 in serum of mice(n=30,±s)
Group Case images/BZ_24_1226_2673_1278_2745.pngimages/BZ_24_1703_2673_1755_2745.pngTest After(4w)14.28±2.61 8.11±1.72 6.28±1.43 Model Control GroupA10 GroupB10 GroupC10 10 10 Hsp70(ng/ml)Before 16.98±0.78 17.31±0.60 17.01±0.52 17.39±0.66 4.21±0.22 TNF-α(pg/ml)Before 812±12 822±13 830+17 828±20 112±11 After(4w)312±17 201±18 178±17 IL-6(pg/ml)Before 411.4±19.0 392.3±18.1 400.2±15.6 410.4±20.1 106.2±17.3 After(4w)335.4±26.4 236.5±21.4 153.6±21.3
3 讨论
Toll样受体(TLR)是识别病原微生物的关键跨膜蛋白[20],与相应配体结合后通过级联信号传导引起细胞免疫炎症反应[21]。TLR4是人类发现的第一个Toll相关蛋白,能识别受损伤细胞或坏死细胞来源的内源性信号,Hsp70就是其中一类重要的危险信号[22]。有研究表明,TLR4识别、介导Hsp70的信号传导,参与炎症,肿瘤,自身免疫疾病的发病机制,使转录因子NF-кB活化,启动相关靶基因转录,表达炎性细胞因子TNF-α等,介导炎性反应[23]。
热休克蛋白(Hsp)是生物进化最保守的伴随细胞蛋白,具有多种生物学活性,参与抗原提呈加工,协同免疫及自身免疫,与许多自身免疫病发病有关。作为其成员之一的Hsp70,在生物细胞中含量最高,诱导性最强,作为“分子伴侣”参与其他蛋白质的合成与成熟。正常耳蜗组织中,Hsp70主要位于螺旋神经节细胞、血管纹、螺旋缘、Corti器的支持细胞、柱状细胞、外毛细胞中[24]。
鼓室注药理论基础是药物经渗透、扩散作用穿过圆窗膜进入外淋巴,并保持较高药物浓度。从1956年Schuknecht首次介绍鼓室内注入链霉素控制梅尼埃病眩晕症状以来,鼓室灌注治疗以糖皮质激素药物为主。并已证明其为治疗内耳疾病安全有效的方法。但鼓室注射抗体却鲜有报道。
本研究建立一种内淋巴积水小鼠模型,针对TLR4的结构和生物学特点,采用鼓室注射低、中、高三种剂量TLR4抗体,观察其在胞内区与TLR4结合后,小鼠前庭反应明显减轻,在造模成功4周后,SP/AP值>0.4,同时AP阈值升高,提示可作为早期MD内淋巴积水的一个敏感指标。耳蜗切片HE免疫组化染色中,对照组Hsp70在内耳呈低水平表达,模型组表达呈明显增强趋势,可能因为造模内淋巴积水小鼠后,使其产生针对膜迷路的体液和(或)细胞免疫反应,当该反应发展到一定强度,听功能下降,同时选择性激活细胞内的热休克基因,启动Hsp70大量合成。实验组中,施加干扰因素TLR4抗体后,内耳Hsp70蛋白表达降低,TNF-α及IL-6的浓度下降,可能是TLR4抗体与TLR4结合后,抑制了HSP70的信号传导,从而抑制此传导通路的转录因子活化,导致相关炎性因子浓度下降。丁苯酞是当归苯酞类成分之一,目前主要用于治疗缺血性脑卒中[25]。从药理作用分析,它可改善微循环障碍,对内耳的前庭康复起到协同治疗,增强疗效作用。故本实验予小鼠联合丁苯酞灌胃干预,可观察到随TLR4抗体及丁苯酞浓度剂量增加,血清Hsp70及炎性因子水平下降。且增加TLR4鼓室注射浓度至200μg时,干预作用最大。实验证明TLR4/Hsp70通路在MD中发挥重要作用,可能与其发病机制相关。从而为研发新的受体阻断剂,从病因控制梅尼埃病提供新的思考。
