腺相关病毒Anc80L65转染成年小鼠椭圆囊的实验研究
2022-02-28王国鹏贺璐郭婧滢陈钟壡龚树生
王国鹏 贺璐 郭婧滢 陈钟壡 龚树生
首都医科大学附属北京友谊医院耳鼻咽喉头颈外科(100050 北京)
眩晕是临床上常见疾病。研究表明,前庭感觉上皮损伤是引起外周性眩晕的重要原因之一[1]。哺乳动物前庭感觉上皮受到不同程度的损伤可呈现不同的病理变化。轻中度损伤的情况下仅毛细胞受到损伤,支持细胞仍然存活,形成“疤痕结构”。重度损伤后,毛细胞和支持细胞均受损,原有感觉上皮替代为扁平上皮[2,3]。哺乳动物的前庭毛细胞受损后无法完全再生[4],通过基因治疗诱导前庭毛细胞再生为修复前庭感觉上皮损伤带来希望[4-6]。
腺相关病毒(adeno-associated virus,AAV)由于其抗原性低、转染效率高、能够长时稳定表达等特点在内耳基因治疗方面具有独特优势[7]。近年来,随着病毒编辑技术的不断发展,一系列新型AAV病毒被开发用于提高病毒的转染效率或内耳细胞的选择性,并进一步降低免疫原性[8]。Anc80L65是一种新型的人工合成AAV,能够高效转染正常的小鼠内耳毛细胞和支持细胞[9,10],表明Anc80L65是前庭基因治疗的理想载体。但是,国内外尚无Anc80L65转染损伤后前庭感觉上皮的报道。利用理想的病毒载体,介导目的基因在损伤后前庭感觉上皮中残存的支持细胞和/或其他细胞中过表达,从而促使其转化为毛细胞,是诱导毛细胞再生的重要途径。因此,在诱导毛细胞再生之前,很有必要研究该病毒载体在损伤后前庭感觉上皮中的转染特性。Anc80L65是否能成功介导目的基因高效表达于损伤后的前庭感觉上皮,目前尚不明确。
通过局部给药的方式能够使病毒高效的作用于内耳组织同时避免对外周器官的感染,半规管注射已被证实是一种安全有效的内耳给药方式[11,12],能够介导多种血清型的AAV在前庭感觉上皮的高效转染[13,14]。在本研究中,我们将通过半规管注射介导Anc80L65转染正常以及不同损伤程度的小鼠椭圆囊感觉上皮,为前庭毛细胞再生基因治疗的载体选择提供线索。
1 材料与方法
1.1 实验动物及分组
本研究采用4-5周龄FVB/N小鼠,购于北京斯贝福生物技术有限公司,所有实验步骤均通过首都医科大学动物伦理委员会批准。实验动物分为三组,每组动物3-5只,6周龄时行手术,均以左耳为手术耳,实验流程见图1。分组为:1)正常对照组:仅行后半规管注射导入1μL Anc80L65病毒液;2)中度损伤组:水平半规管注射手术导入150μg链霉素(150mg/mL,1μL),术后2周行后半规管注射手术导入1μL Anc80L65病毒液;3)重度损伤组:水平半规管注射手术导入400μg链霉素(400mg/mL,1μL),术后2周行后半规管注射手术导入1μL Anc80L65病毒液。病毒导入后4周取椭圆囊行免疫荧光染色观察病毒转染情况。
1.2 主要材料
硫酸链霉素购买自美国Sigma-Aldrich公司(S9137),溶于生理盐水中,配置成150mg/mL或400mg/mL的链霉素注射液。携带绿色荧光蛋白(green fluorescent protein,GFP)基 因 的 AAV/Anc80L65病毒悬液(Anc80L65-GFP)购买自山东维真生物科技有限公司(AV200001-AV Anc80),滴度为3.24×1012v.g./mL,启动子为巨细胞病毒(CMV)启动子;麻醉药Xylazine和Ketamine分别来自美国Sigma公司(X-1251)和福建古田药业有限公司(H35020148);兔Anti-Myosin VIIa抗体来自美国Proteus Biosciences(25-6790),小鼠Anti-GFP抗体来自美国 Santa Cruz Biotechnology(sc-9996),Alexa Fluor 647 Phalloidin(A22287)和荧光标记的二抗均来自美国Invitrogen。
1.3 半规管注射术[11]
小鼠麻醉后,行左耳后弧形切口,充分暴露半规管。用1mL注射器在半规管上钻一小孔,将微导管插入小孔中,采用微量注射泵控制注射速度为0.5µL/min,导入链霉素溶液或病毒液。用一小块肌肉封闭钻孔处,复位肌肉和皮下软组织,缝合切口。经水平半规管注射术导入链霉素,经后半规管注射术导入Anc80L65病毒液(实验流程见图1)。

图1 实验流程图Fig.1 Experimental flowchart
1.4 内耳标本铺片制作
小鼠麻醉后断头取出听泡,用1mL注射器针尖分别在蜗尖、前庭窗、圆窗处钻孔,4%多聚甲醛固定液从蜗尖小孔灌入耳蜗,然后将颞骨浸入固定液中固定2小时。显微镜下取出椭圆囊组织。
1.5 免疫荧光染色
将标本置于一抗工作液中,4℃下孵育过夜,PBS清洗后加入荧光标记的二抗,室温条件下避光孵育2h,PBS清洗后显微镜下修剪和铺片,然后在激光共聚焦显微镜下观察并拍照。
2 结果
三组椭圆囊取材后免疫荧光染色,GFP标记被转染的细胞,Myosin VIIa标记毛细胞,Phalloidin标记细胞骨架和纤毛,激光共聚焦显微镜下观察。在正常椭圆囊中(图2),Anc80L65-GFP转染后,低倍镜下见GFP广泛分布于椭圆囊前庭感觉上皮,椭圆囊形态大致正常,毛细胞纤毛排列有序;高倍镜下见前庭毛细胞(Myosin VIIa阳性细胞)和支持细胞(Myosin VIIa阴性细胞)均被高效转染。

图2 Anc80L65-GFP在正常椭圆囊的转染情况。(A-A’’’)注射Anc80L65-GFP后1月,低倍镜下见GFP广泛分布于前庭感觉上皮;(B-B’’’)在前庭毛细胞胞体层面,高倍镜下见大量前庭毛细胞(Myosin VIIa阳性细胞)表达GFP(箭头所示)。(A)中标尺代表(A-A’’’):50μm;(B)中标尺代表(B-B’’’):20μm。Fig.2 Transfection of Anc80L65-GFP in normal utricles.(AA''')One month after injection of Anc80L65-GFP,GFP was widely distributed in the vestibular sensory epithelium under low power microscope;(B-B''')At the level of the vestibular hair cell body under high power microscope,a large number of vestibular hair cells(Myosin VIIa positive cells)expressed GFP(indicated by arrows).Scale bars,50μm(A for A-A''')and 20μm(B for B-B’’’).
前庭感觉上皮中度损伤后(图3),前庭毛细胞大量缺失,周围的支持细胞肥大以填充原有毛细胞的位置,但前庭感觉上皮仍基本保存原有的细胞框架;GFP广泛分布表达于残存的前庭毛细胞和支持细胞。
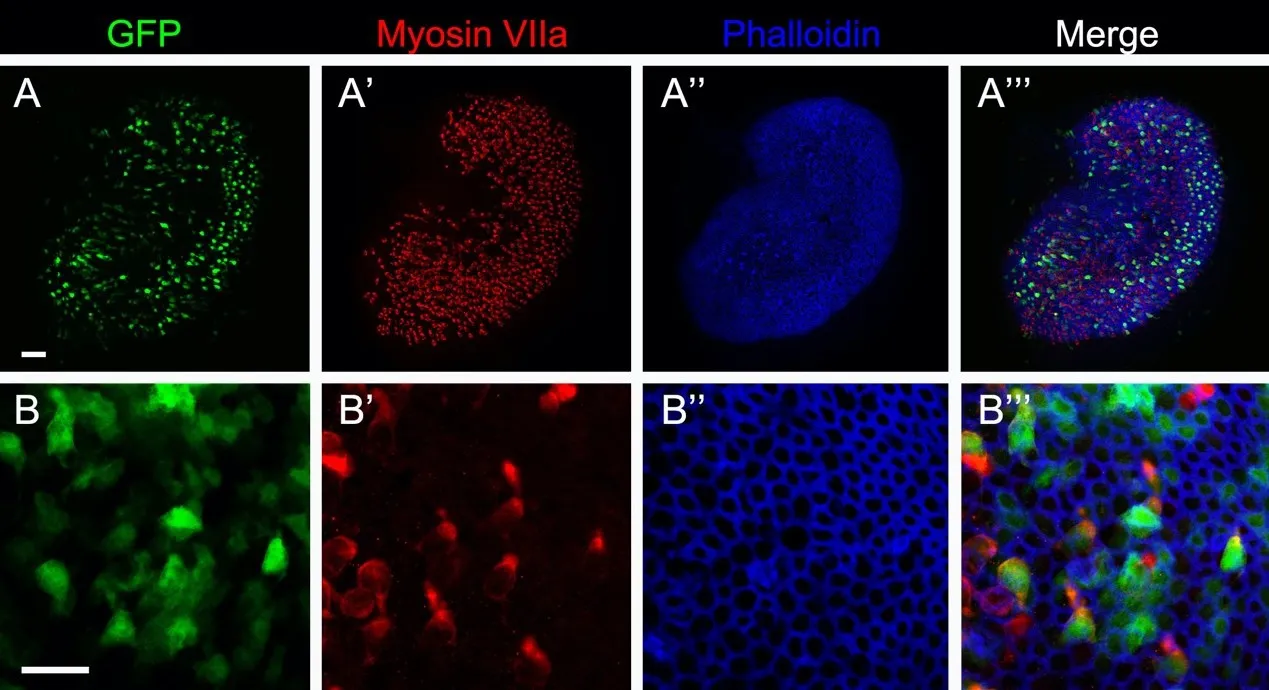
图3 Anc80L65-GFP在中度损伤椭圆囊的转染情况。(AA’’’)注射Anc80L65-GFP后1月,低倍镜下见中度损伤椭圆囊中GFP阳性细胞分布范围与正常椭圆囊相似;(BB’’’)高倍镜下见毛细胞(Myosin VIIa阳性细胞)和支持细胞(Myosin VIIa阴性细胞)均被高效转染。(A)中标尺代表(A-A’’’):50μm;(B)中标尺代表(B-B’’’):20μm。Fig.3 Transfection of Anc80L65-GFP in the moderately dam‐aged utricle.(A-A''')One month after injection of Anc80L65-GFP,the distribution of GFP-positive cells in the moderately damaged utricle was similar to that of normal utricle under low power microscope;(B-B''')Both hair cells(Myosin VIIa positive cells)and supporting cells(Myosin VIIa negative cells)were efficiently transfected under high power micro‐scope.Scale bars,50μm(A for A-A''')and 20μm(B for BB’’’).
前庭感觉上皮重度损伤后(图4),前庭毛细胞几乎完全缺失,支持细胞也受损,前庭感觉上皮失去原有的细胞框架,被大小不一、形态不规则的扁平上皮细胞取代;Anc80L65-GFP转染效率明显降低,仅有少数扁平上皮细胞表达GFP。
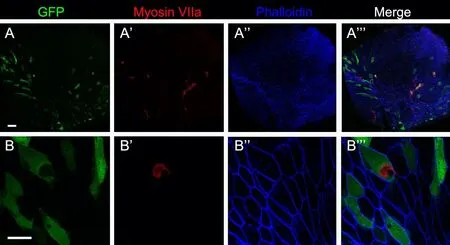
图4 Anc80L65-GFP在重度损伤椭圆囊的转染情况。(AA’’’)注射Anc80L65-GFP后一月,低倍镜下见扁平上皮中GFP阳性细胞数量与正常、中度损伤椭圆囊相比明显减少;(B-B’’’)高倍镜下见少量扁平上皮细胞表达GFP。(A)中标尺代表(A-A’’’):50μm;(B)中标尺代表(B-B’’’):20μm。Fig.4 Transfection of Anc80L65-GFP in the severely dam‐aged utricle.(A-A''')One month after injection of Anc80L65-GFP,the number of GFP-positive cells in the flat epithelium was significantly reduced compared with those in normal and moderately damaged utricles under low power microscope;(B-B''')A small number of flat epithelial cells expressed GFP under high power microscope.Scale bars,50μm(A for A-A''')and 20μm(B for B-B’’’).
3 讨论
近年来随着病毒编辑技术的不断发展,AAV病毒衣壳蛋白基因可以被编辑用于提高病毒的转染效率或内耳细胞的选择性,以及降低在体条件下注射的免疫原性[8],目前已有多种新型AAV载体用于内耳转染并取得了良好的效果[9,15-17]。Anc80L65是一种人工合成的新型AAV,其病毒衣壳蛋白接近AAV的祖先状态。由于其抗原性与传统的AAV不同,可以有效避免传统AAV可能引起的潜在免疫反应[18]。Anc80L65在成年小鼠内耳中可以高效转染耳蜗内外毛细胞、前庭毛细胞和支持细胞[10],通过携带目的基因可以纠正Usher综合症I型的小鼠的听力和前庭功能[19]。
在正常的椭圆囊感觉上皮中,本研究显示Anc80L65可以广泛转染正常前庭毛细胞和支持细胞,但转染效率低于既往文献[9]。造成差异的可能原因包括取材的时间点不同、病毒滴度不同以及病毒生产工艺的差异。目前国内外尚无Anc80L65转染损伤后前庭感觉上皮的报道,我们的研究发现在中度损伤的情况下,Anc80L65能够广泛转染椭圆囊中毛细胞和支持细胞,与正常椭圆囊的情况相似,但在重度损伤的情况下转染效率明显降低。这与8型AAV(AAV8)载体在椭圆囊前庭感觉上皮中的转染特点类似:AAV8能够高效转染正常或中度损伤后的前庭感觉上皮,但对于重度损伤后形成的扁平上皮,AAV8转染效率较低[11,13,20]。这可能是由于在扁平上皮的形成过程中,细胞属性已经发生了显著变化,不同于原有的支持细胞[2,20,21]。细胞属性的改变其一可能影响细胞表面受体的表达,进而影响病毒进入细胞的效率[8]。其二可能影响启动子发挥作用。目前用于内耳基因治疗的AAV病毒载体通常采用CMV或CBA(chicken beta actin)启动子。这两种启动子可以在多数类型的细胞中介导病毒基因组的表达,但在特殊类型的细胞如神经元细胞、肌肉细胞中往往无法介导外源基因高效表达[22]。本研究中Anc80L65病毒采用CMV启动子,扁平上皮细胞性质的变化可能导致其缺乏维持CMV启动子发挥作用的辅因子,进而影响GFP的表达水平。目前已有一些研究采用特异性的启动子来转染内耳组织中特定类型的细胞,如采用以SYN1为启动子的AAV9PHP.B病毒转染螺旋神经节细胞[23]。在未来的研究中可以探索在扁平上皮中采用特殊类型启动子的病毒以提高扁平上皮的转染效率和特异性。
除了Anc80L65,一些新的病毒载体也可尝试用于前庭感觉上皮损伤后的基因治疗研究。通过插入肽段合成的新型内耳AAV(AAV-inner ear,AAV-ie)能够帮助病毒通过膜样结构从而提高转染效率,研究发现AAV-ie在耳蜗中的转染效率高于现有各种血清型的AAV,并且能够在人类前庭终器中实现高效转染[15]。毛细胞的再生需要多基因协同作用,尤其对于扁平上皮[24,25]。在未来扁平上皮的基因治疗研究中,须探索新型AAV载体对其的转染特性,或尝试高装载量且低免疫原性和毒性的载体,如辅助病毒依赖性腺病毒载体,来实现多基因协同调控[26]。
4 结论
Anc80L65能高效转染正常和中度损伤情况下小鼠椭圆囊感觉上皮,但对重度损伤后形成的前庭扁平上皮转染效率较低,这可能与前庭扁平上皮中细胞属性发生改变有关。在未来的前庭基因治疗研究中,须根据前庭感觉上皮的不同损伤程度来选择合适的病毒载体。
