食用菌酶解改性型膳食纤维对人体机能影响研究
2022-02-25杨品臣赵明哲
杨品臣,赵明哲
(1.江苏理工学院,江苏 常州 213000;2.中北大学,太原 030051)
随着人们生活品质的不断提升,食用菌频频出现在人们的餐桌上,所谓的食用菌就是我们日常生活中食用的菌菇类食品。近年来,食用菌养殖规模不断扩大,目前已知的食用菌就已经高达900余种,可进行人工培育养殖的有50种左右[1-2]。大多数的食用菌为担子菌亚门,含有丰富的膳食纤维,根据以往的测定结果可知,在每种食用菌中的总膳食纤维含量均在30%以上。膳食纤维一词最早在20世纪50年代被提出,最初的膳食纤维多指人体器官无法消化吸收的植物细胞壁成分。在20世纪70年代,又有专家学者对其提出了更为精准的定义,将多糖类碳水化合物增加到原有的膳食纤维定义中。随着科技的不断进步,人们对膳食纤维的认识逐渐加深。但直至1985年,联合国粮农组织才将膳食纤维的定义总结为能够通过世界公认的定量测量方法对其含量进行测定的,人体消化道中消化液无法完成水解的植物成分。将此定义与原有的定义联结可将其理解为人体消化系统无法分解的木质素、多糖类以及碳水化合物[3-4]。目前,人们多将植物细胞、多糖以及碳水化合物中不能被人体吸收的部分定义为膳食纤维。
当前,膳食纤维被称为“第七类营养素”[5],在此次研究中,以食用菌酶解改性型膳食纤维作为研究对象,分析其对人体机能的影响效果,为其日后更深入的研究提供了理论基础。
1 材料与方法
1.1 材料来源及制备
在此次研究中,涉及了大量的材料与试剂,见表1。

表1 材料及制剂Table 1 The materials and preparations
在此次制取过程中,需要使用多种设备完成制取过程,为保证制取样本的精度,对此次研究中涉及的设备型号进行设定,具体内容见表2。
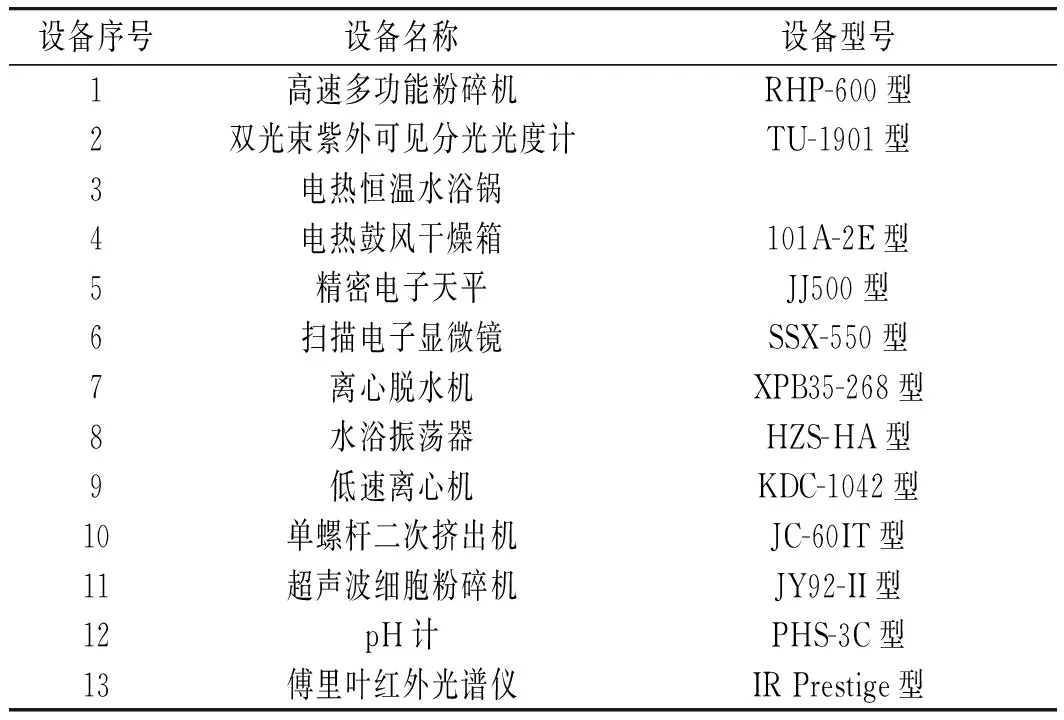
表2 试验设备
使用上述预设的试验设备、材料与试剂,完成食用菌酶解改性型膳食纤维的提取工作。制取过程分为12个环节,具体操作过程如下:首先,分别将预选的干燥原料清理干净,去除其表面附着的杂质。将清理干净的原料静置于35 ℃条件下烘干到恒重,投入粉碎机中分解为多种粒度的粉末。由于此次研究中采用3种不同的食用菌作为原料,样本制取粒度大小设定为不同的数值,提升样本与试剂的结合面积[6]。粉碎后的原料粒度较小,为保证原料的整洁性,避免原料的浪费,将处理后的原料粉放置于干燥的培养皿中备用。设定料液比为1∶30(g/mL),在酶解过程中纤维素酶的添加量设定为0.6%,在此环节的操作中将环境温度设定为40 ℃,提取时间为2 h。在pH取值为5.0的条件下,使用盐酸与氢氧化钠对试验溶液的pH值进行调节,等待材料液体酶解。将酶解后的试验材料溶液放置于100 ℃的水浴锅中加热5 min,使纤维素酶失去活性。
在上述酶解后的样品中注入试验溶液并静置,待其冷却到室温后,使用离心机对其进行离心处理,此时设定设备的转速为3000 r/min,离心时间为10 min。在离心处理后的溶液中注入盐酸与氢氧化钠,调整液体pH值,确保溶液的最终pH值为中性。随后,加入此溶液体积4倍的乙醇,在室温下放置24 h。提取溶液中的沉淀物,使用鼓风干燥箱对其进行烘干处理,并将此设备温度调节为35 ℃,获取风干后的沉淀物,密封处理,备用。为保证样本制取后得到的酶解改性型膳食纤维具有一定的研究价值,对其主要理化性质进行测定,在此部分测定过程将通过下述内容完成。
持水力[7]测定过程:选用50 mL烧杯作为反应器具,称取酶解改性型膳食纤维0.50 g放入其中,随后称取5 mL蒸馏水注入烧杯中。将其与沉淀物充分混合,密封后在室温下放置12 h,使用定量滤纸对0样本进行烘干处理,并将样本移动到表面皿中进行称重,对样本的持水力进行测定,公式如下:
(1)
式中:A表示持水力,a2表示处理称重所得重量,a1表示预先称取膳食纤维重量。通过此公式可得到相应膳食纤维的持水力数据。
结合水力[8]测定过程:选用培养皿作为此环节的反应器具, 称取酶解改性型膳食纤维0.50 g放入其中,在培养皿中注入20 mL蒸馏水,使提取物质与蒸馏水混合均匀,在室温下放置24 h,而后使用定量滤纸对其进行烘干处理,设定离心机速度为3000 r/min,离心处理时长为10 min,对培养皿中液体进行离心处理,获取固态沉淀物,计算其重量,公式如下:
(2)
式中:B表示结合水力,b1表示称取的膳食纤维样品重量,b2表示离心处理后的湿样重量。
膨胀率[9]测定过程:选用10 mL量筒作为反应器具,利用电子天平准确称取0.5 g干燥样本并将15 mL蒸馏水注入量筒中,将样品与蒸馏水混合均匀,放置于室温下等待处理,放置时长设定为5 h。随后读取量筒中物料体积,则测定过程可通过下式表示:
(3)
式中:C表示膨胀率测定结果,V0表示0.5 g干燥恒重样品的体积,V1表示振荡后量筒中物料体积,m表示样本质量。使用上述测定公式对制取后的样本进行测定,确保样本的精度。
1.2 试验方案设计
1.2.1 酶解改性型膳食纤维测定
首先对膳食纤维样本改性后各因素的显著性展开相应的研究,由此试验因素大于4个,使用传统的响应面法分析能力较差,因此,在此次研究中使用Plackett-Barman试验方法[10-11]作为此测定方案蓝本,以膳食纤维得率作为标准,计算各因素的显著性,在此研究过程中设定的因素对照内容见表3。
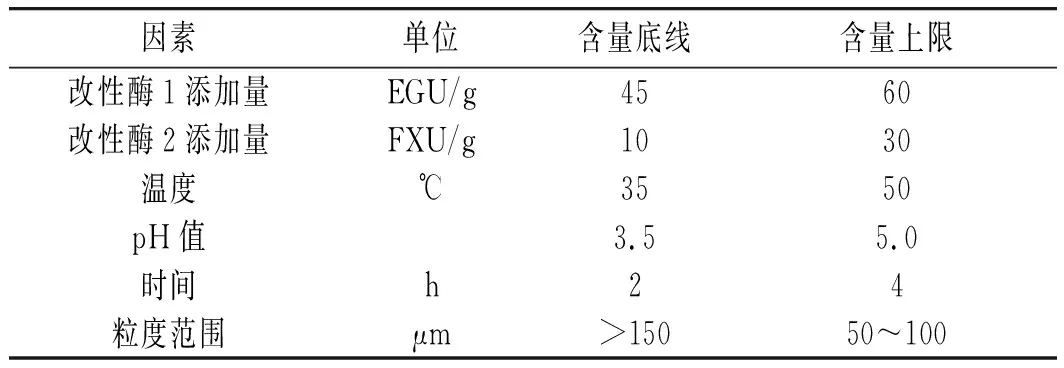
表3 改性试验因素对照表Table 3 The comparison table of modification test factors
以表3中因素对照表作为数据处理依据,以改性后的膳食纤维得率作为指标,设计食用菌酶解改性型膳食纤维性质测定方案。在此次处理过程中,将样本的粒度范围作为一对应概念,采用单一的数据表示。在此部分处理中涉及到大量的数据运算,因此使用Design-Expert V 8.0.6软件[12-13]完成数据处理工作,为保证数据的精确性,对每组数据进行5次重复运算。在此次处理中涉及到的膳食纤维得率可通过下式获取:
D(%)=d1/dall×100%。
(4)
式中:D表示酶解后得到的膳食纤维得率,d1表示干燥试样总量,dall表示总样本重量。
1.2.2 抗胃酸消化能力测定
在此次测试中使用的测定方法根据多种测定方法加以改进后得出,将样本融入蒸馏水中,配制成1~5 mg/mL 5个浓度等级的溶液,并调制成不同的pH值浓度。取0.5 mL样本溶液、2.5 mL 氢氧化钠溶液在试管中充分混合,使用离心机对其进行离心处理,取出试管中上层清液2.5 mL,与2.5 mL去离子水以及乙酸乙酯进行混合,进行37 ℃的水浴,测定pH值、溶液中的还原糖与总糖含量,得到其溶解度,具体计算公式如下:
G(%)=g3/(g1-g2)×100%。
(5)
式中:G表示模拟胃酸试剂下膳食纤维的溶解度,g3表示溶解后的还原糖含量,g1表示溶解前的总糖含量,g2表示最初还原糖含量。
1.2.3 葡萄糖吸收能力测定
以膳食纤维胃酸抗消化能力测定方法作为依据,设计膳食纤维葡萄糖吸收能力测定方法。将150 mL 150 mmol/L的葡萄糖溶液作为测定试剂,并在其中加入1.00 mg的样品,使两者充分溶解。将其放置于室温下,使用搅拌机搅拌5 h,随后使用离心机对其进行离心处理,处理时长设定为20 min。对处理后的上层清液进行葡萄糖测定,在此环节中将降低处理难度,使用手持式折光仪[14-15]完成测定过程,并按照下式对膳食纤维葡萄糖吸收能力进行计算分析。
E(%)=[1-(e1-e2)/e3]×100。
(6)
式中:E表示膳食纤维对葡萄糖的吸收情况,e1表示预设的葡萄糖样本重量,e2表示添加膳食纤维后的葡萄糖重量,e3表示测定反应过程中葡萄糖的对照量。
1.2.4 胆固醇吸收能力测定
使用蛋黄液作为对象,以此测定酶解后膳食纤维对胆固醇的吸收能力。将市售鸡蛋作为样本,分离蛋清与蛋黄,并将蛋黄中融入其体积9倍左右的蒸馏水,使用搅拌机将其混合为乳液状。选用100 mL三角烧杯作为反应器具,加入20 g的蛋黄乳液于烧杯中,并在其中滴入1 mL试剂,将上述液体搅拌至完全融合。调整其pH值,使其与人体消化道环境接近,在37 ℃环境下水浴振荡2 h,将离心机转速设定为3000 r/min,离心时长设定为10 min,完成溶液的离心处理。收集离心管中的上清液,使用邻苯二甲醛法对上清液进行测定,具体测定计算过程设定如下:
F(mg/g)=(f1-f2)/p。
(7)
式中:F表示膳食纤维对胆固醇的吸收能力,f1表示试剂中胆固醇在添加膳食纤维前的含量,f2表示试剂中胆固醇在添加膳食纤维后的含量,p表示膳食纤维样本的质量。
2 结果与分析
2.1 膳食纤维性质测定结果分析
根据上述设定的测定方案,对食用菌的膳食纤维在改性处理后的状态进行分析,此部分结果由电子显微镜获取,具体图像见图1。

(a)膳食纤维表面结构

(b)膳食纤维内部结构
根据预定方案中的酶解改性型膳食纤维测定方案,得到上述显微镜图像。使用电子高倍数显微镜可以发现,由于酶解处理,食用菌膳食纤维的表面结构发生了一定的变化。在酶解过程后,膳食纤维表面结构的层次感明显增强,结构之间的空隙扩大,整体结构由密实走向稀疏。与酶解前图像对比可以看出,酶解处理前样本的膳食纤维结构较为平滑紧致,蜂窝状结构较少。由此可知,酶解处理会对样本的膳食纤维结构造成相应的变化。同时膳食纤维性能研究表明,在酶解改性处理后,样本的内部性能特征均得到了一定的变化,具体变化见表4。
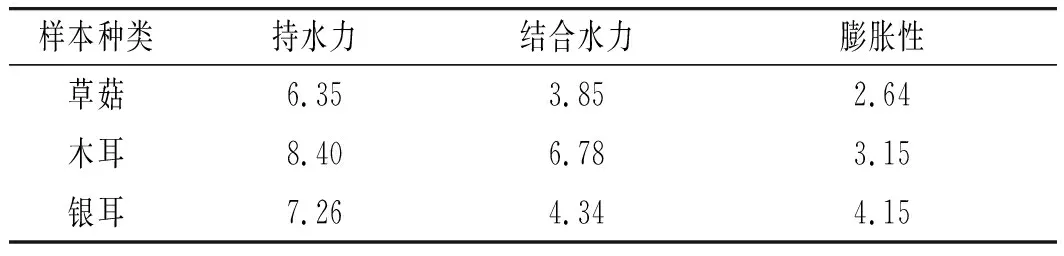
表4 样本性质测定结果Table 4 The determination results of sample properties g/g
在酶解改性处理后,膳食纤维样本的持水力、结合水力以及膨胀力等内部特性得到了显著的提升,通过分析可知,此3种性能的提升与样本结构的变化有关。当膳食纤维表面结构由紧密变得疏松,且生成多毛细孔结构后,膳食纤维的锁水能力得到提升,使膳食纤维的相关性质都得到小幅度提升。
2.2 抗胃酸消化能力测定结果分析
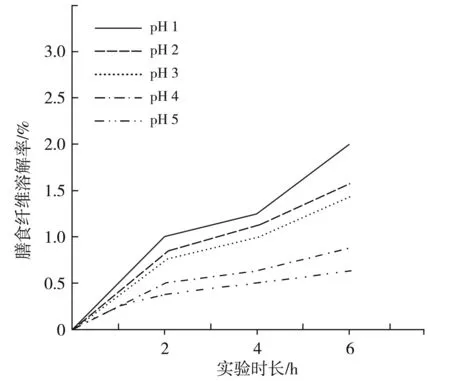
图2 膳食纤维在模拟胃液中的溶解度Fig.2 The solubility of dietary fiber in simulated gastric fluid
由于人体的胃液中多为酸性,人在进食后,食物可在胃部保存4~6 h,为此,在此测定过程中模拟了胃液环境,通过变换模拟液中pH值的浓度,对膳食纤维的消化情况加以分析。由图2可知,在不同的胃液pH浓度下,延长反应时长,膳食纤维的消化走向基本一致,都是随着试剂与样本反应时间的增长,消化能力得到提升。当膳食纤维与模拟液的接触时间为6 h时,膳食纤维的溶液速度下降。当膳食纤维与模拟液的接触时间处于1~6 h之间时,膳食纤维的溶解程度与模拟液的pH值变化有关,两者之间呈现出正比例函数关系。但不论模拟液的pH值如何变动,膳食纤维的溶解率均未超过4%。由此可见,酶解后的膳食纤维在胃液中具有较高的稳定性,能够经过胃部的消化抵达肠道发挥应有的作用。
2.3 葡萄糖吸收能力测定结果分析
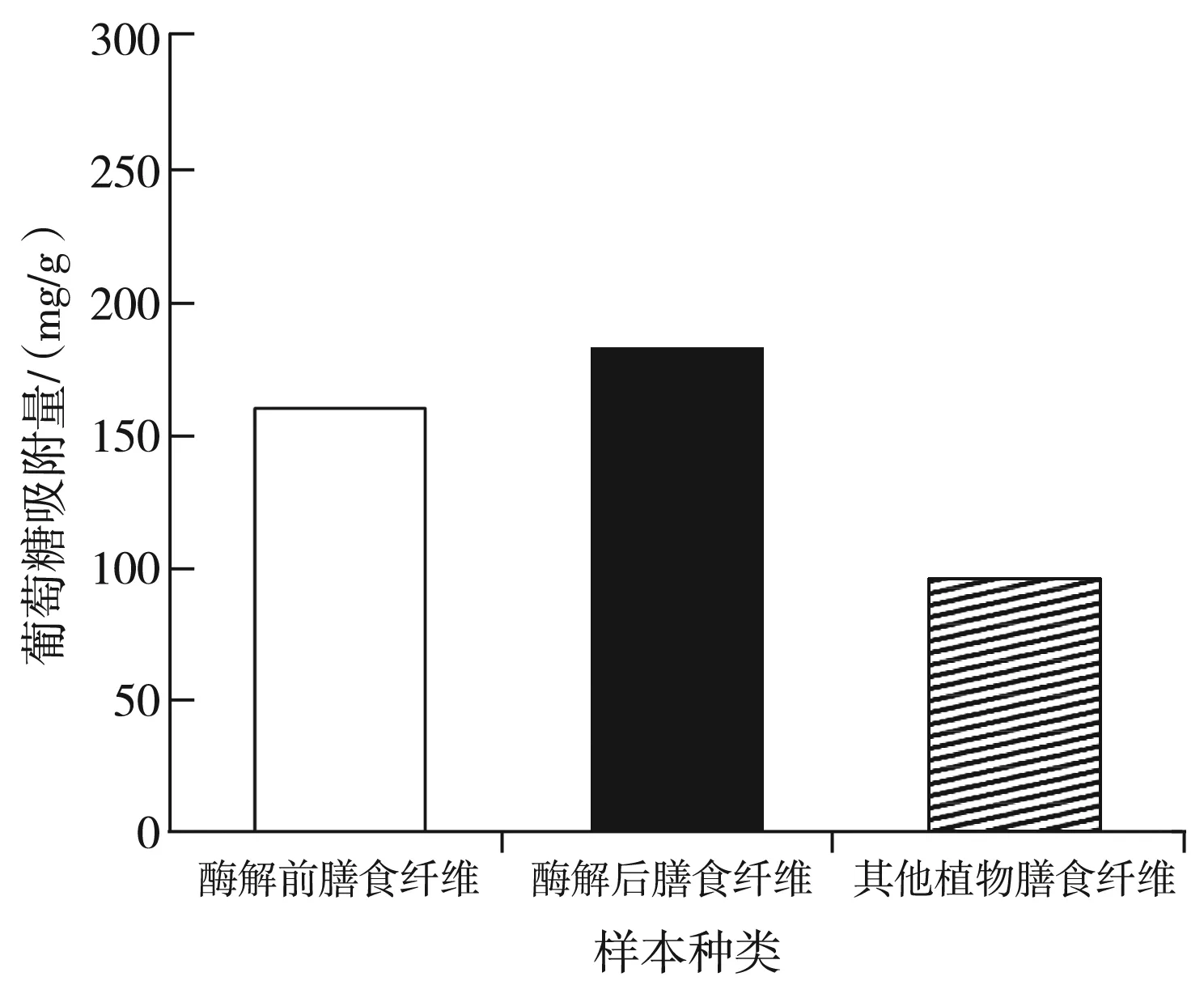
图3 葡萄糖吸收能力测定结果Fig.3 The determination results of glucose absorption capacity
由图3可知,酶解改性处理后膳食纤维的葡萄糖吸收力最强,其葡萄糖吸收量可达到190.50 mg/g。在进行酶解前,膳食纤维的葡萄糖吸收量为190.00 mg/g。在上述测定中对葡萄糖吸附能力最差的物质为其他植物的膳食纤维,其吸附量仅为105.50 mg/g。通过对上述数据进行分析可知,酶解改性处理可有效提升膳食纤维的葡萄糖吸收能力。对其进行系统研究表明,纤维素酶对膳食纤维细胞壁中的大分子结构具有一定的降解作用,使膳食纤维表面结构变得疏松,空隙结构增大。在小分子活动区域内,其更容易进入空隙之中。在酶解作用的影响下,膳食纤维表面结构松散,功能基团失去保护层,其与葡萄糖的结合面积不断扩大,因而可以吸收到大量的葡萄糖。由于其他植物的膳食纤维表面结构较为紧密,大量的功能基团因包裹过密得不到释放,因此不具备较高的葡萄糖吸收能力。
2.4 胆固醇吸收能力测定结果分析
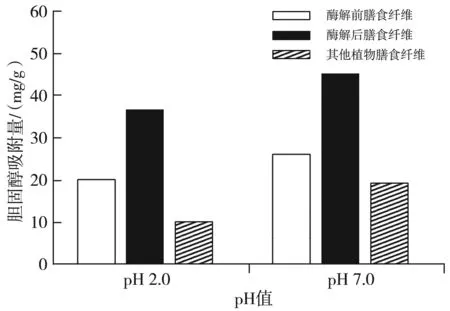
图4 胆固醇吸收能力测定结果Fig.4 The determination results of cholesterol absorption capacity
由图4可知,酶解处理对膳食纤维吸收胆固醇的能力具有一定的影响,同时,膳食纤维所处的pH值环境也是重要的影响指标之一。当pH值浓度得到提升时,胆固醇被膳食纤维吸收量得到提升。在此次测定过程中,将pH值浓度设定为7.0与2.0两部分,分别用于模拟肠道环境与胃部环境,通过对比可知,处于肠道环境中的膳食纤维相较于处于胃部环境的膳食纤维具有更高的胆固醇吸附力。且通过不同种类的膳食纤维对比表明,在两种不同环境下,酶解改性后的膳食纤维对胆固醇的吸收能力维持在较高水平。对此结果加以分析可知,降解程度不仅是膳食纤维吸附胆固醇能力的主要影响因素,其表面结构与组成均会对其造成影响。
3 结论
在此次研究中,通过对食用菌膳食纤维进行酶解改性,利用多种试验方式对酶解改性后的膳食纤维对人体机能的影响展开研究。通过综合分析可知,酶解过程改变了膳食纤维的表面结构,且食用菌酶解改性型膳食纤维对于人体消化道的蠕动与效果具有一定的促进作用。在酶解过程中,膳食纤维抗消化性得到提升,其对葡萄糖、胆固醇的吸附能力得到提升,起到调节肠道菌群的作用。同时,摄入酶解改性型膳食纤维可间接调节人体肠道的乳酸含量,提高血清中的抗氧化酶活力,帮助肠道蠕动。在日后的研究中,需要对酶解改性型膳食纤维调节肠道有益菌群繁殖的途径展开研究,为食用菌健康食品的开发提供更多的理论依据。
