QCR2调控p53泛素化对SiHa细胞株的周期阻滞作用
2022-02-22程海玲曹芹雪霍会蚕
程海玲,王 宁,曹芹雪,霍会蚕,王 琛
宫颈癌是妇科恶性肿瘤致死的重要原因。每年约1/3的新发病例发生在我国,且发病率逐年升高[1]。既往研究[2-3]显示,肿瘤细胞中线粒体数量多于正常细胞,且线粒体复合物一、三抑制剂可抑制肿瘤生长,推测肿瘤细胞中线粒体功能活跃。该课题组根据组蛋白去乙酰化酶抑制剂(trichostatin a,TSA)对肿瘤细胞凋亡具有特异性诱导作用的原理,筛选出凋亡相关基因泛醇-细胞色素C还原酶亚基2(ubiquinol-cytochrome C reductase subunit 2,QCR2),且发现其异常高表达于宫颈癌组织,推测QCR2作为致癌基因参与宫颈癌发生、发展。该研究通过构建沉默QCR2的宫颈癌SiHa细胞株,研究其对该细胞的周期阻滞作用及相关机制。
1 材料与方法
1.1 细胞宫颈癌SiHa细胞株购于上海江林生物科技有限公司。培养条件:含10%胎牛血清、1%双抗(青霉素、链霉素)的DMEM培养基,标准条件(37 ℃,5% CO2)培养箱。
1.2 药物、主要试剂和仪器携带绿色荧光蛋白的QCR2 siRNA(上游:5′-AUGACUGCCGCAUGUUACG CACAC-3′,下游:5′-UGCACAGCUGUGCACGCUAC GUGC-3′)、QCR2 siRNA2(上游:5′-UGCAGCGUG CGUGCACGCGUGACG-3′,下游:5′-UGCACGCUGCA CUAGUGGCUGCAC-3′)、control siRNA质粒(深圳默赛尔生物医学科技发展有限公司);LipofectamineTM3000脂质体法转染试剂盒(北京索莱宝科技有限公司);TRIzol试剂盒、逆转录试剂盒、实时荧光定量PCR检测试剂盒、BCA蛋白定量试剂盒(美国Sigma公司);QCR2、p53一抗(美国Santa Cruz公司);碘化丙啶(propidium iodide,PI)染液(北京中杉金桥生物技术有限公司);泛素-蛋白酶体抑制剂PS341(美国Thermo Fisher Scientific公司);Pierce Crosslink IP kit试剂盒(上海北诺生物科技有限公司)。DMI4000B型荧光显微镜(德国徕卡微系统有限公司);FACSCanto Ⅱ流式细胞仪(美国BD公司)。
1.3 方法
1.3.1细胞培养与转染 收集对数期SiHa细胞,胰蛋白酶消化,接种于24孔板,细胞融合度达75%时,更换成双抗完全培养基。严格按照LipofectamineTM3000脂质体法转染说明书操作,LipofectamineTM3000转染试剂5 μl加至Opti-MEM无血清培养基100 μl中(A液),待转质粒(QCR2 siRNA1、QCR2 siRNA2、control siRNA)各5 μl加至Opti-MEM无血清培养基100 μl中(B液),A液与B液混合,室温孵育5 min。孵育期间,每个孔板更换为新鲜培养基1.8 ml,孵育完成后每孔加入混合液,继续培养48 h。显微镜下观察转染效率,筛选有效siRNA。将转染有效siRNA、control siRNA质粒的细胞分别设为QCR2 siRNA组、control siRNA组,未经处理的SiHa细胞设为空白组,每组设置5个复孔。荧光显微镜下观察,发出明亮的绿色荧光者为阳性细胞,转染效率(%)=阳性细胞数/总细胞数×100%。
1.3.2qRT-PCR、Western blot检测QCR2 mRNA与蛋白相对表达量 取空白组、control siRNA组、QCR2 siRNA组细胞,加入TRIzol 1 ml,经浓度、纯度检测后逆转录获取cDNA,鉴定后对反应体系及反应条件进行设置,重复40次,72 ℃延伸5 min。以GAPDH为内参基因,2-ΔΔCt法计算mRNA相对表达量。QCR2上游引物序列:5′-TGCACGCATAGCAGGCACGTGCAC-3′,下游引物序列:5′-GTACGTGTGACAGTCGTACAACGC-3′;GAPDH上游引物序列:5′-GTGACCGTGAATTCACCGCACGCT-3′,下游引物序列:5′-TGACACGACGTGCACACAGTCGTG-3′。所有实验重复3次,取平均值。
取空白组、control siRNA组、QCR2 siRNA组细胞,PBS洗涤,RIPA细胞裂解液裂解,离心收集沉淀,BCA试剂盒定量。取40 μg样品混合上样缓冲液,100 ℃水浴5 min,10 000 r/min离心15 min,收集上清液,恒压下分离,湿法转膜,5%脱脂奶粉常温封闭2 h,加入QCR2一抗(1 ∶1 000)4 ℃孵育过夜,TBTS漂洗,加入山羊抗兔IgG二抗(1 ∶8 000)常温孵育2 h,TBTS漂洗。暗室显影,Fluor Chem FC2成像系统扫描、分析,以QCR2/GAPDH灰度值表示蛋白相对表达量。
1.3.3PI染色检测细胞周期 取空白组、control siRNA组、QCR2 siRNA组细胞,至融合度80%左右时胰蛋白酶消化,培养基终止消化,轻吹细胞,移至15 ml离心管,4 ℃,2 500 r/min离心5 min;预冷PBS冲洗,同条件离心5 min;100 μl PBS重悬,加入1 ml 70%预冷乙醇,混合均匀;4 ℃固定12 h,2 500 r/min,半径12 cm离心5 min,预冷PBS冲洗细胞;加入PI染液(RNaseA 10 μl,染色缓冲液0.5 ml,PI染液25 μl),遮光冰浴30 min;300细胞滤网过滤,经流式细胞仪检测。
1.3.4qRT-PCR、Western blot检测p53 mRNA与蛋白相对表达量 取QCR2 siRNA组细胞,用生理盐水(normal saline,NS)溶液溶解泛素-蛋白酶体抑制剂PS341,以终浓度50 nmol/L干预QCR2 siRNA组细胞4 h,设为QCR2 siRNA+PS341组,另取QCR2 siRNA组细胞以等量NS干预4 h,设为QCR2 siRNA+NS组。
qRT-PCR分别检测空白组、control siRNA组、QCR2 siRNA组p53 mRNA相对表达量。操作同1.3.2, p53上游引物序列:5′-TGCGCGCAACTGCAC GCGTGCACGC-3′,下游引物序列:5′-CGTACGCTGCACGCTAGCTGCACGC-3′;GAPDH上游引物序列:5′-GTCGAAAACCACACTGCACCGCGTC-3′,下游引物序列:5′-GTCAACGGGTTTGCACGCTGCAACT-3′。所有实验重复3次,取平均值。
Western blot检测空白组、control siRNA组、QCR2 siRNA组,空白组、QCR2 siRNA组、QCR2 siRNA+NS组、QCR2 siRNA+PS341组p53蛋白相对表达量。操作同1.3.2,封闭液封闭后加入p53一抗(1 ∶1 000)4 ℃孵育过夜,TBTS漂洗,加入山羊抗兔IgG二抗(1 ∶8 000)常温孵育2 h,TBTS漂洗。暗室显影,Fluor Chem FC2成像系统扫描、分析,以p53灰度值/内参GAPDH灰度值表示其蛋白相对表达量。
1.3.5免疫共沉淀实验检测p53泛素化水平 取空白组、control siRNA组、QCR2 siRNA组细胞,按照Pierce Crosslink IP kit试剂盒说明书要求操作。于NP-40裂解缓冲液中裂解,10 000 r/min离心15 min转移上清液至新离心管。Protein A/G琼脂糖珠经PBS洗涤2次后制成50% Protein A/G琼脂糖珠工作液。振荡器4 ℃振荡10 min以避免非特异性结合蛋白对实验结果的影响。10 000 r/min离心15 min转移上清液至新离心管,弃去Protein A/G琼脂糖珠,加入QCR2、p53一抗至总体积500 μl。振荡器4 ℃缓慢振荡过夜,离心收集免疫沉淀产物,PBS洗涤。加入上样缓冲液15 μl,沸水浴5 min行Western blot检测。

2 结果
2.1 转染效率观察转染48 h,荧光显微镜下观察,QCR2 siRNA1的转染效率大于QCR2 siRNA2,将其作为有效siRNA进行后续实验。见图1。
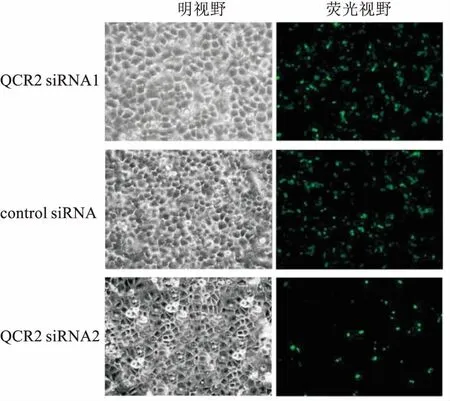
图1 荧光显微镜下观察转染效率 ×200
2.2 QCR2 mRNA与蛋白相对表达量比较与空白组、control siRNA组比较,QCR2 siRNA组mRNA与蛋白相对表达量均降低(P<0.05)。见图2。
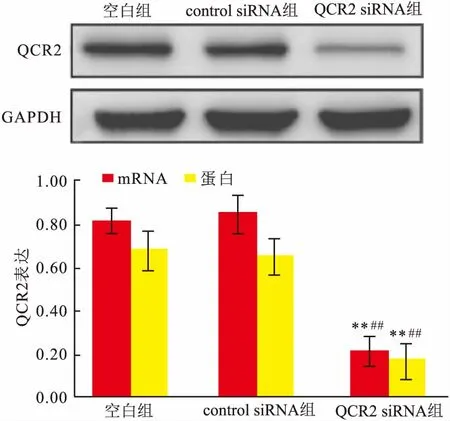
图2 qRT-PCR、Western blot检测QCR2表达与空白组比较:**P<0.01;与control siRNA组比较:##P<0.01
2.3 各组细胞周期分布对比与空白组、control siRNA组比较,QCR2 siRNA组G0/G1占比升高(P<0.01),S、G2/M占比降低(P<0.01)。见图3。

图3 各组细胞周期分布情况A:各组细胞周期流式图;B:各组细胞周期柱状图;与空白组比较:**P<0.01;与control siRNA组比较:##P<0.01
2.4 各组p53 mRNA与蛋白相对表达量比较
p53 mRNA相对表达量组间比较,差异无统计学意义;与空白组、control siRNA组比较,QCR2 siRNA组p53蛋白相对表达量升高(P<0.05)。见图4。

图4 qRT-PCR、Western blot检测QCR2表达与空白组比较:**P<0.01;与control siRNA组比较:##P<0.01
2.5 各组p53蛋白相对表达量比较空白组、QCR2 siRNA组、QCR2 siRNA+NS组、QCR2 siRNA+PS341组p53蛋白相对表达量分别为(0.21±0.03)、(0.82±0.09)、(0.80±0.10)、(0.24±0.04),与空白组、QCR2 siRNA+PS341组比较,QCR2 siRNA组、QCR2 siRNA+NS组p53蛋白相对表达量升高(P<0.05)。见图5。

图5 Western blot检测p53蛋白表达A:空白组:B:QCR2 siRNA组;C:QCR2 siRNA+NS组;D:QCR2 siRNA+PS341组
2.6 各组p53泛素化程度比较空白组、control siRNA组、QCR2 siRNA组p53泛素化程度分别为(70.58±8.54)%、(71.03±8.62)%、(20.27±4.15)%,与空白组、control siRNA组比较,QCR2 siRNA组p53泛素化程度降低(t=11.848,P<0.001;t=11.864,P<0.001)。见图6。
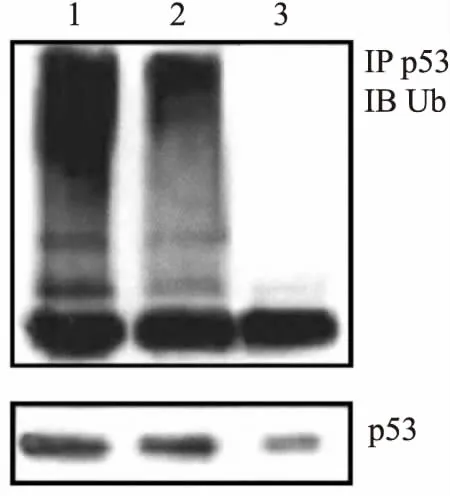
图6 免疫共沉淀实验检测p53泛素化水平1:空白组; 2:control siRNA组; 3:QCR2 siRNA组
3 讨论
宫颈癌是妇科高发生殖系统恶性肿瘤之一,目前临床关于其发病机制尚未完全明确,多认为与细胞周期调控异常、ATM信号通路被激活、3q区域扩增、内切酶活性增强等有关[4-5]。由于该病早期无明显及特异性症状,多数患者早期难以确诊,仅能采取放化疗为主的姑息治疗方式,但治疗靶向性不足,且具有较强的神经、肝肾毒性,预后不良[6]。随着对宫颈癌分子机制研究的逐步深入,基因靶向干预为该病治疗提供了新的方向。
研究[7-8]证实,细胞周期调控基因突变是肿瘤发生的重要机制之一。该研究结果中,与空白组、control siRNA组比较,QCR2 siRNA组QCR2 mRNA与蛋白表达降低,细胞周期G0/G1占比升高,提示沉默QCR2可将宫颈癌细胞阻滞在G0/G1期,从而抑制肿瘤。Abbaszadeh et al[9]研究认为,肿瘤细胞中无氧糖酵解途径增强的主要原因是线粒体氧化磷酸化水平提高,且伴随相关蛋白表达的增加。QCR2是线粒体氧化磷酸化复合体三的重要组成蛋白,本课题组以其与肿瘤细胞凋亡具有相关性为线索,进一步检测其在多种肿瘤组织中的表达情况,发现其普遍高表达于乳腺癌、宫颈癌、肺癌、食管癌等疾病中,且与部分临床特征具有相关性,揭示其致癌作用,为进一步研究其参与肿瘤发生发展的机制奠定基础。
p53是目前公认的作用最广泛、最重要的抑癌基因,恢复其表达及功能活性是治疗肿瘤的重要思路[10-11]。调控p53蛋白可从转录、翻译、蛋白修饰等层面进行,其中泛素化降解过程是最重要的调控方式。泛素化是一种对靶蛋白进行特异性修饰的过程,可调控细胞增殖、细胞周期、凋亡等多种进程,泛素-蛋白酶体系统在肿瘤进程中发挥重要作用[12]。该研究结果显示,与空白组、control siRNA组比较,QCR2 siRNA组p53 mRNA表达未发生明显变化,蛋白表达升高,推测QCR2对p53具有调控作用,且该调控并非在转录水平,而是发生在蛋白水平,可能经p53泛素-蛋白酶体降解途径对其蛋白表达进行调控。为验证该推测,该研究在沉默宫颈癌细胞QCR2的同时加入泛素-蛋白酶体抑制剂PS341,结果显示p53蛋白表达未发生变化,提示QCR2对p53蛋白表达的调控可能依赖于蛋白酶体。由于蛋白酶体是泛素化蛋白发生降解的主要场所,该研究进一步检测了沉默QCR2对p53泛素化水平的影响,显示其泛素化水平降低。综合以上结果,推测沉默QCR2可将宫颈癌细胞阻滞在G0/G1期,其作用机制与抑制p53泛素化,提高其蛋白表达有关。Han et al[13]研究显示,QCR2在多种人类肿瘤中表达上调,抑制其表达可通过激活p53信号传导并诱导p21依赖性细胞周期阻滞和衰老来抑制癌细胞生长,该研究结果与其具有相似性。
