PAQR4在肝细胞癌中的表达及其对HepG2细胞生物学特性的影响
2022-02-22董庆泰林振宇李中虎张智勇马丹丹
董庆泰,林振宇,李中虎,张智勇,马丹丹,蔡 逊
原发性肝癌是临床上最常见的恶性肿瘤之一。在2018年公布的全球36种恶性肿瘤数据中,肝癌患者占恶性肿瘤新发病例数4.7%,位居第7位;肝癌患者占死亡病例数8.2%,位居第2位[1]。原发性肝癌中85%~90%病理分型为肝细胞癌(hepatocellular carcinoma, HCC)[2]。目前HCC最有效的治疗手段是早期手术,且早期诊疗患者的5年生存率超过70%,远高于晚期(低于16%)[3]。但HCC起病隐匿,大多数患者首次诊断即为中晚期,错过了最佳手术时机[4]。因此,寻找对HCC敏感且特异性高的新型生物标志物和新的肿瘤基因治疗靶点有重大意义。
Progestin and adipoQ receptor family member 4(PAQR4)属于PAQR基因组家族(PAQR1-PAQR11)中的一员,定位于人类染色体16p13.3,包含3个外显子[5]。已有研究表明PAQR4参与人体恶性肿瘤的发生发展,如乳腺癌[6]、非小细胞肺癌[7-8]、前列腺癌[9]、胃癌[10],且PAQR4都表现出癌基因的特性。但目前PAQR4在HCC中的表达及其对HepG2细胞生物学特性影响的研究报道甚少。
1 材料与方法
1.1 生物信息学分析收集TCGA(the cancer genome atlas)数据库中PAQR4在HCC中的基因表达数据和临床数据,利用R语言整理两组数据,并分析PAQR4在HCC中的表达差异及临床预后。
1.2 细胞培养及转染肝癌HepG2细胞株购自中国典型培养物保藏中心。HepG2细胞培养于10%胎牛血清(FBS)、1%双抗(青霉素/链霉素)的 Dulbecco改良的Eagle培养基(Dulbecco′s modified eagle medium, DMEM)中,置于37 ℃、5%CO2培养箱中。细胞接种于6孔培养板,待贴壁后,使用阳离子脂质载体Lipofectamine 2000将pcDNA3.1-PAQR4质粒转染HepG2细胞作为实验组,将空载体pcDNA3.1-vector转染HepG2细胞作为其对照组。转染48 h后收集细胞,通过RT-PCR(Real-time PCR)测定法评估转染效率。
1.3 CCK-8实验取对数生长期HepG2细胞接种于96孔板,24 h后转染,分为实验组和对照组。设置复孔4个/组,分别于培养24、48、72 h后加入CCK-8试剂,每孔10 μl,放入37 ℃培养箱孵育2 h。最后进行检测(酶标仪波长450 nm),记录吸光度值。
1.4 Transwell实验胰酶消化对照组和实验组细胞,调整细胞密度为1.0×108个/L,并接种到含有无血清培养基的Transwell小室上层中,加入细胞悬液100 μl/孔。下室内加入600 μl新鲜培养基。置入配养箱中培育24 h后,在室温下每孔加入4%多聚甲醛1 ml固定10 min,甲醇对细胞通透处理20 min,0.1%结晶紫染液染色20 min,棉签擦去上室未迁移细胞,自然风干后在显微镜下以200倍放大观察染色细胞。设置复孔3个/组。
1.5 划痕实验取对数生长期的对照组和实验组细胞,分别用胰酶消化后铺于6孔板中,接种细胞约5×105个/孔。继续培养至细胞铺满贴壁,用10 μl消毒枪头垂直划痕,PBS冲洗3遍,加入无血清DMEM培养基置于培养箱中培养。分别于0、24、48 h拍摄显微镜放大200倍下的图片。
1.6 流式细胞仪检测细胞凋亡用胰酶消化对照组和实验组的细胞,制成细胞悬浮液,调整密度为1.0×105个/ml,接种于96孔板中培养48 h后,PBS清洗2次,低温下加入Binding Buffer重悬细胞。室温避光条件下取100 μl结合缓冲液重悬细胞加入5 μl的 AnnexinV-FITC反应10 min,再加入5 μl的碘化丙啶(propidium iodide, PI)反应10 min。最后加入400 μl Binding Buffer缓冲液,流式细胞仪检测细胞凋亡。设置复孔3个/组。

2 结果
2.1 PAQR4 mRNA在HCC组织和癌旁组织中的表达差异收集整理出TCGA数据库中关于HCC共424个样本,包括50个癌旁组织和374个癌组织,PAQR4 mRNA在癌组织中的表达水平明显高于癌旁组织,差异有统计学意义(P<0.001),见图1A。50例HCC患者的配对癌组织和癌旁组织中,癌组织中PAQR4 mRNA的表达水平高于癌旁组织,差异有统计学意义(P<0.001),见图1B。

图1 采用Wilcoxon signed-rank检验分析PAQR4在非配对和配对的癌组织和癌旁组织样本中的表达水平A:非配对;B:配对;与癌旁组织比较:***P<0.001
2.2 PAQR4与HCC患者临床预后的关系在全部374个癌组织样本中,PAQR4 mRNA高表达组总体生存率低于低表达组,且差异有统计学意义(P=0.012),见图2。HCC患者Cox回归分析结果如表1所示,单因素Cox分析结果显示PAQR4 mRNA表达水平(HR=1.104, 95%CI:1.051~1.160,P<0.001)、T分期(HR=1.816, 95%CI:1.442~2.287,P<0.001)、M分期(HR=3.924,95%CI:1.230~12.519,P=0.021)、病理分期(HR=1.879, 95%CI:1.466~2.408,P<0.001)对HCC患者的预后存在显著影响。多因素Cox分析结果显示PAQR4 mRNA表达水平(HR=1.396, 95%CI:1.081~1.804,P=0.011)是HCC患者预后的独立危险因素。
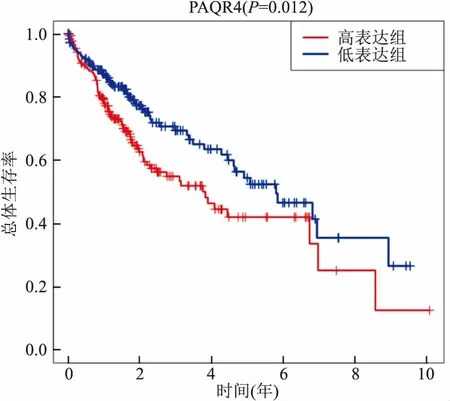
图2 PAQR4 mRNA表达水平对HCC患者的总体生存的影响
表1 Cox回归比例风险模型分析HCC患者PAQR4 mRNA表达水平及其他临床病理特征与总生存率的相关性
2.3 过表达PAQR4对HepG2细胞增殖的影响
CCK-8法检测结果显示,24、48、72 h时实验组的OD值较对照组更高,差异有统计学意义(t=4.05、10.47、3.82,P<0.05 )。见图3。上述结果表明PAQR4促进了HepG2细胞的增殖。

图3 CCK-8检测PAQR4对HepG2细胞增殖的影响与对照组比较:*P<0.05,**P<0.01,***P<0.001
2.4 过表达PAQR4对HepG2细胞侵袭的影响Transwell实验结果显示,24 h后实验组侵袭细胞数较对照组更多,差异有统计学意义(t=6.03,P<0.01)。见图4。结果表明PAQR4增加了HepG2细胞的侵袭能力。

图4 Transwell检测PAQR4对HepG2细胞侵袭的影响 ×200与对照组比较:**P<0.01
2.5 过表达PAQR4对HepG2细胞迁移的影响划痕实验结果显示,24、48 h后实验组愈合率较对照组更高,差异有统计学意义(t=9.13、4.40,P<0.05)。见图5。以上表明PAQR4增加了HepG2细胞的迁移能力。
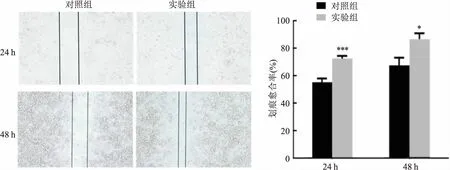
图5 划痕实验检测PAQR4对HepG2细胞侵袭的影响 ×200与对照组比较:*P<0.05,***P<0.001
2.6 过表达PAQR4对HepG2细胞凋亡的影响流式细胞仪检测结果显示,48 h后实验组细胞存活率高于对照组,差异有统计学意义(t=41.44,P<0.001)。见图6。此结果表明PAQR4抑制了HepG2细胞凋亡。
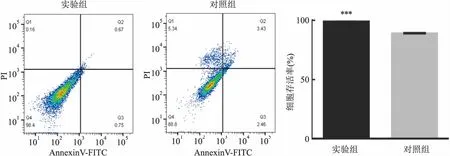
图6 PI & Annexin V检测PAQR4对HepG2细胞凋亡的影响与对照组比较:***P<0.001
3 讨论
PAQR家族(PAQR1-PAQR11)基因最先由Tang et al[5]于2005年定义并命名,该家族所有成员所编码的蛋白都包含7个跨膜域,但其拓扑结构又不同于传统的G蛋白偶联受体蛋白。目前,国内外已有研究表明人体内PAQR家族基因的异常表达与体内恶性肿瘤的发生发展密切相关,如胃癌[11]、结肠癌[12]、肝癌[13]等。PAQR4作为PAQR家族基因中的一员在肿瘤的发生中同样起着关键作用,有报道[14]表明PAQR4和SKP2通过相互之间的拮抗作用调节老鼠体内CDK4蛋白的水平进而间接参与肿瘤的发生发展。这为后续PAQR4在人体内肿瘤的相关研究提供了线索,但目前国内外关于PAQR4在HCC中的表达及意义的研究甚少。
Zhang et al[6]研究表明PAQR4 mRNA的表达水平在乳腺癌组织及配对癌旁组织中的表达存在差异,且PAQR4 mRNA的高表达与乳腺癌患者更差的预后相关。在非小细胞肺癌患者的癌组织中PAQR4呈现出高表达状态,且PAQR4高表达的非小细胞肺癌患者相对于PAQR4低表达的患者的总体生存率更低[8]。PAQR4 mRNA在前列腺癌组织中的表达量相对于其配对癌旁组织中的表达量高,且PAQR4 mRNA的高表达与前列腺癌的大小、病理分期和远处转移相关[9]。PAQR4 mRNA在胃癌组织中的表达水平高于癌旁组织[10]。这些研究均提示PAQR4在人体恶性肿瘤的发生中表现出癌基因的特性。在该研究中,利用从TCGA数据库中获得的高通量RNA测序数据,对PAQR4在HCC中的表达和预后进行了生物信息学分析;结果显示PAQR4 mRNA在HCC组织中高表达,且PAQR4 mRNA高表达的HCC患者总体生存率更低。这与国内外研究结果基本一致。此外,该研究还表明PAQR4 mRNA的表达水平是HCC患者的独立预后因素,这说明在该研究中所涉及的临床病理特征中,PAQR4 mRNA的表达水平对HCC患者预后有明显的影响。由于该研究中所纳入的临床病理特征有限,PAQR4 mRNA的表达水平在纳入更多临床病理特征的多因素分析中是否仍是HCC患者预后的独立影响因素需要进一步研究。
为了进一步探讨PAQR4与肝癌的关系,该研究通过构建PAQR4过表达的HepG2细胞株,结果提示过表达PAQR4可显著促进HepG2肝癌细胞的增殖、侵袭、迁移,与此同时,PI和Annexin V双染实验的结果也表明过表达PAQR4对HepG2细胞凋亡起抑制作用。Wu et al[7]的研究表明过表达PAQR4促进A549肺癌细胞增殖、侵袭、迁移。过表达PAQR4能够促进PC53和DU145前列腺癌细胞的增殖、侵袭、转移和上皮-间质细胞之间的转换[9]。在胃癌中miR-370的直接作用靶点在PAQR4的3′UTR,miR-370的敲除会导致SGC7901胃癌细胞中PAQR4的表达量增加;与此同时,过表达PAQR4能够逆转miR-370对胃癌细胞的增殖、侵袭和上皮-间质细胞之间的转换[10]。国内外研究均提示PAQR4过表达促进癌细胞的增殖、侵袭和迁移,这与该研究结果相同。以上提示PAQR4有可能成为预测HCC的候选生物标志物。
综上所述,该研究初步探讨了PAQR4基因对HCC患者预后影响及其在HepG2细胞中的作用,证明了PAQR4在HCC组织中高表达且与预后相关,过表达PAQR4促进HepG2细胞的增殖、侵袭、迁移,且过表达PAQR4抑制HepG2细胞的凋亡。PAQR4有可能成为HCC诊断和预后的新标志物。
