利多卡因对肺癌A549细胞增殖、侵袭及AMPK/mTOR/4EBP1信号通路的影响*
2022-02-19杨路宗
王 静,杨路宗,燕 枫
1.上海市长宁区天山中医医院麻醉科,上海 200000;2.上海中医药大学附属龙华医院麻醉科,上海 200000;3.上海市松江区九亭医院麻醉科,上海 201600
肺癌患者死亡率较高,每年约有160万人死于肺癌[1]。非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)是肺癌的两种亚型,NSCLC包括腺癌、鳞状细胞癌和大细胞癌,约占所有肺癌患者的85%[2]。尽管近年来治疗NSCLC的技术和策略已有所改善,但该疾病的预后仍然很差。NSCLC的5年生存率仅在15%左右[3]。因此,寻找新的生物标志物并阐明其潜在机制是开发NSCLC新疗法的基础。研究表明,肺癌细胞异常增殖与单磷酸腺苷活化蛋白激酶(AMPK)/哺乳动物雷帕霉素靶蛋白(mTOR)/真核细胞翻译起始因子4E结合蛋白1(4EBP1)信号通路有关,其涉及多效性AMPK的激活[4]。AMPK在调节能量稳态中起着关键作用,并充当“代谢传感器”来调节三磷酸腺苷(ATP)的水平[5]。它还与细胞生长有关,磷酸化的AMPK会抑制哺乳动物mTOR信号转导途径的靶标[6]。mTOR在调节细胞增殖、生长、分化、迁移和存活中起着核心作用,4EBP1是mTOR下游信号级联的一部分,它可通过mTOR的磷酸化被激活[7]。利多卡因是一种广泛使用的酰胺类局部麻醉药。近年来,许多研究报道了其在体外的抗肿瘤活性,比如在肝癌和宫颈癌中[8-9],但关于利多卡因对肺癌细胞作用的报道较少。本研究拟探讨利多卡因对肺癌细胞增殖、侵袭及AMPK/mTOR/4EBP1信号通路的影响,为肺癌的治疗提供理论依据。
1 材料与方法
1.1实验细胞及药物 人肺癌A549细胞系购自美国典型培养物保藏中心,批号CST-20200613;利多卡因购自武汉贝兰生物科技有限公司,原料药,纯度99.9%,批号97958-12-3;5-氟尿嘧啶购自深圳市思美泉生物科技有限公司,原料药,纯度99.0%,批号TA10693-7。
1.2仪器与试剂 RPMI-1640培养基、Matrigel基质胶均购自美国Gibco公司,批号分别为QW74869、QW1659;胎牛血清购自美国Hyclone公司,批号XD458-32;细胞计数试剂盒8(CCK-8)测定试剂盒、结晶紫染料、TRIzol试剂、RIPA缓冲液均购自江苏弘麒生物科技有限公司,批号分别为198043、195017、193016、200411;mRNA反转录试剂盒、实时荧光定量PCR(RT-PCR)试剂盒(2×SYBR Green qPCR Master Mix)、聚偏二氟乙烯(PVDF)膜、ECL化学发光试剂盒均购自上海冠泰生物科技有限公司,批号分别为A2020A109、A2020B117、A2020B207、A2020A105;AMPK、mTOR、4EBP1、磷酸化mTOR(p-mTOR)、磷酸化4EBP1(p-4EBP1)、GAPDH单克隆抗体、鼠抗人二抗均购自美国Santa Cruz Biotechnology公司,批号分别为sc-3930、sc-7480、sc-5091、sc-7482、sc-5092、sc-1006、sc-1013;MJP-250S型二氧化碳培养箱购自浙江纳德科学仪器有限公司;Labserv K3型酶标仪购自上海沃元科技有限公司;E100型显微镜购自日本尼康公司;3420型transwell小室购自北京优尼康生物科技有限公司;TL988-Ⅱ型RT-PCR仪购自西安天隆科技有限公司;DYCZ-24EN型凝胶电泳仪购自北京六一生物科技有限公司;JY02G型凝胶成像仪购自北京君意东方电泳设备有限公司。
1.3方法
1.3.1细胞培养及分组 将肺癌A549细胞加入到RPMI-1640培养基中,该培养基中添加了10%的胎牛血清并在37 ℃、5%CO2、2%O2、93%N2环境中培养。设以下分组,肺癌A549细胞组,细胞浓度为每毫升5×106个肺癌A549细胞,并置于含10% 胎牛血清的RPMI-1640培养基中培养;5-氟尿嘧啶组,肺癌A549细胞培养方法同肺癌A549细胞组,加入5-氟尿嘧啶,使5-氟尿嘧啶浓度为50 μmol/L[10];利多卡因低、高剂量组,肺癌A549细胞培养方法同肺癌A549细胞组,各组分别加入利多卡因[11],使利多卡因浓度分别为100、200 μmol/L。以上各组每组设6个平行孔,培养72 h。
1.3.2细胞增殖测定 各组细胞培养结束后,收集细胞,重悬,并将细胞种植到96孔板中,24 h后将10 μL CCK-8试剂加入每个孔中,并在37 ℃培养箱中孵育2 h后,用酶标仪在450 nm处测量吸光度(A)值,同时设置空白组(含有培养液、CCK-8),计算细胞存活率,存活率=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。
1.3.3细胞侵袭水平测定 transwell小室用于评估细胞的侵袭程度,操作如下:在无血清RPMI-1640培养基中,将100 mL Matrigel基质胶包被在24孔细胞培养板中,将2×104个A549细胞悬浮于150 μL无血清培养基中,进入上腔室,将700 μL含20% 胎牛血清的RPMI-1640培养基置于下腔室中,温育48 h后,用棉签轻轻地去除内层上的细胞,并将外层细胞在4%多聚甲醛中固定15 min,并用0.1%结晶紫染料染色20 min,在5个随机选择的视野中对细胞进行计数,取平均值。
1.3.4细胞AMPK、mTOR、4EBP1 mRNA水平测定 使用TRIzol试剂从细胞中提取总RNA,通过mRNA反转录试剂盒进行cDNA的合成,使用2×SYBR Green qPCR Master Mix在PCR仪上进行RT-PCR分析。β-actin是标准化AMPK、mTOR、4EBP1的内参。采用2-ΔΔCt的方法计算AMPK、mTOR、4EBP1 mRNA的相对表达水平。引物由上海冠泰生物科技有限公司合成,引物序列如下:AMPK正向5′-GCACACATTGAAGAGGACAGAC-3′和反向5′-TATTGAAGGGGGTTCTGGTGGA-3′;mTOR正向5′-CCTAGTTTGGGAGGAGCAGA-3′和反向5′-GGCATGACACACAACACACT-3′;4EBP1正向5′-GACTCATGACCACAGTCCATGC-3′和反向5′-AGAGGCAGGGATGATGTTCTGA-3′;β-actin正向5′-GCTTCGGCAGCACATATACTAAAAT-3′和反向5′-CGCTTCACGAATTTGCGTGTCATCG-3′。RT-PCR总反应体系(10 μL)为:2×SYBR Green qPCR Master Mix 4 μL,cDNA模板1 μL,正向引物0.5 μL,反向引物0.5 μL,去离子水4 μL。参数设置为95 ℃ 48 s,57 ℃ 40 s,70 ℃ 40 s,循环40次,78 ℃ 1 min。
1.3.5细胞AMPK、mTOR、4EBP1、p-mTOR、p-4EBP1蛋白表达水平测定 使用RIPA缓冲液制备细胞裂解物,并检测蛋白质表达水平,通过SDS聚丙烯酰胺凝胶电泳分离每种蛋白质样品(50 μg),然后转移至PVDF膜上,将膜与AMPK、mTOR、4EBP1、p-mTOR、p-4EBP1、GAPDH一抗(均为1∶500稀释)置于4 ℃冰箱中孵育过夜,然后加入鼠抗人二抗(1∶3 000稀释)孵育2 h,并用ECL化学发光试剂盒显色,使用Image J软件定量蛋白质印迹上的蛋白条带强度,并将其标准化。
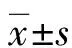
2 结 果
2.1各组肺癌A549细胞A值、存活率比较 与肺癌A549细胞组比较,5-氟尿嘧啶组、利多卡因低剂量组、利多卡因高剂量组A值、存活率降低(P<0.05);与5-氟尿嘧啶组比较,利多卡因低、高剂量组A值、存活率升高(P<0.05);与利多卡因低剂量组比较,利多卡因高剂量组A值、存活率降低(P<0.05)。见表1。

表1 各组肺癌A549细胞A值、存活率、侵袭能力比较
2.2各组肺癌A549细胞侵袭能力的比较 与肺癌A549细胞组比较,5-氟尿嘧啶组、利多卡因低剂量组、利多卡因高剂量组穿膜数减少(P<0.05);与5-氟尿嘧啶组比较,利多卡因低、高剂量组穿膜数增加(P<0.05);与利多卡因低剂量组比较,利多卡因高剂量组穿膜数减少(P<0.05)。见表1、图1。

注:A为肺癌A549细胞组;B为5-氟尿嘧啶组;C为利多卡因低剂量组;D为利多卡因高剂量组。
2.3各组肺癌A549细胞AMPK、mTOR、4EBP1 mRNA表达水平比较 与肺癌A549细胞组比较,5-氟尿嘧啶组、利多卡因低剂量组、利多卡因高剂量组AMPK mRNA相对表达水平升高,mTOR、4EBP1 mRNA相对表达水平降低(P<0.05);与5-氟尿嘧啶组比较,利多卡因低、高剂量组AMPK mRNA相对表达水平降低,mTOR、4EBP1 mRNA相对表达水平升高(P<0.05);与利多卡因低剂量组比较,利多卡因高剂量组AMPK mRNA相对表达水平升高,mTOR、4EBP1 mRNA相对表达水平降低(P<0.05)。见表2。

表2 各组肺癌A549细胞AMPK、mTOR、4EBP1 mRNA 相对表达水平比较
2.4各组肺癌A549细胞AMPK、mTOR、4EBP1、p-mTOR、p-4EBP1蛋白表达水平比较 与肺癌A549细胞组比较,5-氟尿嘧啶组、利多卡因低剂量组、利多卡因高剂量组AMPK蛋白表达水平升高,mTOR、4EBP1、p-mTOR、p-4EBP1蛋白表达水平降低(P<0.05);与5-氟尿嘧啶组比较,利多卡因低、高剂量组AMPK蛋白表达水平降低,mTOR、4EBP1、p-mTOR、p-4EBP1蛋白表达水平升高(P<0.05);与利多卡因低剂量组比较,利多卡因高剂量组AMPK蛋白表达水平升高,mTOR、4EBP1、p-mTOR、p-4EBP1蛋白表达水平降低(P<0.05)。见表3、图2。

表3 各组肺癌A549细胞AMPK、mTOR、4EBP1、p-mTOR、p-4EBP1蛋白表达水平比较

注:A为肺癌A549细胞组;B为5-氟尿嘧啶组;C为利多卡因低剂量组;D为利多卡因高剂量组。
3 讨 论
局部麻醉在预防癌症转移和复发中起着重要的作用,这可能归因于其抑制了外科手术的应激反应。局部麻醉药不仅可达到神经阻滞、控制疼痛、抗心律失常和消炎的目的,而且还可引起神经元细胞和其他类型细胞的死亡[12],推测局部麻醉药的细胞毒性可能起抗肿瘤作用。研究发现,利多卡因可能是乳腺癌手术的理想浸润麻醉剂,因为它们可以在临床相关浓度下诱导人乳腺癌细胞凋亡,证明了局部麻醉剂的潜在益处[13];随后,在研究利多卡因对胃癌细胞的治疗后发现,高剂量的利多卡因治疗可导致细胞活力和集落形成呈剂量依赖性降低,利多卡因可能通过有丝分裂原激活的蛋白激酶途径诱导癌细胞凋亡[14]。本研究评估了100、200 μmol/L的利多卡因的细胞毒性,发现5-氟尿嘧啶组、利多卡因低剂量组、利多卡因高剂量组A值、存活率低于肺癌A549细胞组,且穿膜数少于肺癌A549细胞组(P<0.05);利多卡因高剂量组A值、存活率、穿膜数低于利多卡因低剂量组,且穿膜数少于利多卡因低剂量组(P<0.05)。这说明,利多卡因对肺癌A549细胞增殖、侵袭具有明显的抑制作用。
AMPK信号传导是癌症中最常见的调控途径之一,AMPK的主要下游靶标是蛋白激酶B(Akt),Akt首先被鉴定为由反转录病毒转导的致癌基因,可诱导胸腺淋巴瘤。Akt在人实体瘤和血液系统恶性肿瘤中经常被过度激活[15]。mTOR是Akt信号通路的关键下游转导因子,通过关键翻译成分的磷酸化将上游营养物质的利用与细胞生长、蛋白质合成的控制联系起来[16]。mTOR与雷帕霉素哺乳动物靶调控相关蛋白或雷帕霉素哺乳动物靶调控敏感蛋白组装在一起,分别产生2个功能不同的复合物,即mTOR复合物1和2(mTORC1、mTORC2)。由mTORC1激活的2个最突出且特征最充分的翻译调节因子是真核细胞翻译起始因子4E(eIF4E)和4EBP1。4EBP1是eIF4E的已知结合伴侣,eIF4E是帽依赖翻译的关键速率限制起始因子,可使4EBP1磷酸化导致其与eIF4E分离,并允许4EBP1在mRNA的5′端形成活性起始复合物。4EBP1对肿瘤的形成极为重要,已被确定为许多类型肿瘤恶性转化的关键转录因子[17-18]。有研究表明,脂联素可通过调节AMPK/mTOR/4EBP1信号通路抑制子宫内膜癌细胞侵袭和迁移[19],灯盏花素可抑制mTOR/4EBP1信号通路激活从而促进肺腺癌细胞凋亡[20]。本研究中,5-氟尿嘧啶组,利多卡因低剂量组、利多卡因高剂量组AMPK mRNA和蛋白表达水平高于肺癌A549细胞组(P<0.05),mTOR、4EBP1 mRNA和蛋白及p-mTOR、p-4EBP1蛋白表达水平低于肺癌A549细胞组(P<0.05);利多卡因高剂量组AMPK mRNA和蛋白表达水平高于利多卡因低剂量组(P<0.05),mTOR、4EBP1 mRNA和蛋白及p-mTOR、p-4EBP1蛋白表达水平低于利多卡因低剂量组(P<0.05),这表明利多卡因促进AMPK mRNA和蛋白表达,进而抑制mTOR、4EBP1 mRNA和蛋白及p-mTOR、p-4EBP1蛋白表达。同时说明,在肺癌A549细胞中,利多卡因通过激活AMPK的表达进而抑制mTOR/4EBP1信号通路的激活。
综上所述,利多卡因对肺癌A549细胞增殖、侵袭具有明显抑制作用,其机制可能与利多卡因通过激活AMPK的表达进而抑制mTOR/4EBP1信号通路的激活有关。
