利多卡因通过LncRNA H19/miR-671-5p 分子轴调控胃癌细胞增殖、迁移及侵袭
2022-08-30谢玉海朵海珍王学军青海红十字医院麻醉科西宁810000
谢玉海 朵海珍 王学军 (青海红十字医院麻醉科,西宁 810000)
胃癌是临床常见的一种恶性肿瘤,其高度的侵袭性及转移能力可提高患者病死率。目前临床主要采用手术等方式进行治疗,但大部分患者确诊时已处于肿瘤晚期,若采用手术、化疗等姑息治疗,患者会出现胃癌转移、耐药性等现象,导致治疗失败,研究表明麻醉药物可用于治疗胃癌并可能改善患者临床症状[1-2]。但麻醉药物在胃癌治疗中的作用机制尚未完全阐明。长链非编码RNA(long noncoding RNA,LncRNA)可充当微小RNA(miRNA)的竞争性内源RNA 从而参与胃癌的发生及发展过程[3]。因而需要探究麻醉药物是否通过调控LncRNA表达从而影响胃癌的发生及发展。利多卡因可抑制乳腺癌细胞迁移[4]。LncRNA H19 在卵巢癌细胞中表达上调,并可促进卵巢癌细胞的迁移及顺铂耐药性的发生[5]。生物信息学分析显示miR-671-5p可能是H19 的靶基因,研究表明miR-671-5p 在胃癌细胞中表达下调,并可通过靶向URGCP抑制胃癌细胞增殖并促进细胞凋亡[6]。因此,本研究主要探讨利多卡因对胃癌细胞增殖、迁移及侵袭的影响,探究其对H19/miR-671-5p 分子轴的靶向调控作用,旨在为进一步阐释利多卡因治疗胃癌的分子机制奠定实验基础。
1 材料与方法
1.1 材料 利多卡因购自山东华鲁制药有限公司(国药准字:H80110255);胃癌细胞AGS 购自美国ATCC细胞库;Lipofectamine2000购自美国Invitrogen公司;miR-671-5p mimics、miR-NC、si-H19、si-NC 购自上海吉玛制药技术有限公司;pcDNA3.1 购自上海柯雷生物科技有限公司;Trizol试剂购自北京全式金生物技术有限公司;反转录与实时荧光定量PCR试剂盒购自北京天根生化科技有限公司;MTT、DMSO 购自美国Sigma公司;Transwell小室购自美国Corning 公司;Matrigel 基质胶购自美国 BD 公司;兔抗人Ki-67、PCNA 抗体购自美国CST 公司;兔抗人E-cadherin、N-cadherin 抗体购自美国 Santa Cruz 公司;HRP标记的山羊抗兔二抗购自美国Abcam公司。
1.2 方法
1.2.1 实验分组 AGS 细胞接种于96 孔板(3×104个/孔),分别使用不同浓度(10、50、100 μmol/L)的利多卡因处理 24 h[7],分别记作利多卡因-L 组、利多卡因-M组、利多卡因-H组。同时将正常培养的细胞作为Con 组。参照Lipofectamine2000 说明书进行转染,分别将 pcDNA、pcDNA-H19 转染至 AGS 细胞,随后使用含100 μmol/L 的利多卡因处理24 h,分别记作利多卡因-H+pcDNA 组、利多卡因-H+pcDNAH19组。
1.2.2 MTT 检测细胞增殖 取对数生长期AGS 细胞(3×105个/ml)按照每孔100 μl的密度接种于96孔板后加入20 μl MTT 溶液,室温孵育4 h 后弃上清,加入150 μl DMSO,室温振荡孵育10 min,酶标仪检测波长490 nm处各孔吸光度值(OD)。
1.2.3 Transwell 实验检测细胞迁移与侵袭 AGS细胞(5×104个/ml)以200 μl/孔接种于Transwell 小室的上室,继续培养24 h后加入多聚甲醛固定20 min,PBS 洗涤,0.1%结晶紫染液染色10 min,棉签擦拭未迁移的细胞,显微镜下观察迁移细胞数。预冷培养液稀释Matrigel 基质胶后加入上室(40 μl/孔),将其放入培养箱内孵育5 h 后加入AGS 细胞,后续实验步骤同细胞迁移实验,观察侵袭细胞数。
1.2.4 qRT-PCR 检测细胞中 H19、miR-671-5p 的表达水平 收集各组处于对数生长期的AGS 细胞,Trizol 法提取细胞中的总RNA,应用Nanodrop2000c超微量分光光度计检测RNA 浓度。参照反转录试剂盒将总RNA 反转录为cDNA。以cDNA 为模板进行qRT-PCR 反应,参照实时荧光定量PCR 试剂盒配置反应体系及设置反应程序,应用罗氏LightCycler480 荧光定量 PCR 仪检测 H19、miR-671-5p 的相对表达量。
1.2.5 双荧光素酶报告基因检测H19 的靶基因starBase 预测显示 H19 与 miR-671-5p 存在结合位点,构建野生型载体WT-H19、突变型载体MUT-H19后,分别与 miR-NC、miR-671-5p mimics 共转染至AGS细胞,继续培养24 h后检测相对荧光素酶活性。
1.2.6 Western blot 检测 Ki-67、PCNA、E-cadherin、N-cadherin 蛋白表达 AGS 细胞加入 RIPA 裂解液提取细胞总蛋白,SDS-PAGE 分离蛋白后转移至PVDF膜,封闭,分别加入一抗稀释液(1∶1 000),4 ℃孵育24 h 后使用TBST 洗涤,分别加入二抗稀释液(1∶5 000),室温孵育 1 h 后使用 TBST 洗涤,滴加ECL,暗室内曝光显影,应用Image J 软件分析各条带灰度值。
1.3 统计学处理 采用SPSS21.0统计学软件分析数据,计量资料以表示,数据进行正态分布检验及组间方差齐性检验,符合正态分布及方差齐性,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 利多卡因对胃癌细胞AGS 增殖的影响 与Con 组相比,利多卡因-L 组、利多卡因-M 组、利多卡因-H 组细胞活力显著降低(P<0.05),Ki-67、PCNA蛋白水平显著降低(P<0.05),且利多卡因-L 组、利多卡因-M 组、利多卡因-H 组细胞活力、Ki-67、PCNA蛋白水平比较差异均有统计学意义(P<0.05),见图1、表1。
表1 利多卡因对胃癌细胞AGS增殖的影响(,n=9)Tab.1 Effect of lidocaine on proliferation of gastric cancer cell AGS(,n=9)
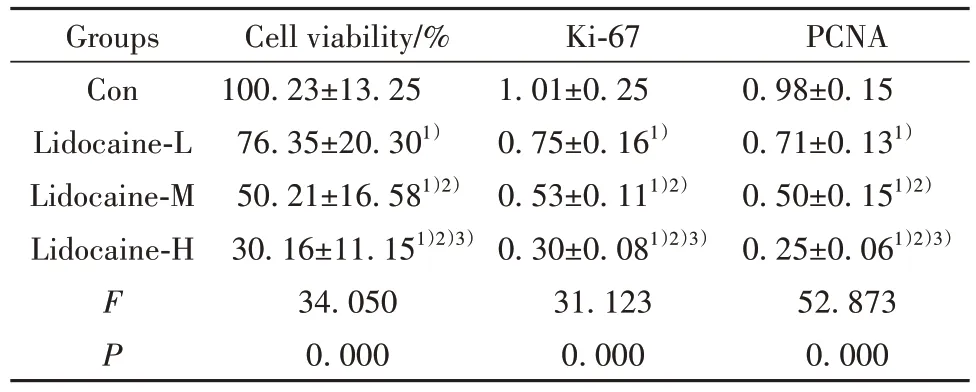
表1 利多卡因对胃癌细胞AGS增殖的影响(,n=9)Tab.1 Effect of lidocaine on proliferation of gastric cancer cell AGS(,n=9)
Note:Compared with Con group,1)P<0.05;compared with Lidocaine-L group,2)P<0.05;compared with Lidocaine-M group,3)P<0.05.
PCNA 0.98±0.15 0.71±0.131)0.50±0.151)2)0.25±0.061)2)3)52.873 0.000 Groups Con Lidocaine-L Lidocaine-M Lidocaine-H F P Cell viability/%100.23±13.25 76.35±20.301)50.21±16.581)2)30.16±11.151)2)3)34.050 0.000 Ki-67 1.01±0.25 0.75±0.161)0.53±0.111)2)0.30±0.081)2)3)31.123 0.000
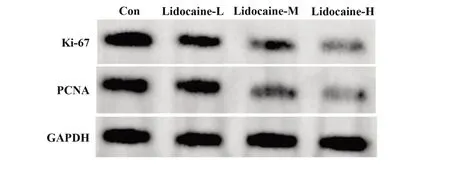
图1 利多卡因对AGS细胞Ki-67、PCNA蛋白表达的影响Fig.1 Effects of lidocaine on protein expressions of Ki-67 and PCNA in AGS cells
2.2 利多卡因对胃癌细胞AGS 迁移及侵袭的影响 与Con 组相比,利多卡因-L 组、利多卡因-M 组、利多卡因-H 组迁移细胞数及侵袭细胞数显著减少(P<0.05),E-cadherin 蛋白水平显著升高(P<0.05),N-cadherin 蛋白水平显著降低(P<0.05),且利多卡因-L组、利多卡因-M组、利多卡因-H组迁移细胞数、侵袭细胞数及E-cadherin、N-cadherin 蛋白水平比较差异均有统计学意义(P<0.05),见图2、表2。
表2 利多卡因对胃癌细胞AGS迁移及侵袭的影响(,n=9)Tab.2 Effect of lidocaine on migration and invasion of gastric cancer cell AGS(,n=9)

表2 利多卡因对胃癌细胞AGS迁移及侵袭的影响(,n=9)Tab.2 Effect of lidocaine on migration and invasion of gastric cancer cell AGS(,n=9)
Note:Compared with Con group,1)P<0.05;compared with Lidocaine-L group,2)P<0.05;compared with Lidocaine-M group,3)P<0.05.
N-cadherin 1.01±0.16 0.72±0.111)0.53±0.121)2)0.28±0.041)2)3)63.665 0.000 Groups Con Lidocaine-L Lidocaine-M Lidocaine-H F P Number of migration cells 125.24±16.32 92.31±12.241)63.22±11.251)2)36.32±10.021)2)3)81.830 0.000 Number of invasion cells 97.65±11.26 70.32±13.241)51.26±15.231)2)31.24±10.051)2)3)45.354 0.000 E-cadherin 0.52±0.13 0.78±0.111)0.92±0.131)2)1.05±0.081)2)3)35.444 0.000
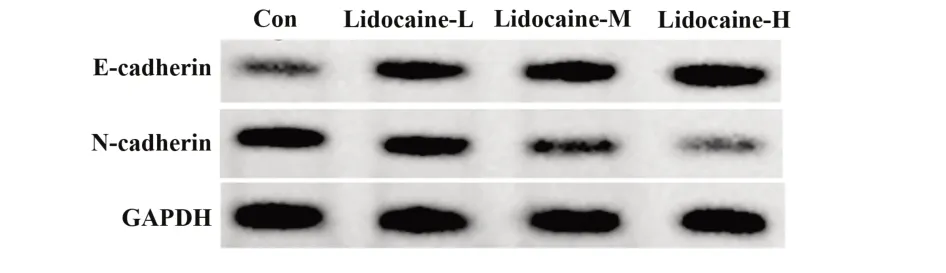
图2 利多卡因对 AGS 细胞 E-cadherin、N-cadherin 蛋白表达的影响Fig.2 Effects of lidocaine on expressions of E-cadherin and N-cadherin protein in AGS cells
2.3 利多卡因对胃癌细胞AGS 中H19、miR-671-5p表达量的影响 与Con组相比,利多卡因-L组、利多卡因-M组、利多卡因-H组细胞中H19表达显著降低(P<0.05),miR-671-5p 表达显著升高(P<0.05),且利多卡因-L 组、利多卡因-M 组、利多卡因-H 组细胞中H19、miR-671-5p 的表达量比较差异有统计学意义(P<0.05),见表3。
表3 利多卡因对胃癌细胞AGS中H19、miR-671-5p表达的影响(,n=9)Tab.3 Effect of lidocaine on expressions of H19 and miR-671-5p in gastric cancer cell AGS(,n=9)

表3 利多卡因对胃癌细胞AGS中H19、miR-671-5p表达的影响(,n=9)Tab.3 Effect of lidocaine on expressions of H19 and miR-671-5p in gastric cancer cell AGS(,n=9)
Note:Compared with Con group,1)P<0.05;compared with Lidocaine-L group,2)P<0.05;compared with Lidocaine-M group,3)P<0.05.
miR-671-5p 1.00±0.12 1.65±0.131)2.52±0.201)2)3.02±0.241)2)3)225.689 0.000 Groups Con Lidocaine-L Lidocaine-M Lidocaine-H F P H19 1.01±0.13 0.71±0.111)0.52±0.121)2)0.30±0.091)2)3)63.309 0.000
2.4 H19 靶向调控miR-671-5p starBase 预测显示H19 的序列中含有与miR-671-5p 互补的核苷酸序列,见图3。双荧光素酶报告实验结果显示,共转染野生型载体WT-H19 的细胞实验中,与miR-NC 组相比,miR-671-5p 组荧光素酶活性显著降低(P<0.05);共突变型载体MUT-H19的细胞实验中,miR-671-5p 组荧光素酶活性与miR-NC 组比较差异无统计学意义(P>0.05),见表4。与si-NC组相比,si-H19组细胞中miR-671-5p 表达水平显著升高(P<0.05);与 pcDNA 组相比,pcDNA-H19 组细胞中 miR-671-5p表达水平显著降低(P<0.05),见表5。
表4 双荧光素酶报告实验(,n=9)Tab.4 Double luciferase report experiment(,n=9)
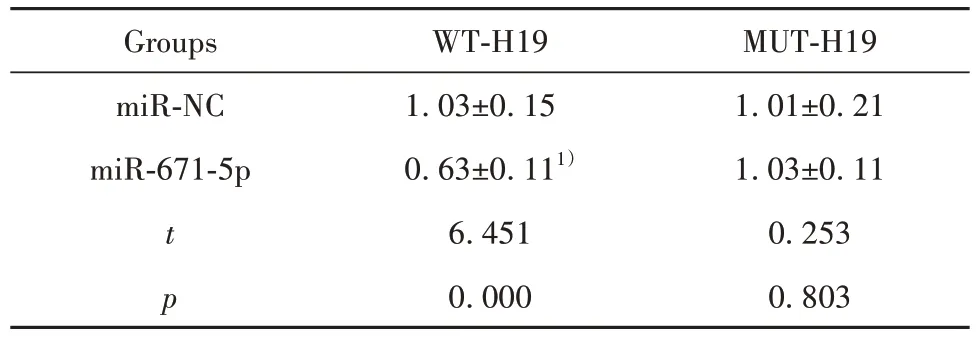
表4 双荧光素酶报告实验(,n=9)Tab.4 Double luciferase report experiment(,n=9)
Note:Compared with miR-NC group,1)P<0.05.
MUT-H19 1.01±0.21 1.03±0.11 0.253 0.803 Groups miR-NC miR-671-5p t p WT-H19 1.03±0.15 0.63±0.111)6.451 0.000
表5 H19靶向调控miR-671-5p的表达(,n=9)Tab.5 H19 target regulate expression of miR-671-5p(,n=9)
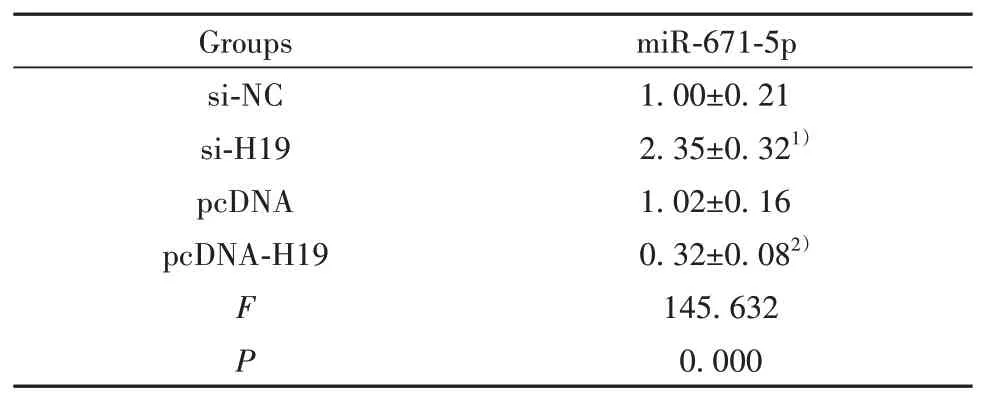
表5 H19靶向调控miR-671-5p的表达(,n=9)Tab.5 H19 target regulate expression of miR-671-5p(,n=9)
Note:Compared with si-NC group,1)P<0.05;compared with pcDNA group,2)P<0.05.
miR-671-5p 1.00±0.21 2.35±0.321)1.02±0.16 0.32±0.082)145.632 0.000 si-NC si-H19 pcDNA pcDNA-H19 F P Groups
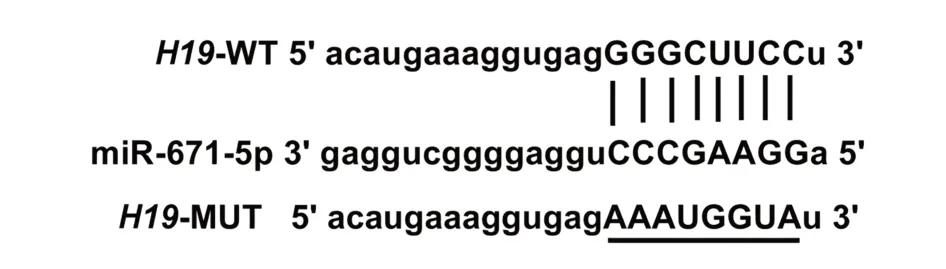
图3 H19的序列中含有与miR-671-5p互补的核苷酸序列Fig.3 Sequence of H19 contains a nucleotide sequence complementary to miR-671-5p
2.5 H19 过表达减弱利多卡因对胃癌细胞AGS 增殖的抑制作用 与利多卡因-H+pcDNA 组相比,利多卡因-H+pcDNA-H19 组细胞活力显著升高(P<0.05),Ki-67、PCNA 蛋白水平显著升高(P<0.05),见图4、表6。
表6 H19过表达减弱利多卡因对胃癌细胞AGS增殖的抑制作用(,n=9)Tab.6 H19 overexpression attenuated inhibitory effect of lidocaine on proliferation of gastric cancer cell AGS(,n=9)
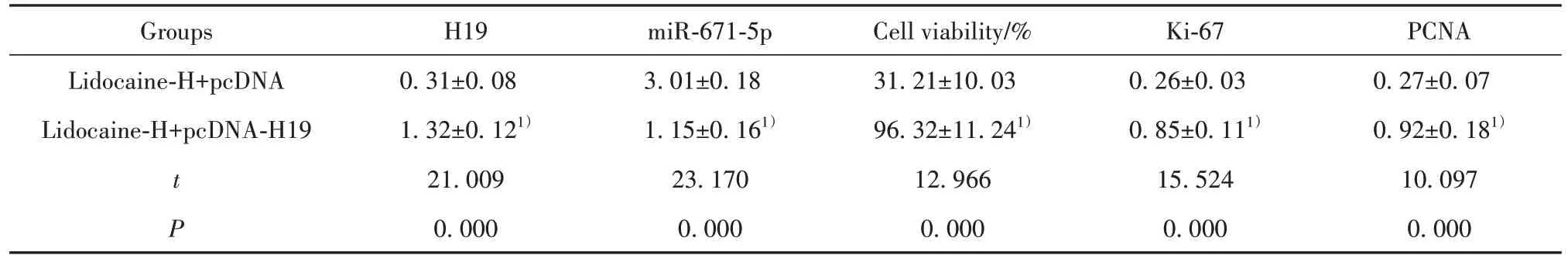
表6 H19过表达减弱利多卡因对胃癌细胞AGS增殖的抑制作用(,n=9)Tab.6 H19 overexpression attenuated inhibitory effect of lidocaine on proliferation of gastric cancer cell AGS(,n=9)
Note:Compared with Lidocaine-H+pcDNA group,1)P<0.05。
PCNA 0.27±0.07 0.92±0.181)10.097 0.000 Groups Lidocaine-H+pcDNA Lidocaine-H+pcDNA-H19 t P H19 0.31±0.08 1.32±0.121)21.009 0.000 miR-671-5p 3.01±0.18 1.15±0.161)23.170 0.000 Cell viability/%31.21±10.03 96.32±11.241)12.966 0.000 Ki-67 0.26±0.03 0.85±0.111)15.524 0.000
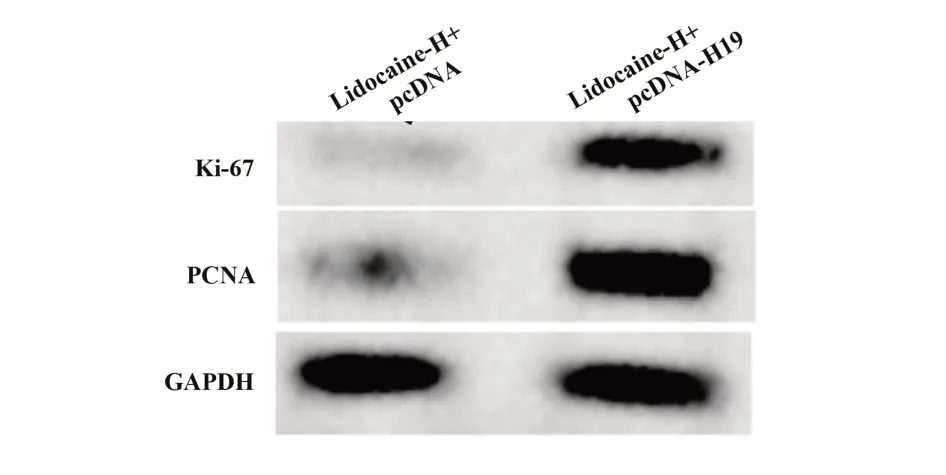
图4 Western blot检测Ki-67、PCNA蛋白表达Fig.4 Western blot was used to detect expressions of Ki-67 and PCNA protein
2.6 H19 过表达减弱利多卡因对胃癌细胞AGS 迁移及侵袭的抑制作用 与利多卡因-H+pcDNA 组相比,利多卡因-H+pcDNA-H19 组迁移细胞数及侵袭细胞数显著增多(P<0.05),E-cadherin 蛋白水平显著降低(P<0.05),N-cadherin 蛋白水平显著升高(P<0.05),见图5、表7。
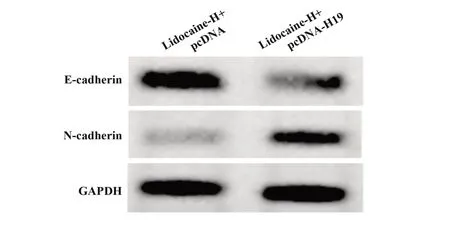
图5 Western blot检测E-cadherin、N-cadherin蛋白表达Fig.5 Western blot was used to detect expressions of E-cadherin and N-cadherin protein
表7 H19过表达减弱利多卡因对胃癌细胞AGS迁移及侵袭的抑制作用(,n=9)Tab.7 H19 overexpression attenuated inhibitory effect of lidocaine on migration and invasion of gastric cancer cell AGS(,n=9)

表7 H19过表达减弱利多卡因对胃癌细胞AGS迁移及侵袭的抑制作用(,n=9)Tab.7 H19 overexpression attenuated inhibitory effect of lidocaine on migration and invasion of gastric cancer cell AGS(,n=9)
Note:Compared with Lidocaine-H+pcDNA group,1)P<0.05.
N-cadherin 0.29±0.06 0.78±0.131)10.267 0.000 Groups Lidocaine-H+pcDNA Lidocaine-H+pcDNA-H19 t p Number of migrating cells 39.32±10.12 98.65±13.241)10.681 0.000 Number of invasion cells 31.58±10.11 85.42±11.291)10.658 0.000 E-cadherin 1.03±0.05 0.56±0.111)11.669 0.000
3 讨论
利多卡因可通过调节LncRNA-MEG3/miR-421/BTG1 分子轴抑制宫颈癌细胞增殖并诱导细胞凋亡[8];通过调节miR-539/EGFR 分子轴抑制肺癌细胞的增殖和转移[9];通过上调 miR-145 表达抑制胃癌细胞的生长、迁移和侵袭[10]。本研究结果显示,不同浓度的利多卡因处理后胃癌细胞活力显著降低,提示利多卡因可抑制胃癌细胞增殖。上皮-间质转化(EMT)与肿瘤细胞迁移及侵袭密切相关,其中上皮型标志物为E-cadherin,E-cadherin 表达下调可促进EMT 的发生从而促进肿瘤细胞转移,间充质细胞标志物N-cadherin表达下调可抑制EMT的发生从而抑制肿瘤细胞转移[11]。本研究结果显示,不同浓度的利多卡因处理后胃癌细胞迁移及侵袭能力显著降低,E-cadherin 表达上调,N-cadherin 表达下调,且呈利多卡因剂量依赖性,提示利多卡因可抑制胃癌细胞的迁移及侵袭。
H19在胃癌细胞中表达水平升高并可促进细胞生长[12];在多发性骨髓瘤细胞中表达上调并可通过激活BRD4 信号通路促进多发性骨髓瘤发生[13]。miR-671-5p在胃癌细胞中表达下调,circPIP5K1A可充当miR-671-5p 的海绵分子从而促进胃癌的发展进程[14]。本研究通过双荧光素酶报告实验证实H19可靶向结合miR-671-5p。本研究结果显示,不同浓度的利多卡因处理后胃癌细胞中H19 表达下调,而miR-671-5p 表达上调,且呈利多卡因剂量依赖性,而H19 过表达可减弱利多卡因对胃癌细胞增殖、迁移及侵袭的抑制作用。
综上所述,利多卡因可抑制胃癌细胞的增殖、迁移及侵袭,其可能是通过下调H19 表达及上调miR-671-5p 表达发挥作用,可为进一步揭示利多卡因抗胃癌的作用机制提高理论依据,并可为胃癌的治疗提供新方向。
