黑豆种皮花色苷酶法辅助提取工艺优化及其抗氧化活性分析
2022-02-19张宽朝汪炜姿汤雲星罗会涛王康威
张宽朝,汪炜姿,余 平,汤雲星,罗会涛,王康威
安徽农业大学生命科学学院,合肥 230036
黑豆,别名乌豆、冬豆子、橹豆等,是豆科植物大豆Glycinemax(L.) Merr的干燥成熟黑色种子,其环境适应性强,抗旱耐瘠,能在绝大多数地方,甚至是盐碱地种植[1,2]。黑豆在我国种植面积较广,且区域性分布相对集中,黑龙江、安徽、山西等地种植较为普遍,资源丰富,类型多样[1,3]。黑豆是著名的传统药食同源农产品,富含不饱和脂肪酸、蛋白质、维生素、多糖、异黄酮等生物活性物质[4,5]。黑豆种皮呈黑红色或紫红色,有光泽,薄而脆,易破碎,含有膳食纤维、维生素、色素、多糖、黄酮等多种活性物质[6,7]。黑豆种皮中的花色苷不仅赋予了黑豆的颜色,而且对人体有着多种保健功效,可以抗氧化、润肠通便、保护肝脏、预防糖尿病、降血糖、降血脂、改善记忆力、保护视力、抗肿瘤、预防和治疗哮喘等[8,9]。
花色苷提取技术的逐步改良,为其工业化应用提供了基础,使其得以广泛用于新型化妆品、医疗保健、食品、天然染料等行业领域[10]。黑豆种皮花色苷传统提取方法主要有水提法、有机溶剂提取法等,但这些方法存在着提取时间长、溶剂消耗量大、提取率低、花色苷稳定性差等缺点[11]。近年来,超声辅助提取[12]、微波辅助提取[13]、离子液体提取[14]等方法因具有提取时间短、提取率更高等特点在黑豆种皮花色苷研究中进行了探索。已有研究发现,生物酶法辅助提取花色苷等生物活性物质具有低能耗、高性价比以及提取产物稳定性及活性高等优势[15],但生物酶法辅助提取黑豆种皮花色苷的研究尚未见报道。本研究采用生物酶法辅助提取黑豆种皮花色苷,并以花色苷含量为指标,通过响应面法优化花色苷提取工艺,同时体外试验分析黑豆种皮花色苷提取液的抗氧化活性,以期为黑豆种皮花色苷的提取、综合开发利用提供理论和技术参考。
1 材料与方法
1.1 材料
1.1.1 样品
黑豆种皮,购自安徽亳州,批号20191209,粉碎,过100目筛,备用。
1.1.2 试剂
纤维素酶(最适pH4.8、最适温度50 ℃,上海源叶生物科技有限公司);α-淀粉酶(最适pH6.0、最适温度60 ℃,上海源叶生物科技有限公司);无水乙醇、ABTS、过硫酸钾、1,1-二苯基-2-三硝基苯肼、磷酸二氢钠、磷酸氢二钠、氯化钠、铁氰化钾、三氯乙酸、氯化铁、三羟甲基氨基甲烷、邻苯三酚、抗坏血酸、浓盐酸、对氨基苯磺酸、盐酸萘乙二胺、亚硝酸钠等均为国产分析纯。
1.1.3 仪器
722型可见分光光度计(上海光谱仪器有限公司);HH-2型数显恒温水浴锅(常州普天仪器制造有限公司);YP3002型电子天平(上海佑科仪器仪表有限公司);L-600型低速离心机(湖南湘仪实验室仪器开发有限公司);UV-1600型紫外可见分光光度计(北京瑞利分析仪器公司);FW-100型粉碎机(天津市泰斯特仪器有限公司)。
1.2 方法
1.2.1 黑豆种皮花色苷提取与含量分析
参考Zhao等[16]法进行黑豆种皮花色苷提取与含量测定。
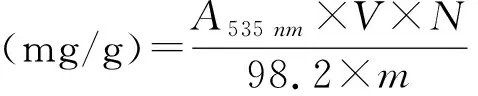
式中,V:定容体积(mL);N:稀释倍数;98.2:花色苷在535 nm处的平均消光系数;m:黑豆种皮质量(g)。
1.2.2 不同酶解方法对黑豆种皮花色苷提取影响
准确称取0.30 g黑豆种皮粉末,按照液料比25∶1 mL/g加入体积分数为65%的乙醇,分别加入纤维素酶400 U/g、α-淀粉酶50 U/g、复合酶(纤维素酶400 U/g +α-淀粉酶50 U/g),50 ℃恒温水浴浸提60 min,4 000 rpm离心10 min,取上清液535 nm处测定吸光度值[16]。以与乙醇等量的纯水(不加酶)为空白对照。
1.2.3 单因素试验
准确称取0.30 g的黑豆种皮粉末、一定量复合酶,分别考察温度(30、40、50、60、70 ℃)、液料比(15∶1、20∶1、25∶1、30∶1、35∶1 mL/g)、乙醇体积分数(55%、60%、65%、70%、75%、80%)、酶解时间(20、40、60、80、100 min)对黑豆种皮花色苷生物酶法辅助提取的影响。温度、液料比、乙醇体积分数、酶解时间四个因素的固定水平分别为50 ℃、25∶1 mL/g、65%、60 min。在对各因素进行单因素试验时,其他因素及相应水平固定。
1.2.4 响应面试验优化
根据以上单因素试验结果,以花色苷含量(Y)为响应值,选择复合酶酶解,选取液料比(A)、酶解温度(B)、乙醇体积分数(C)、酶解时间(D)四个因素为自变量,进行响应面分析试验。响应曲面优化设计因素与水平见表1。

表1 响应曲面优化设计因素与水平
1.2.5 黑豆种皮花色苷抗氧化活性测定
1.2.5.1 黑豆种皮花色苷还原能力分析
参考Hao等[17]方法。吸取不同浓度花色苷提取液各2.5 mL,分别加入2.5 mL pH6.6磷酸盐缓冲液、2.5 mL 1%K4[Fe(CN)6]溶液,混匀,50 ℃水浴20 min,再加入2.5 mL 10%的三氯乙酸溶液,混匀,300 0 rpm离心10 min,取上清液3 mL加入3 mL纯水和0.5 mL 0.1% FeCl3溶液,混匀,700 nm处测定吸光度。以抗坏血酸为对照。
1.2.5.2 黑豆种皮花色苷对超氧阴离子自由基清除能力测定
采用邻苯三酚法[18]。取4.5 mL 0.05 mol/L Tris-HC1缓冲溶液(pH8.2),加入1 mL不同浓度的花色苷提取液和0.1 mL 6 mmol/L的邻苯三酚溶液,混匀,暗处反应5 min,在299 nm处测定吸光度Ai,以等体积的纯水代替邻苯三酚,测量吸光度Ai0;以等体积乙醇浸取液代替试样溶液测得A0。以抗坏血酸为对照。
1.2.5.3 黑豆种皮花色苷对亚硝酸根离子清除能力测定
参考Li等[19]方法。吸取不同浓度花色苷提取液各2 mL,分别与2 mL 5 mg/L NaNO2溶液混合均匀,25 ℃水浴30 min后,加入1 mL 4 g/L对氨基苯磺酸溶液,摇匀,25 ℃水浴5 min后,再加入1mL 2 g/L盐酸萘乙二胺溶液,摇匀,25 ℃水浴15 min,538 nm处测定吸光度Ax。空白对照液吸光度记为A0,花色苷提取液本底吸光度记为Axo。以抗坏血酸为对照。
1.2.5.4 黑豆种皮花色苷对DPPH自由基清除能力测定
参考Wang等[20]方法。吸取不同浓度花色苷提取液各2 mL,加入2 mL 0.1 mol/L DPPH溶液,摇匀,暗处反应30 min,517 nm处测定吸光度Ai;用2 mL 70%乙醇分别代替DPPH溶液和花色苷试样液,重复上述操作,分别测定吸光度Aj、A0。以抗坏血酸为对照。
1.2.5.5 黑豆种皮花色苷对ABTS自由基清除能力测定
参考Yan等[21]方法。配制ABTS储备液:分别配制7 mmol/L ABTS溶液和4.9 mmol/L过硫酸钾溶液,等体积混合均匀,室温暗处静置12~16 h后备用。使用时稀释至其稀释液在734 nm处的吸光度为0.7±0.02。
吸取不同浓度花色苷提取液各2 mL,加入4 mL ABTS稀释溶液,振荡摇匀,室温暗处静置6 min,724 nm处测定吸光值Ai;用浸提体系的乙醇分别代替花色苷试样液和ABTS稀释溶液,重复上述操作,测定吸光度A0和Aj。以抗坏血酸为对照。
1.3 数据处理
所有试验均重复3次。Microsoft Excel 2016绘制图表,Design Expert 10.0软件进行响应面优化试验的设计、多元回归拟合分析及工艺参数优化,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 不同酶解方法对黑豆种皮花色苷提取的影响
不同酶解方法对黑豆种皮花色苷提取的影响如图1所示。可以看出,α-淀粉酶和纤维素酶对提高黑豆种皮花色苷的提取量都有明显效果,且纤维素酶的酶解效果略优于α-淀粉酶。复合酶对黑豆种皮花色苷辅助提取的效果最好,可达未加酶条件下的近2倍。因此,本试验后续选用纤维素酶和α-淀粉酶混合而成的复合酶辅助提取黑豆种皮花色苷,并结合纤维素酶、α-淀粉酶的单一酶解进一步探讨具体试验参数优化。

图1 不同酶解方法对黑豆种皮花色苷提取的影响Fig.1 Effect of different enzymolysis methods on extraction of anthocyanins from black bean seed coat
2.2 温度对黑豆种皮花色苷生物酶法辅助提取的影响
温度对黑豆种皮花色苷生物酶法辅助提取的影响如图2所示。分析可知,在试验范围内,以α-淀粉酶、纤维素酶、复合酶辅助提取黑豆种皮花色苷含量均随温度的增加呈先上升后下降的趋势。这可能是因为温度太低时酶的催化活性过低,不利于花色苷的溶出。随着温度的升高,酶的催化活性逐渐增强,同时细胞膜的通透性也随之提高,酶辅助花色苷提取的速率加快,花色苷含量上升。当温度为50 ℃时,三种酶解方法辅助提取的花色苷含量都达到最大,复合酶的辅助提取效果优于α-淀粉酶、纤维素酶,达到2.203 mg/g。随着温度的继续升高,花色苷因不稳定而分解,同时,酶的活性下降甚至失活,花色苷提取含量逐渐降低。

图2 温度对黑豆种皮花色苷生物酶法辅助提取的影响Fig.2 Effect of temperature on enzymatic extraction of anthocyanins from black bean seed coat
2.3 液料比对黑豆种皮花色苷生物酶法辅助提取的影响
液料比对黑豆种皮花色苷生物酶法辅助提取的影响如图3所示。可以看出,在液料比为25∶1 mL/g时,α-淀粉酶、纤维素酶、复合酶辅助提取黑豆种皮花色苷含量达到最大,复合酶辅助提取最高达到2.217 mg/g。其后花色苷提取含量随液料比的增加而减少,可能由于随着液料比的增加,提取体系中酶的浓度减小,酶活性降低,酶的辅助提取效能减弱,不利于花色苷溶出[16]。

图3 液料比对黑豆种皮花色苷生物酶法辅助提取的影响Fig.3 Effect of liquid to material ratio on enzymatic extraction of anthocyanins from black bean seed coat
2.4 乙醇体积分数对黑豆种皮花色苷生物酶法辅助提取的影响
生物酶法辅助提取黑豆种皮花色苷提取含量随乙醇体积分数的增加呈先上升后下降的趋势(图4)。在乙醇体积分数为65%时,花色苷含量均达到最高,复合酶辅助提取的花色苷含量为2.043 mg/g。这可能由于花色苷溶于乙醇,当乙醇体积分数增大时,花色苷溶解速度加快,花色苷含量增加,乙醇体积分数为65%时最大;之后乙醇体积分数继续增大,α-淀粉酶、纤维素酶的活性受到抑制甚至变性失活,同时,反应体系中的蛋白质、糖类等大分子物质发生凝聚反应,影响花色苷的析出,导致花色苷含量下降。
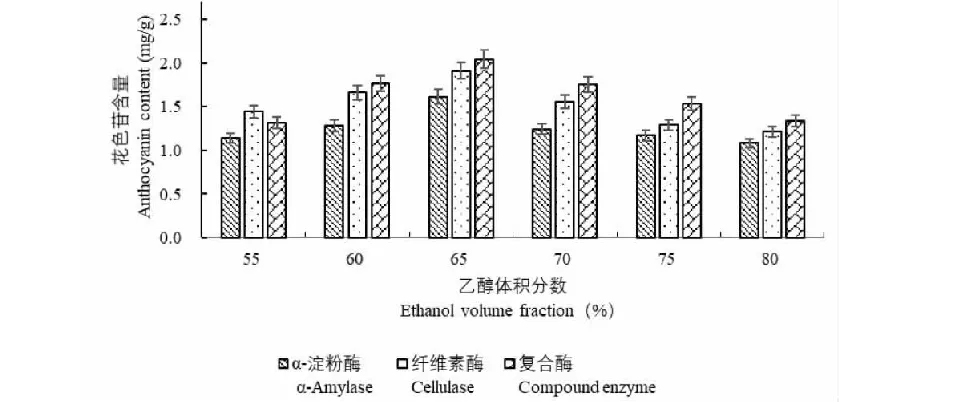
图4 乙醇体积分数对黑豆种皮花色苷生物酶法辅助提取的影响Fig.4 Effect of ethanol volume fraction on enzymatic extraction of anthocyanins from black bean seed coat
2.5 酶解时间对黑豆种皮花色苷生物酶法辅助提取影响
酶解时间对黑豆种皮花色苷生物酶法辅助提取的影响见图5。分析发现,当酶解时间为60 min时,黑豆种皮花色苷提取含量均最高,其中复合酶辅助提取的花色苷含量为2.016 mg/g。酶解时间大于60 min时,α-淀粉酶、纤维素酶、复合酶辅助提取黑豆种皮花色苷含量虽略有下降,但下降幅度相对平稳。这一结果可能是由于短时间内生物酶没有得到充分利用,花色苷在溶液中溶解不充分,而随着酶解时间增大,生物酶作用能力逐渐增强,花色苷更多地溶解于溶液,其含量逐渐提高,但随着酶解时间的进一步延长,花色苷易氧化分解,导致含量下降。
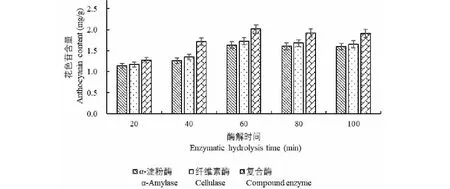
图5 酶解时间对黑豆种皮花色苷生物酶法辅助提取的影响Fig.5 Effect of enzymolysis time on enzymatic assisted extraction of anthocyanins from black bean seed coat
2.6 响应面法优化复合酶辅助提取黑豆种皮花色苷工艺
2.6.1 响应面分析
根据单因素试验结果,选择复合酶酶解,响应面设计试验的结果见表2,方差分析见表3,并对试验所得数据进行多元回归拟合,得到黑豆种皮花色苷含量(Y)对液料比(A)、酶解温度(B)、乙醇体积分数(C)、酶解时间(D)的回归方程为:Y=2.06+0.082A-0.049B-0.053C+0.030D-0.067AB-0.029AC+0.023AD-0.087BC+0.040BD+0.077CD-0.18A2-0.24B2-0.21C2-0.15D2。
表2 响应面试验设计及结果分析
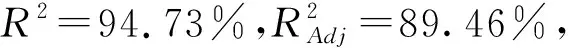
该回归模型能较好反映各因素与响应值之间的关系。根据表3所得P值大小得出所选因素对花色苷含量的影响的强弱程度顺序为:液料比>乙醇体积分数>酶解温度>酶解时间。

表3 回归模型方差分析结果
由回归模型和方差分析可得,方程一次项A、C和二次项A2、B2、C2、D2对提取花色苷含量达到极显著水平。试验中AB(液料比与酶解温度)、BC(酶解温度与乙醇体积分数)和CD(乙醇体积分数与酶解时间)对提取黑豆种皮花色苷含量影响显著,各试验影响因素之间的交互作用响应面图和等高线图见图6~8。因素D、AC、AD、BD对提取花色苷含量影响不显著。

图6 液料比和酶解温度对花色苷含量影响的响应面图(A)及等高线图(B)Fig.6 Response surface (A) and contour (B) of the effects of liquid-solid ratio and enzymolysis temperature on anthocyanin content

图8 乙醇体积分数和酶解时间对花色苷含量影响的响应面图(A)及等高线图(B)Fig.8 Response surface (A) and contour (B) of the effects of ethanol concentration and enzymolysis time on anthocyanin content
2.6.2 最佳工艺验证性试验结果
根据“2.6.1”的回归方程,可得试验范围内生物酶法辅助提取黑豆种皮花色苷最佳条件为:液料比26.3∶1 mL/g、酶解温度48.9 ℃、乙醇体积分数63.9%、酶解时间59.22 min,黑豆种皮花色苷含量理论值为2.074mg/g。结合实际操作调整后优化提取参数:液料比26∶1 mL/g、酶解温度50 ℃、乙醇体积分数64%、酶解时间59 min。在此条件下验证试验得到的实际提取花色苷含量为2.019 mg/g,与理论值比较接近,一定程度上验证了回归模型的有效性。响应面优化提取方法对复合酶提取黑豆种皮花色苷的回归分析有一定参考价值。
2.7 黑豆种皮花色苷抗氧化活性
2.7.1 黑豆种皮花色苷还原能力
试验条件下,随着花色苷提取液和抗坏血酸质量浓度的增加,反应体系在700 nm的吸光值均呈明显上升(见图9),表明黑豆种皮花色苷具有一定还原能力。分析发现,当质量浓度在5~15 μg/mL时,二者吸光值差距逐渐缩小,在15 μg/mL时达到最小,其后又持续增大,表明二者还原能力在15 μg/mL时最接近。吸光值达到0.5时,两者所需样品的有效质量浓度IC50值分别是6.59、5.36 μg/mL,花色苷提取液的还原能力低于对照抗坏血酸。
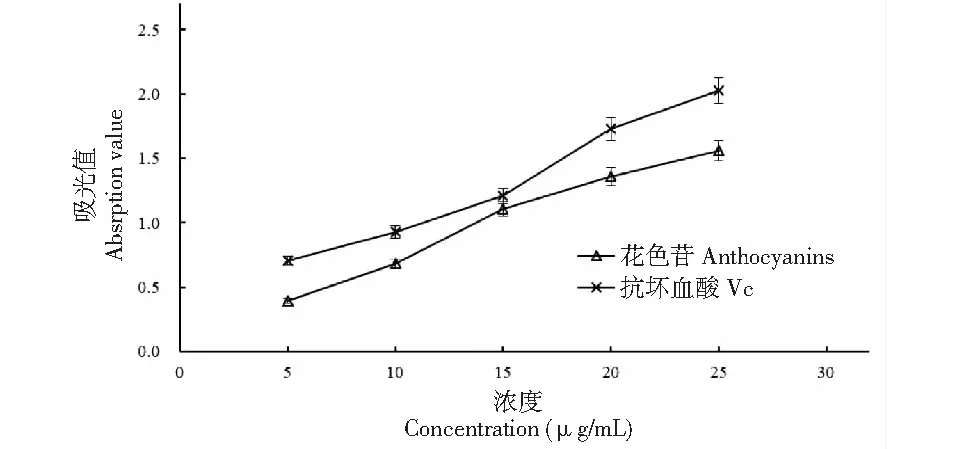
图9 黑豆种皮花色苷还原能力的测定Fig.9 Determination of reducing ability of anthocyanins in black bean seed coat
2.7.2 超氧阴离子自由基清除能力
还原能力的测定表明花色苷具有抗氧化性,为清除自由基试验奠定基础。随着花色苷提取溶液和抗坏血酸质量浓度的增大,对超氧阴离子自由基的清除率逐渐增加,呈平滑式上升(见图10),表明两者对超氧阴离子自由基清除能力的变化规律较为一致。与铁离子还原能力的测定结果相对应,花色苷提取溶液和抗坏血酸通过自身给出电子的还原能力作用捕获并中和自由基。两者对超氧阴离子自由基清除作用的IC50值(清除率为50%时,所需要样品的有效质量浓度)分别为119.07、93.00 μg/mL,试验条件下花色苷提取溶液超氧阴离子自由基清除能力略弱于抗坏血酸。

图10 超氧阴离子自由基清除能力的测定Fig.10 Determination of superoxide anion radical scavenging capacity
2.7.3 亚硝酸根离子清除能力
由图11可以看出,在试验条件下,随着花色苷提取溶液和抗坏血酸质量浓度的增大,其对亚硝酸根离子的清除率也逐渐升高,且清除率均可超过50%,说明二者都能很高效地清除亚硝酸根离子。分析发现,质量浓度较低时,抗坏血酸的清除效果优于花色苷提取溶液,但随着质量浓度的逐渐上升,花色苷提取溶液对亚硝酸根离子清除能力表现出明显的增强。花色苷提取溶液和抗坏血酸对亚硝酸根离子清除作用的IC50值分别为13.66、16.70 μg/mL,表明花色苷提取溶液的亚硝酸根离子清除能力强于抗坏血酸。

图11 亚硝酸根离子清除能力的测定Fig.11 Determination of nitrite ion scavenging capacity
2.7.4 DPPH自由基清除能力
反应体系中的抗氧化剂能给DPPH自由基提供电子和氢原子从而使DPPH自由基溶液发生褪色,褪色程度越大说明清除DPPH自由基的能力越强。质量浓度在10~50 μg/mL范围时,花色苷提取液和抗坏血酸对DPPH自由基有明显的清除作用,且随着样品质量浓度的升高,其清除能力逐渐升高(见图12)。两者对DPPH自由基清除作用的IC50值分别为31.31、36.17 μg/mL,表明试验条件下花色苷提取溶液的DPPH自由基清除能力强于抗坏血酸。

图12 DPPH自由基清除能力的测定Fig.12 Determination of DPPH radical scavenging capacity
2.7.5 ABTS自由基清除能力
试验条件下,花色苷提取溶液对ABTS自由基有明显的清除能力,且随其浓度的增加,清除率也逐渐上升,远高于相同浓度下抗坏血酸对ABTS自由基的清除率(见图13)。花色苷提取溶液和抗坏血酸对ABTS自由基清除作用的IC50值分别为17.63、29.39 μg/mL,进一步验证花色苷提取溶液对ABTS自由基清除效果强于抗坏血酸。

图13 ABTS自由基清除能力的测定Fig.13 Determination of ABTS radical scavenging ability
3 讨论与结论
本试验以乙醇为提取液,对生物酶辅助的方法提取黑豆种皮花色苷进行了工艺优化研究。生物酶法辅助提取植物活性成分具有绿色、无污染、无毒无害等优点,主要根据有效活性成分大多存在于植物细胞的胞质中,可利用纤维素酶、α-淀粉酶等对细胞壁纤维素等的生物降解作用,达到破坏细胞壁的致密结构、实现细胞壁与细胞间质等屏障通透性增强的目的,最大限度促进有效成分由细胞的原生质向提取介质扩散释放,高效提取生物活性物质[22]。
在单因素试验基础上,响应面优化推导最佳提取方案,并进行验证。结果表明,响应面模型回归极显著(P<0.000 1),失拟项不显著(P>0.05),模型可以比较准确地用来预测黑豆种皮花色苷提取含量随各试验因素改变的规律。优化得到的最佳工艺条件:复合酶(纤维素酶400 U/g+α-淀粉酶50 U/g),酶解温度为50 ℃,液料比为26∶1 mL/g,乙醇体积分数64%,酶解时间为59 min。在此试验条件下,提取花色苷含量为2.019 mg/g。
对黑豆种皮花色苷抗氧化性的初步研究表明,黑豆种皮花色苷具有较好的抗氧化性,且表现出剂量效应。在试验范围内,其还原能力、对超氧阴离子自由基清除能力略低于抗坏血酸,但对亚硝酸根离子和DPPH自由基、ABTS自由基清除能力强于抗坏血酸,这与Xu[23]、Wu等[24]研究结果相一致。花色苷抗氧化能力的产生是因为其具有的共轭结构,并且花色苷稳定性和反应性又受到B环上发生羟基化和甲基化程度与位置的不同的影响,进而产生对花色苷抗氧化活性的影响[25]。研究表明,矢车菊素-3-O-葡萄糖苷(C3G)是黑豆种皮花色苷的最主要成分[26],结构中具有酚羟基,可用作为羟基供体,捕捉、结合游离自由基形成稳定的结构,终止自由基链式反应的发生,从而表现出抗氧化能力[27,28]。
试验表明,黑豆种皮花色苷具有较高的药用价值和广泛的应用前景。但生物酶法辅助提取天然有效成分是一个较为复杂的固-液相转移过程,细胞更多内容物的溶出,可能导致更多杂质同步带入粗提物中[29]。黑豆种皮中花色苷含量较高,其花色苷粗提物表现出一定的抗氧化能力,具有开发新的花色苷资源的潜力。花色苷并不是黑豆种皮中唯一的抗氧化物质,因此,后续进一步纯化黑豆种皮花色苷,对深入研究其有效成分、化学结构、理化性质以及确定构效关系具有一定的指导意义。
