非酒精性脂肪肝的继发因素及诊断
2022-02-15王晓琳谢青
王晓琳 谢青
近年来,非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)已成为全世界慢性肝病的首要病因,在成年人群中全球流行率高达25%。肥胖、糖尿病、代谢综合征等是造成NAFLD最常见的因素。2015年美国的数据显示NAFLD导致的全因死亡率、肝脏相关的死亡率和糖尿病相关的死亡率分别为8%、36%和38%。目前欧洲和美国二大国际肝病协会诊断NAFLD之前都需要排除引起肝内脂肪沉积的继发因素或可能的原因包括过多的酒精摄入。2020年,国际专家小组提出将NAFLD更名为代谢相关脂肪性肝病(metabolic associated fatty liver disease,MAFLD),强调了NAFLD的代谢紊乱基础[1]。然而在临床工作中,很多NAFLD的患者并无肥胖、糖尿病、代谢综合征等危险因素。例如,在亚洲,非肥胖NAFLD的患病率高达19%[2]。一方面,相对于MAFLD,继发性脂肪肝在临床并不常见,易于忽略。对这些无明显代谢紊乱因素的NAFLD患者病因的分析是临床工作的一大挑战。另一方面,由于部分继发性脂肪肝可通过针对性的治疗而得以改善,因此对继发性脂肪肝的识别和诊断极为重要。本文综述了继发性NAFLD的常见因素,包括一系列病理生理因素和疾病状态,例如丙型肝炎病毒感染(hepatitis C,HCV)相关的脂肪肝、肠道功能紊乱相关的脂肪肝等,为临床上NAFLD患者的病因评估提供诊疗思路。
一、导致脂肪肝的继发因素
(一)遗传性疾病 一系列遗传性疾病与脂肪肝的发生相关,包括脂代谢异常遗传病(先天性脂肪营养不良 ,无β脂蛋白血症(abetalipoproteinaemia, ABL), 家族性低β脂蛋白血症 (familial hypobetalipoproteinaemia, FHBL),家族性混合型高脂血症(familial combined hyperlipidemia, FCHL)等。
ABL是一种罕见的常染色体隐形遗传疾病。由于MTTP基因变异,造成乳糜微粒以及VLDL组装和分泌障碍,使得甘油三酯聚集在肝细胞内造成脂肪肝。与ABL类似,FHBL是以低密度脂蛋白(low density lipoprotein, LDL)和载脂蛋白水平减低为特征的常染色体隐性遗传病。由于APOB100基因的突变造成肝脏无法合成VLDL,从而导致甘油三酯在肝脏的聚集以及肝细胞脂肪变性。FCHL是常染色体显性遗传病。由于apoB的生成过多导致肝脏合成过多的VLDL,造成肝脏脂肪以及血清脂肪水平的升高。大约50%-75%的FCHL患者具有脂肪肝。
糖原累积症 (Glycogen storage disease, GSD)是由于先天性酶缺陷所致糖原合成和分解紊乱,从而引起肝脏肿大、低血糖、生长发育迟缓、高乳酸血症等临床表现。GSD的患者由于肝脏脂肪酸合成增加而易于发生肝脏脂肪沉积。
脂质营养不良以机体脂肪分布异常或缺少为特征。临床表现包括严重的脂肪组织减少、胰岛素抵抗、糖尿病、高胰岛素血症、高脂血症以及NAFLD[3]。在HIV治疗中如使用高效抗反转录病毒疗法可引起获得性脂质营养不良[4]。临床研究发现,脂肪组织的分布异常和脂肪组织减少可促进脂肪肝的发生发展,这可能是部分非肥胖NAFLD患者潜在的发病机制。
Wilson’s病是由于铜转运ATP酶ATP7B基因突变,造成铜无法通过胆道排泄而沉积在肝脏、神经系统等多种组织中。在肝脏,过多的铜引起线粒体氧化损伤及功能障碍,造成脂肪酸氧化减少,从而促进脂肪肝发生[5]。
此外,近年来研究发现一系列的基因变异与脂肪肝易感性以及脂肪性肝炎、脂肪肝相关肝纤维化、肝硬化以及肝细胞癌密切相关,包括PNPLA3 (patatin like phospholipase domain containing 3), TM6SF2 (transmembrane 6 superfamily member 2), MBOAT7(membrane-bound O-acyltransferase domain-containing-7), GCKR (glucokinase regulatory protein), HSD17B13 (hydroxysteroid 17-beta dehydrogenase-13) 以及MARC1 (mitochondrial amidoxime reducing component-1)等[6]。
PNPLA3与脂肪肝的发生和发展的关系已经在多项研究中被证实。PNPLA3 I148M突变与NAFLD NAS评分、肝脏炎症以及肝脏纤维化正相关,并且是NAFLD患者发生HCC的危险因素[7]。近期的动物实验发现,反义寡核苷酸(ASOs)或小发夹RNA介导的PNPLA3基因沉默可减少肝脏脂质沉积,减轻肝脏炎症和纤维化[8]。针对PNPLA3进行药物靶点研发可能会成为部分NAFLD患者的有效治疗手段。
TM6SF2是另一个与NAFLD易感性相关的重要基因位点。研究发现,TM6SF2 rs58542926 C/T基因变异,由于抑制了甘油三脂的分泌,促进了肝脏的脂质沉积,从而促进NAFLD的发生[9]。此外,TM6SF2与NAFLD的组织学严重程度及脂肪肝相关纤维化的进展密切相关[10]。
(二)药物相关脂肪肝 部分药物在代谢过程中可产生类似于NAFLD的病理生理过程,促进脂肪肝的发生[11]。药物诱导的NAFLD流行率各不相同,据估计,大约有2%的NAFLD病例是由于药物毒性所致。引起脂肪变性和脂肪性肝炎的常见药物包括他莫昔芬、甲氨蝶呤、糖皮质激素、胺碘酮、伊立替康、丙戊酸、四环素、阿司匹林和不同的抗逆转录病毒药物等[6]。这些药物可以引起脂肪性肝炎或加重已存在的原发性NAFLD。他莫昔芬是雌激素受体抑制剂,常应用于乳腺癌的术后治疗,近40%的患者使用他莫昔芬后两年内发生脂肪肝。据报道,应用他莫昔芬的患者脂肪肝的患病风险是健康人群的2~3倍[12]。与没有新辅助化疗相比,在肝结直肠转移切除前使用化疗药物伊立替康治疗增加了脂肪性肝炎的风险。甲氨蝶呤是免疫抑制药物,常用于治疗类风湿性关节炎和其他风湿免疫性疾病。研究证实,甲氨蝶呤促进肝细胞脂肪沉积、肝细胞气球样变、促进炎症以及纤维化[13]。高效抗逆转录病毒疗法(highly active antiretroviral therapy,HAART)被用于治疗HIV感染,大约有40%~50%的应用HAART治疗的患者出现脂质营养不良,导致脂肪肝的发生[4]。糖皮质激素通过以抑制脂肪酸氧化以及促进脂肪酸合成,可促进脂肪肝的发生。同时,糖皮质激素导致的胰岛素抵抗、高胰岛素血症、糖脂代谢紊乱,脂肪组织分解增加等因素促进了脂肪肝的发生、发展。
一系列环境毒物及化学物质亦可引起肝脏脂肪沉积,研究发现,土壤中的重金属,日常所用杀虫剂、杀菌剂及干洗剂等。其作用机制包括破坏机体内分泌调节系统、干扰内分泌激素的功能、改变肝细胞因子的分泌、干扰核受体的代谢调控功能等[14]。
(三)肠道相关脂肪肝 营养不良、肠道通透性增加、小肠细菌过度生长、肠道菌群失调以及肠外营养等肠道疾病促进脂肪肝的发生。例如,乳糜泻 (Celiac disease, CD)的患者在诊断CD一年内发生脂肪肝的风险为健康人群的13倍[15]。慢性营养吸收不良、肠道屏障破坏、低血清胆碱水平以及肠道细菌多样性的降低,均促进了脂肪肝的发生、发展。神经性厌食及严重的营养不良亦可导致脂肪肝。儿童严重的营养不良可造成低蛋白血症以及脂肪肝的发生,其可能与肝脏过氧化物酶体以及线粒体功能紊乱相关。
减肥手术如胃束带术、袖状胃切除术、Roux-en-Y胃旁路术等可有效减轻体重并改善大多数肥胖患者的脂肪肝[16]。但少数病例报道发现减肥术后出现肝功能异常以及脂肪肝加重。其原因可能是由于在肥胖患者,快速的脂肪动员增加肝细胞的氧化应激水平从而引起及加重脂肪肝及肝脏炎症。
大约37%的胰腺切除术后患者可发生脂肪肝,术后营养吸收异常以及营养不良状态可能是这些患者发生脂肪肝的主要原因,适当的胰酶补充治疗可改善此类患者的脂肪肝[17]。此外,短肠综合征,放射性肠炎等因营养吸收障碍而需要静脉营养补充,亦可导致脂肪肝的发生。
(四)内分泌紊乱(除外代谢综合征/糖尿病) 内分泌紊乱例如垂体机能减退、生长激素缺乏以及性激素代谢紊乱等都可促进脂肪肝的发生。有研究报道,下丘脑/垂体机能减退的患者,存在中心性肥胖、胰岛素抵抗以及NAFLD等类似于代谢综合征的临床表现。生长激素缺乏患者通常伴随有脂肪肝、肝功能异常以及高脂血症,而生长激素替代治疗可显著降低血清ALT、AST以及GGT水平以及改善肝脏脂肪沉积、炎症和纤维化。
女性雌激素缺乏以及雄激素过多均可引起代谢紊乱,促进脂肪肝的发生。女性绝经期后NAFLD的患病率显著高于绝经期前,其机制可能是缺乏雌激素的保护作用有关。多囊卵巢综合征(PCOS)与胰岛素抵抗及代谢综合征密切相关,研究发现,PCOS患者发生NAFLD的风险为健康人群的2.5倍左右,高雄激素血症以及肥胖是促进PCOS相关NAFLD发生的主要危险因素。
多数研究认为,甲状腺机能减退通常伴随着肥胖、高脂血症、胰岛素抵抗以及NAFLD 的发生,但这一观点仍有争论[18]。临床试验提示,甲状腺受体激动剂可能成为脂肪肝的新的有效手段。例如,最近的研究发现,应用肝脏选择性的甲状腺激素受体β 激动剂resmetirom可减少60% NAFLD患者的肝脏脂肪含量,且56% NAFLD患者的NAS评分降低了2分以上[19]。甲状腺激素受体激动剂的应用为NAFLD的治疗提供了新的思路。
(五)丙型肝炎病毒(hepatitis C,HCV)相关脂肪肝 HCV,特别是基因3型HCV病毒感染与脂肪肝密切相关。脂质对HCV病毒复制、组装以及血液循环至关重要。 HCV感染可通过多种途径干扰脂代谢,包括抑制VLDL分泌,促进脂质合成以及抑制脂质氧化。据报道,慢性丙型病毒性肝炎中脂肪肝的患病率约为40%~80%。在基因3型慢性丙型病毒性肝炎患者,脂肪肝的严重程度与病毒载量呈正相关并且抗病毒治疗后脂肪肝可明显改善[20]。
二、 继发性脂肪肝的诊断
在临床工作中,大多数NAFLD伴随着糖脂代谢紊乱以及代谢综合征。对NAFLD的诊断,所有人应排除继发性脂肪肝的常见因素。特别是当患者无明显代谢综合征表现时,应考虑其他导致的继发性NAFLD(图1)[6]。通过详细的病史询问及体格检查,可排查是否存在营养或肠道相关以及药物或环境毒物相关的继发性脂肪肝。女性需检查有无PCOS的症状及体征。常规筛查抗HCV抗体、血清铜、血清TSH水平等指标易于鉴别NAFLD继发因素的鉴别。由肿瘤、脑弓形体病或其他感染引起的垂体功能减退也是导致继发性NAFLD的罕见原因。对无明确病因的患者可进行基因检测,明确有无NAFLD易感性基因突变以及先天性遗传性疾病。肥胖儿童中NAFLD的流行率已上升至28%,除了超重和肥胖儿童,瘦儿童也应排除NAFLD的继发原因。18%的NAFLD肥胖儿童中有继发原因,因此,NAFLD患者体质量减轻后肝酶仍未正常的儿童,仍须排除继发因素。非常瘦的儿童应检查脂营养不良。腹部超声检查以排除解剖学异常,并及时发现门脉高压。也可以考虑肝脏活检以助于诊断。
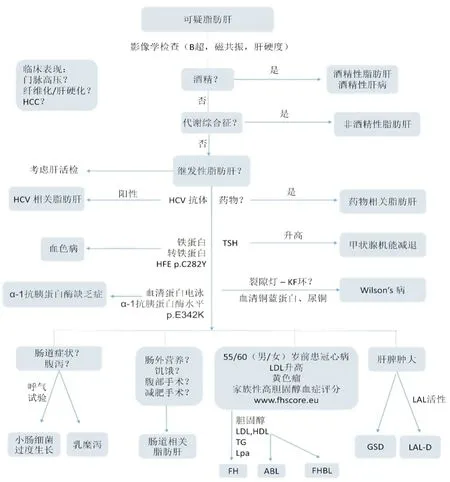
ABL:无β脂蛋白血症; FH:家族性高脂蛋白血症;FHBL:家族性低β脂蛋白血症;GSD:糖原累积症; HCC:肝细胞肝癌;HDL:高密度脂蛋白; LAL:溶酶体酸性脂肪酶; LAL-D:溶酶体酸性脂肪酶缺乏症; LDL:低密度脂蛋白;Lpa:脂蛋白a;TG:甘油三酯; TSH:促甲状腺激素。
三、 治疗
目前国际上尚无药物批准用于NAFLD的治疗,而部分继发性NAFLD在正确甄别病因后可给予针对性的治疗(表1)[6],阻止疾病进展并改善NAFLD/NASH。因此,在临床工作中,正确识别继发性NAFLD的病因对NAFLD的治疗具有重大意义。

表1 继发性NAFLD治疗策略
四、总结及展望
大多数NAFLD是由营养过剩引起的代谢综合征的一个组成部分。如果在临床评估中没有代谢综合征的症状和迹象,应考虑是否存在NAFLD的继发因素,包括药物治疗和环境暴露到内分泌激素失调以及先天性代谢缺陷,特别是在瘦患者和儿童患者中。尽早识别NAFLD的病因有助于早期干预改善预后。如果没有针对性治疗措施,通过分析已知遗传风险因子(PNPLA3、TM6SF2、GCKR、MBOAT7、HFE、A1AT;保护性:HSD17B13、MARC1)从而调整随访监测频率。未来将会开发更多针对性的治疗继发性NAFLD的治疗药物用于临床。
