长链脂酰辅酶A合成酶1在肝癌中的表达及临床意义
2022-02-15李娇娇师豆豆黄启超陶梅
李娇娇 师豆豆 黄启超 陶梅
肝细胞癌(hepatocellular carcinoma,HCC)目前是全球第六大最常见的癌症和第三大癌症死因[1]。由于肝癌的生物学特性,放射治疗和化学疗法不敏感,手术切除仍是最有效的肝癌治疗方法,但几乎70%的患者在切除后发展为复发性HCC[2]。因此,发现新的预后靶点,将有助于提高HCC患者生存率。
哺乳动物体内一共有26种脂酰辅酶A合成酶,其中长链脂酰辅酶A合成酶(ACSLs)主要负责活化最丰富的长链脂肪酸(C12 ~ C20脂肪酸),活化的脂酰辅酶A通过参与脂质合成或脂质氧化来发挥生物作用。ACSL1是ACSLs家族中第一个发现的亚基,肝脏的ACSL1含量占ACSLs家族总含量的50%以上[3]。越来越多的研究表明,组织ACSL1的异常表达在肿瘤的发生、发展中占据重要作用。比如,在结肠癌[4-5]、甲状腺癌[6]、卵巢癌[7]中,ACSL1促进癌细胞不受抑制的增殖,开启不受调控的癌症代谢,促进肿瘤的侵袭和转移;在食管癌[8]、IDH1突变胶质瘤[9]中,ACSL1与肿瘤的生存率和预后存在密切联系。ACSL1在HCC中的作用尚不明确,且ACSL1在HCC中的表达情况尚存在争议[10-11]。因此该研究通过检测临床HCC组织样本ACSL1的表达并分析ACSL1对HCC患者预后的影响,在细胞层面观察ACSL1对癌细胞增殖、凋亡、能量代谢的影响,初步探讨ACSL1与HCC的关系及其对临床诊疗的意义。
资料与方法
一、一般材料
(一)组织样本及临床病理资料 HCC手术组织及临床资料来自空军军医大学西京医院和唐都医院2010年1月至2016年12月的HCC队列,334例在肝胆外科诊断为HCC的癌组织及对应的癌旁正常组织石蜡包埋组织。癌组织的石蜡包埋组织均经病理检查确认,术前无放化疗,不伴有其他恶性疾病。临床资料包括患者的6年随访资料。该研究获得空军军医大学唐都医院医学伦理委员会批准。
(二)主要材料及试剂 人HCC细胞株 SNU739由空军军医大学基础医学院病理实验室赞助;胎牛血清、RPMI培养基、Trypsin-EDTA购自美国Gibco公司;ACSL1过表达的慢病毒质粒购自上海吉凯基因公司;ACSL1抗体、MTS检测试剂盒购自上海艾博抗贸易有限公司;β-actin 抗体和兔二抗购自Cell Signaling Technology;免疫组化试剂盒、蛋白上样Marker购自美国 Thermo Fisher 公司;DAB 显色试剂盒、BCA 蛋白定量试剂盒购自陕西中晖赫彩生物医药科技有限公司;青链霉素混合液、Annexin V-FITC/PI 细胞凋亡检测试剂盒、乳酸检测试剂盒购自北京索莱宝科技有限公司;XF测定培养基购自Seahorse Bioscience公司;24孔海马测定板购自安捷伦科技公司。
二、研究方法
(一)免疫组化检测癌组织与癌旁组织中ACSL1的表达 病理切片60 ℃恒温箱烤片20 min;二甲苯浸泡脱蜡;无水乙醇和3种由高到低浓度酒精依次浸泡水化;自来水冲洗;柠檬酸钠缓冲液抗原修复;PBS洗涤;H2O2水封闭内源性过氧化物酶;PBS洗涤;山羊血清阻断内源性过氧化物酶;ACSL1 抗体(1∶50)孵育,4 ℃过夜;PBS洗涤;生物素标记山羊抗兔IgG静置孵育15 min;PBS洗涤;辣根酶标记链霉卵白素工作液孵育20 min;PBS洗涤;镜下DAB显色观察;苏木精复染;自来水冲洗;1%盐酸酒精分化;自来水返蓝;酒精和无水乙醇依次浸泡脱水;二甲苯浸泡透明;中性树胶封片;镜下观察:细胞染色强度判断:阴性0分,弱阳性1分,阳性2分,强阳性3分;细胞阳性率判断:<10%为0分,10%~30%为1分,31%~60%为2分,>60%为3分;细胞染色强度和阳性率的乘积为免疫结果,总分<2分为低表达,≥2分为高表达。
(二)细胞培养和慢病毒转染 配置含10%胎牛血清和1%青霉素、链霉素混合液的RPMI培养基,用于孵育SNU739细胞。把对数生长期的细胞用Trypsin-EDTA消化;细胞计数;6孔板种植转染(4×105/孔):对照组(control)转染空质粒慢病毒,实验组转染ACSL1过表达慢病毒;待细胞长到50%时转染慢病毒:948 μL常规RPMI培养基 +40 μL感染增强P液 +12 μL病毒液(病毒浓度为 108/mL);8 h后更换培养基;72 h后用1 μg/mL嘌呤霉素进行抗嘌呤霉素细胞筛选,将其传代培养。
(三)Western blot检测SNU739癌细胞ACSL1的表达 提取实验组和对照组细胞总蛋白;BCA法检测样本蛋白浓度;5×蛋白上样缓冲液使蛋白变性;取35 μg蛋白上样,10%SDS-PAGE电泳;250 mA、90 min恒流将蛋白转至PVDF膜;10%脱脂奶粉室温摇床封闭 3 h;ACSL1 抗体(1∶1 000)4 ℃孵育过夜;1×PBST 洗膜3次;二抗室温孵育1 h;PBST 再次洗涤3次;HRP-ECL化学发光液显影。
(四)MTS法检测ACSL1对SNU739细胞增殖能力的影响 取实验组和对照组对数生长期癌细胞,Trypsin-EDTA消化;细胞计数使细胞悬液浓度为 2×104个/ mL,加入96孔板,100 μL/孔;37 ℃、5%CO2培养箱孵育过夜,镜下观察;每孔加入20 μL的MTS(5 mg/mL),孵育1 h;酶标仪490 nm 波长处检测细胞吸光度值,记录为起始值;同样的方法分别在24、48、72、96 h检测吸光度值。每组采用5个复孔,实验重复 3 次,记录数据并绘制细胞增殖曲线。
(五)流式细胞仪检测ACSL1对SNU739细胞凋亡的影响 取实验组和对照组对数生长期癌细胞,Trypsin-EDTA消化;细胞计数使细胞悬液浓度约为1×106个/mL;1 000 r/min,4 ℃离心10 min后收集细胞,弃培养基;用冷PBS 轻轻震荡使细胞悬浮,1 000 r/min, 4 ℃离心10 min后收集细胞,该步骤重复2次;200 μL 1×Binding Buffer 缓冲液悬浮细胞;向上述细胞悬液中加入10 μL Annexin V-FITC轻轻混匀,4 ℃避光孵育30 min;加入20 μL PI轻轻混匀,4 ℃避光孵育15 min;1 h内用流式细胞仪检测。
(六)Seahorse XF24分析仪检测ACSL1对SNU739细胞OCR的影响 Seahorse XF24分析仪检测前一天,在探针板中加入校正液后,放入37 ℃、无CO2的培养箱过夜进行活化;实验组和对照组的癌细胞以5×104个/孔接种到24孔板中,在37 ℃、CO2的培养箱中培养过夜;第二天,细胞培养板从培养箱中取出,记录时间,用XF测定培养基替换原来的培养基,将细胞板置于37 ℃无CO2的培养箱中1 h;正式测定前,进行预测试以发现每种抑制剂的最佳浓度:寡霉素(oligomycin)3 μmol/L,三氟甲氧基羰基氰化物苯腙(FCCP)1 μmol/L,鱼藤酮(ROT)4 μmol/L,抗霉素A 4 μmol/L;XF24细胞外通量分析仪上测量OCR,XF Cell Mito Stress Test Generator软件分析整理数据结果。
(七)乳酸试剂盒检测ACSL1对SNU739细胞乳酸的影响 实验组和对照组的癌细胞Trypsin-EDTA消化;PBS重悬,1 000 r/min,离心10 min,弃上清,留细胞沉淀;加入PBS缓冲液清洗1~2次,同样1 000 r/min,离心10 min,弃上清液,留细胞沉淀;加入1%~2%的TritonX-100细胞裂解液0.2~0.3 mL, 4 ℃条件下裂解30~40 min,裂解好的液体不离心直接进行测定;取96孔板和乳酸试剂盒,将裂解液和测试试剂于EP管内混合,移入到96孔板;酶标仪在波长510 nm测定吸光度值,计算各组细胞内乳酸含量。
三、统计学分析
数据整理后,用SPSS 26.0和Graph Pad Prism 8.0进行统计学分析。计量资料以均数±标准差表示,两组间比较采用t检验;计数资料分析用χ2检验;生存分析用Cox 比例风险回归。P<0.05为差异有统计学意义。
结 果
一、ACSL1在HCC癌组织及癌旁组织中的表达及癌组织中ACSL1与HCC患者临床病理特征关系
免疫组化检测显示,癌组织中ACSL1染色大多为弱阳性,而癌旁组织中大多为阳性至强阳性。癌组织及癌旁组织中 ACSL1 的免疫组化结果分别为3.02±2.57和7.60±3.34,癌组织的ACSL1表达显著低于癌旁组织(t=20.040,P=0.000),见图1。通过6年的随访资料,发现HCC中ACSL1表达与不同年龄存在相关性(P<0.000),而与性别(P>0.05)、临床分期(P>0.05)均无关,见表1。
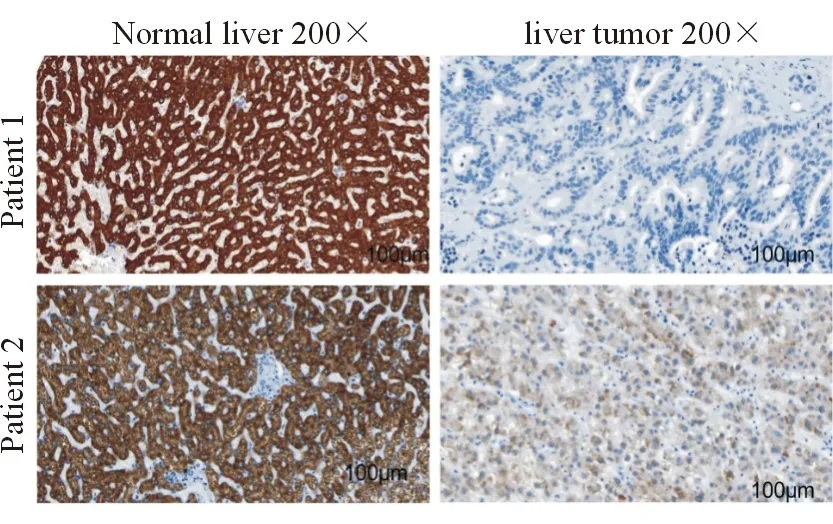
图1 HCC癌组织及癌旁组织ACSL1的表达
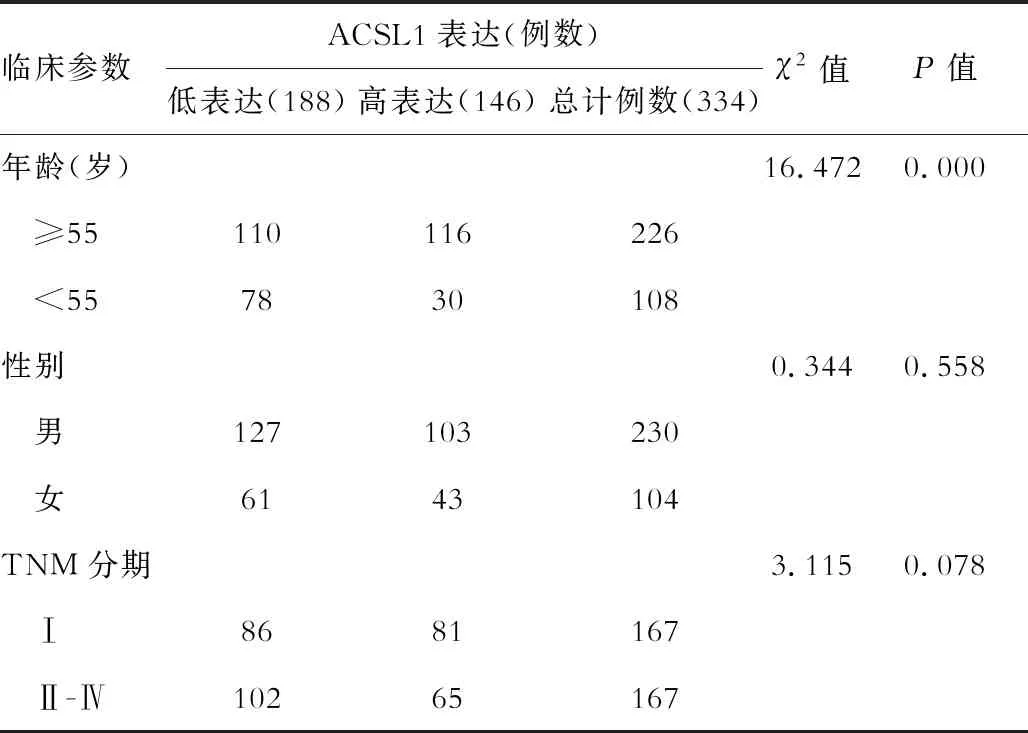
表1 ACSL1蛋白表达与HCC临床病理特征关系
二、HCC预后单因素和多因素Cox分析
首先将已知的可能影响HCC预后的临床资料进行Cox单因素分析,发现ACSL1蛋白表达、TNM分期与HCC的预后有相关性(均P<0.1),而性别、年龄与预后无关(均P>0.5);再将与HCC预后相关的因素作为自变量进行多因素Cox回归分析,发现ACSL1蛋白表达水平是HCC患者生存的危险因素(HR=1.642,P=0.012),见表2。
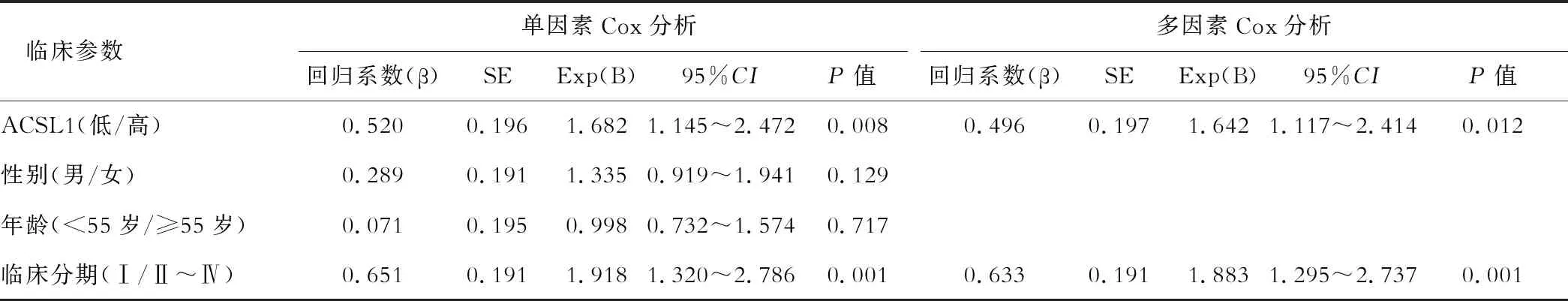
表2 肝细胞癌患者预后单因素及多因素Cox分析
三、ACSL1对SNU739细胞增殖和凋亡的影响
Western blot验证实验组和对照组ACSL1蛋白表达,发现实验组ACSL1蛋白表达水平明显高于对照组,见图2A;MTS法检测ACSL1对SNU739细胞增殖的影响,发现实验组细胞增殖能力较对照组细胞显著减弱(F=45.056 ,P=0.003),见图2B;Annexin V-FITC/PI双染法流式检测ACSL1对SNU739细胞凋亡影响,发现实验组细胞凋亡百分数显著高于对照组(t=13.886,P=0.000),见图2C、2D。
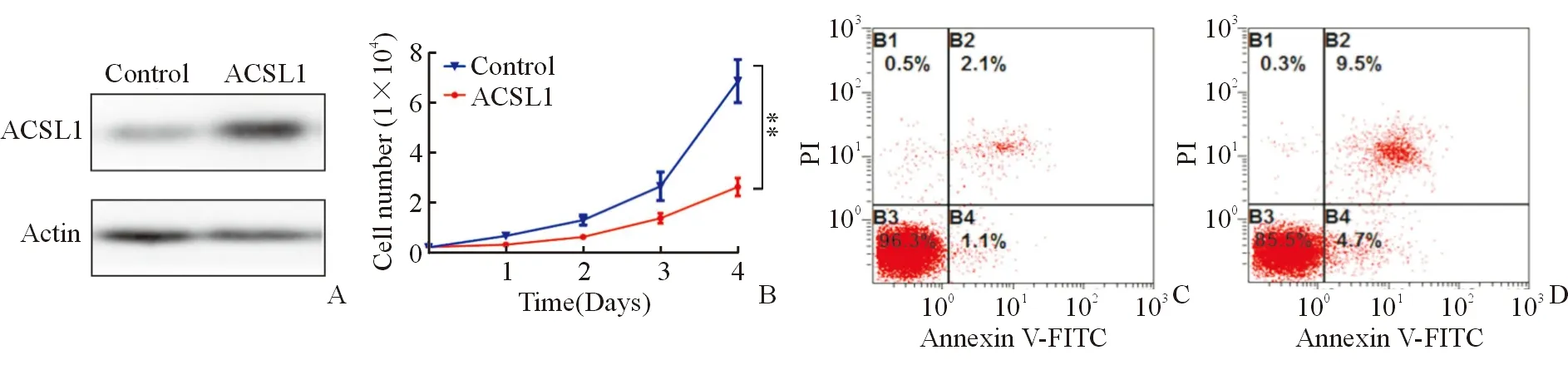
A.Western blot验证SNU739细胞过表达ACSL1;B.MTS法检测ACSL1对HCC细胞增殖的影响;C.Annexin V-FITC/PI双染法流式检测实验组ACSL1对HCC细胞凋亡的影响;D. Annexin V-FITC/PI双染法流式检测对照组ACSLI对HCC细胞凋亡的影响
四、ACSL1对SNU739细胞能量代谢的影响
Seahorse XF24分析仪检测实验组和对照组细胞线粒体OCR,发现在加入FCCP后,随着时间进展,实验组细胞基础氧耗速率(F=83.429,P=0.001)、最大氧耗速率(F=859.792,P=0.000)明显高于对照组,解偶联呼吸较对照组增强(F=11.579,P=0.027),见图3;乳酸试剂盒检测实验组和对照组细胞乳酸含量,发现实验组细胞乳酸含量低于对照组的(t=4.585,P=0.010)。
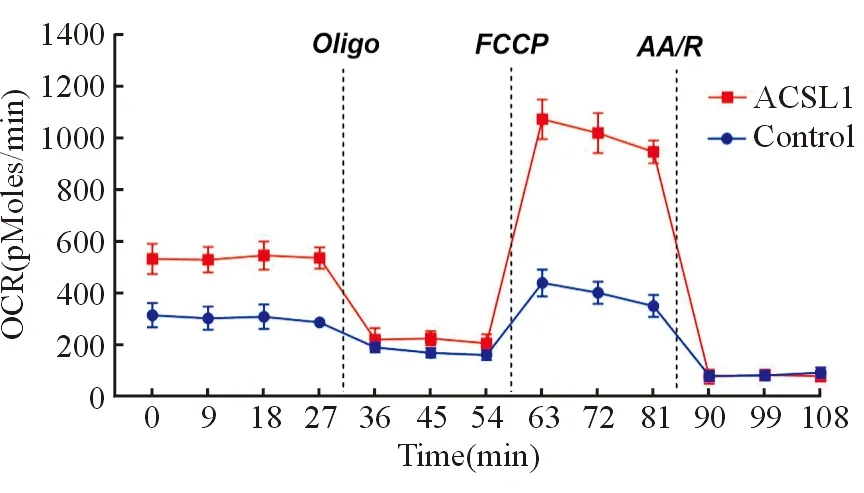
图3 Seahorse XF24分析仪检测ACSL1对HCC OCR的影响
讨 论
HCC是由感染以及与慢性坏死性炎症相关代谢物和毒物诱发的癌症范例。尽管这些发现已转为一级和二级预防措施,以及疾病的模型系统,但临床上特征明显的HCC预后仍然很差[1,12]。因此,发现新的HCC预后标志物,将更有利于改善HCC患者的预后。生理条件下,ACSL1以ATP依赖的方式将特定的游离长链脂肪酸活化为脂酰辅酶A,作为代谢变阻剂调节肝脏[13]、心脏[14]、骨骼肌[15]和脂肪组织[16]的脂质代谢。研究表明,当肝脏中ACSL1表达异常时,可使肝脏的脂质代谢失调,导致肝脏功能异常,甚至发生肝恶变[17-18]。本研究旨在探讨ACSL1在HCC中的表达及对HCC预后、HCC细胞株SNU739增殖和凋亡的影响,并且初步探究ACSL1在HCC中的作用机制。
Cui等[10]在探究肝癌中特异性过度表达的lncRNA(Highly upregulated in liver cancer ,HULC)对HCC脂质代谢紊乱的作用时,发现ACSL1可被HULC显著上调,并且免疫组化检测ACSL1在临床HCC组织样本的表达,发现ACSL1在HCC癌组织中的表达强于癌旁组织。Muir等[11]报道,在磷酸酶和张力蛋白同系物(phosphatase and tensin homolog,Pten)诱导的小鼠HCC和小鼠非酒精性脂肪性肝炎(Non-alcoholic steatohepatitis,NASH)模型中,对小鼠HCC组织和NASH组织进行广泛质谱分析,发现Pten缺失的HCC中,ACSL1 mRNA的表达明显下调,并且与癌旁NASH组织相比,ASCL1在肿瘤组织中的表达也显著降低。本研究通过免疫组化分析334例HCC患者癌组织及癌旁正常组织中ACSL1表达情况,发现癌组织中ACSL1的表达要较癌旁组织低;进一步分析HCC中ACSL1表达与HCC临床病理特征关系,发现ACSL1的表达与HCC患者的年龄和临床分期显著相关,与其他临床病理无相关;在 HCC预后单因素和多因素Cox分析中,发现ACSL1低表达的HCC患者预后更差,ACSL1蛋白表达水平是HCC患者生存的危险因素。
Guo等[6]发现,甲状腺癌中小核仁RNA宿主基因7表达上调,可降低miR-449a表达,进而上调ACSL1促进癌细胞增殖和迁移,抑制癌细胞凋亡。Chen等为了验证ACSL1对大肠癌的致癌作用和对肺癌的抑制作用,将两种表达ACSL1 shRNA的慢病毒颗粒分别导入大肠癌HCT116细胞和肺A549细胞中,发现ACSL1 shRNA抑制HCT116细胞的增殖,但促进A549细胞的增殖[19]。本研究在慢病毒构建的ACSL1过表达SNU739细胞中,发现ACSL1可减弱SNU739细胞增殖能力,而显著促进其凋亡,说明ACSL1在HCC的进展中可能介导一种特定机制。
Cassim等证实HCC表现出普遍的糖酵解代谢,但在葡萄糖缺乏的情况下,脂肪酸氧化(fatty acid oxidation,FAO)被激活,可以为癌细胞供应能量并促进增殖[20]。 Sangineto等[8]报道,癌细胞中FAO被激活后,电子传输链的过度活性可能产生活性氧和氧化损伤,导致癌细胞死亡。而在缺氧诱导因子-1α介导的FAO抑制,有利于肝癌细胞对低氧环境的适应,但是在常氧条件下增强的FAO对肝癌的生长没有影响[21-22]。可见,FAO在HCC进展中的作用和HCC所处的背景有很大的相关性,需要更广泛的研究来了解癌症代谢重新编程对FAO的影响。线粒体是细胞的能量加工厂,产生的 ATP为机体的基本生命活动提供能量。本研究通过检测实验组细胞和对照组细胞的线粒体OCR和乳酸含量,初步探究ACSL1对HCC能量代谢的影响,结果表明实验组细胞线粒体OCR明显高于对照组,而乳酸含量明显低于对照组。提示与对照组细胞的糖酵解供能相比,ACSL1过表达的肝癌细胞能量供应主要来源线粒体的三羧酸循环。
本研究的不足之处是未能进一步明确ACSL1异常表达对HCC能量代谢重编程的具体机制。但结合前文描述,我们推测,ACSL1可能通过FAO途径参与线粒体三羧酸循环,进而参与HCC的发生、发展。下一步我们将结合动物实验,进一步深入探讨ACSL1在HCC中的具体机制,并且借ACSL1相关研究进一步揭示FAO异常在HCC参与的新途径。
