微载体6复合脂肪干细胞移植在肛瘘治疗中的应用*
2022-01-12李衍森范明峰乐瀚翔孔令玉
李衍森 范明峰 乐瀚翔 孔令玉 洪 丰 晁 民△
(1 济宁医学院附属医院,济宁 272029;2 吉林大学第二医院,长春 130041)
肛瘘即肛门直肠瘘,是由肛门直肠脓肿破溃或切开排脓后形成的肛门直肠周围肉芽肿性管道[1];其临床特征为肛门反复疼痛、瘙痒、流脓水,难以愈合,影响患者生存质量[2]。肛瘘发病机理尚不明确,手术是其主要治疗方法,但创面大、损伤重、相关并发症多[3]。有研究报道脂肪干细胞(ADSC)可治愈肛瘘[4],且治疗复杂性肛瘘,具有微创、无肛门括约肌损伤、痛苦小、住院时间短等优势[5]。微载体 6(Microcarrier 6)是由带正电的有机聚合物复合材料组成,具有多层多孔结构、利于细胞生长,具有抗污染,免疫原性低,生物相容性和新陈代谢性好的特点[6]。为使ADSC在肛瘘的治疗中发挥更好的作用,本研究使用Microcarrier 6 复合ADSC通过组织工程技术修复肛瘘周围的受损组织,为临床肛瘘微创化治疗探索新路径。
1 材料与方法
1.1 材料
1.1.1动物 24只4月龄大的日本大耳兔,雌雄不限,每只体重2.0~4.0kg,由济南金丰实验动物有限公司提供。实验室动物质量证书编号:37009700000659,许可证编号:SCXK(山东)20180006;所有动物实验程序均符合规定,并由济宁医学院附属医院动物伦理委员会(批准号:2018-FY-002))审查和批准。
1.1.2试剂与仪器 RPMI-1640培养基,胶原酶Ⅰ,胎牛血清(FBS),红细胞裂解缓冲液(ACK),1×PBS和胰蛋白酶购自Gibco(US);Microcarrier 6由Elyon Bio-Technologies LLC(美国)提供;肛瘘刮除刀购自由山东赛诺医疗器械有限公司。
1.2 方法
1.2.1兔肛瘘模型的制备 家兔全麻后固定四肢,剪除肛周皮毛并完全暴露肛门,碘伏常规消毒家兔肛门及其周围皮肤,使用温控电刀在兔肛周距肛缘0.5~1cm制造肛瘘外口,在肛镜引导下从兔肛门距肛缘0.5~0.7cm肛管内穿出,瘘管造膜完成,探针尾部系一橡皮条,在探针引导下,使橡皮条经瘘管外口进入,穿入瘘管,自内口穿出,结扎橡皮条两端,使橡皮条浮挂于瘘管内,造膜结束。造膜完成后给予造模动物配备防咬装置,防止咬断橡皮筋、舔咬瘘管伤口;26d后去除橡皮筋,经专业两位肛肠外科医师检查并探针检查确定造模成功[7]。
1.2.2ADSC的提取和培养 家兔全麻后,将四肢固定,准备好手术区域的皮肤,然后用碘伏常规消毒并覆盖无菌洞巾。在兔子的后背部做一个大约4cm长的正中切口,分离皮下组织,每只兔子取出约5~9g脂肪组织,将脂肪组织放入无菌培养盘中,并用生理盐水洗涤,去除多余的头发和血迹,并用PBS进一步洗涤细胞2~3次,在无菌条件下去除包膜,结缔组织和血管,用小剪刀将脂肪组织切成约1mm大小的3块,并在37℃的恒温振荡器上用5ml的0.05%胶原酶Ⅰ消化60min,接着加入含有10% FBS的RPMI-1640培养基以终止消化。将悬浮液以1000r/min离心5min,并丢弃上层中的脂质滴和上清液,将细胞重悬于PBS中并通过200目滤器;随后以1000r/min离心5min,弃去上清液。然后将细胞重悬于含有10% FBS的RPMI-1640培养基中,接种到6孔板中,并在5% CO2培养箱中于37℃培养。根据细胞的生长状态,每3~4天更换1次培养基。将原代细胞培养大约2周后,用0.25%的胰蛋白酶消化并传代。在倒置显微镜下观察细胞的形态变化。培养传至第三代后,拍照并收集细胞。
1.2.3Microcarrier 6-ADSC复合物的构建 将 Microcarrier 6浸泡在75%的乙醇中24h,然后用PBS洗涤3次,后将Microcarrier 6在RPMI-1640培养基中孵育24h。用基质细胞衍生因子-1α(SDF-1α)和血管内皮生长因子(VEGF)修饰Microcarrier 6,浓度均为100ng/mL,孵育3h,收获处于对数期生长阶段的细胞,通过使用锥虫蓝,发现活细胞百分比超过95%,并将细胞浓度调整为2×107个/mL,将ADSC悬浮液与修饰的Microcarrier 6混合并在5%CO2培养箱中在37℃下培养24h,以使细胞在Microcarrier 6上(在显微镜下)达到饱和状态。
1.2.4动物分组 成功建立模型后,将其中的24只兔随机分为4组:Microcarrier 6-ADSC复合组,自体ADSC治疗组(简称ADSC治疗组),橡皮筋挂线手术组(简称手术组)和对照组,每组6只;Microcarrier 6-ADSC复合组接种200μl 2×107个/ml混合悬浮液,ADSC治疗组接种200μl 2×107个/ml ADSC悬浮液,对照组接种200μl 1×PBS溶液。
1.2.5各组动物手术步骤 1)各组家兔刨削瘘管内壁,用亚甲蓝稀释液(0.5∶6~0.5∶2)从肛瘘外口注入,内口有蓝液流出,确定好内口位置,用肛瘘刮除刀刨削瘘管内壁1~3次,肉眼观察没有染色组织即可;2)采用3/0可吸收线对各组家兔肛瘘的肛管内部开口进行全层缝合。完成后,通过肛瘘的外口将少量生理盐水注入瘘管创腔内,如果没有液体从肛瘘的内部开口漏出,则确定肛瘘的内口已成功关闭;3)ADSC治疗组注射自体ADSC悬浮液,将100μl 2×107个/ml的细胞悬液注射到瘘管创腔周围的组织中。为了使细胞分布更均匀,每次以小剂量进行多点注射,形成多个<2mm的微囊泡,将剩余的100μl液体通过肛瘘的外口均匀地注入瘘管创腔内,在注射过程中,注射点保持在离瘘管壁1~5mm;同法Microcarrier 6-ADSC复合组注射200μl Microcarrier 6-ADSC混合悬浮液,对照组注射200μl 1×PBS溶液。4)手术组沿瘘管的方向,将探头从瘘管的外口缓慢插入,然后从瘘管的内口引出,探头末端弯曲并从肛门引出,将一根带有橡皮筋的7号丝线绑在探头末端,然后将其与橡皮筋一起从内向外拉出,以使橡皮筋贯穿整个瘘管,切开瘘管内部和外部开口之间的皮肤以暴露括约肌,抬高并拉紧橡皮筋,紧贴肌肉组织用血管钳钳夹橡皮筋下方用7号丝线进行结扎。上述操作完成后,将兔子按不同的组进行单只饲养。每天或隔2~3d观察兔瘘管内外口的愈合情况。
1.2.6HE染色
石蜡组织切片4μm厚度,贴于载玻片上,经过二甲苯脱蜡,梯度酒精,水化,分别苏木素和伊红染液(福州迈新公司)染色,后经梯度酒精脱水,二甲苯透明后,滴加中性树胶后封片,显微镜下观察。
1.3 统计学方法
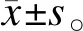
2 结果
2.1 ADSC的形态学
原代细胞培养1d后,发现一些细胞是圆形的,具有可见的细胞核黏附在培养瓶壁上;第2天,贴壁细胞数量增加,一些贴壁细胞变形,细胞直径增加;在第3天,细胞逐渐伸长成多边形;在第7天,黏附的ADSC呈现出均匀的形态和长的纺锤形;在第12天,大多数黏附细胞融合,呈现集落状分布和鱼群状排列(图1a)。培养2周后,细胞均匀分布,大部分为长纺锤形,中间有核;细胞传代后,细胞迅速附着在壁上,具有相对均匀的形态和很少的异形细胞;细胞呈现出集落状或鱼群状的排列方式(图1b)。用胰蛋白酶消化后,ADSC变成单细胞悬液,与Microcarrier 6孵育4 h后发现,ADSC可均匀地黏附在Microcarrier 6上并达到饱和状态(图1c)。
注:a.在第12天,大多数贴壁细胞被融合,呈现集落状分布和鱼群状排列;b.细胞传代后表现为集落状或鱼群状排列模式; c.ADSC与Microcarrier 6结合良好,分布均匀,达到饱和状态
2.2 各组病理HE染色情况
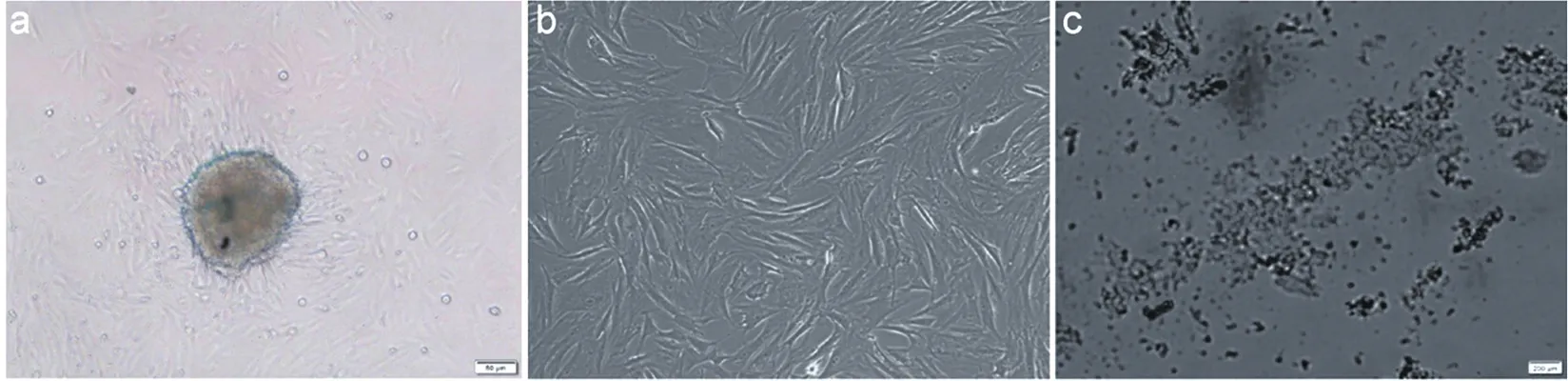
肛瘘治疗3周后,在全麻醉下切除肛瘘创腔组织,行病理检查评估。Microcarrier 6-ADSC复合组、ADSC治疗组所有肛瘘均愈合,在肛瘘创腔部位有纤维状肉芽组织,HE染色显示:在Microcarrier 6-ADSC复合组中Microcarrier 6周围观察到了少量淋巴细胞浮着(图2a),Microcarrier 6未被周围组织完全吸收,免疫刺激在局部组织中的反应;ADSC治疗组在肛瘘创腔部位有许多脂质囊泡(图3b),ADSC分化的脂肪组织充填了瘘管创腔;手术组瘘管虽愈合,但肛周组织明显缺损畸形,肉芽组织和淋巴细胞浸润(图2c),可能由于在穿线刺激下瘘管周围组织的反应性增生所致;对照组肛瘘未愈合,在瘘管腔内存在大量坏死组织,大量淋巴细胞浸润(图2d)。
注:a.Microcarrier 6-ADSC复合组;b.ADSC治疗组;c.手术组;d.对照组
2.3 各组肛瘘愈合情况
肛瘘治疗后,每天或隔2~3d观察一次伤口愈合过程,共3周。所有动物在手术和观察期间均存活。各组之间的体重无差异,Microcarrier 6-ADSC复合组、ADSC治疗组、手术组所有肛瘘均愈合,对照组没有愈合;与手术组相比,ADSC治疗组和Microcarrier 6-ADSC复合组治愈时间显著缩短(P<0.01);与ADSC治疗组相比,Microcarrier 6-ADSC复合组的愈合时间稍长,但差异无统计学意义(P> 0.05)。见表1。
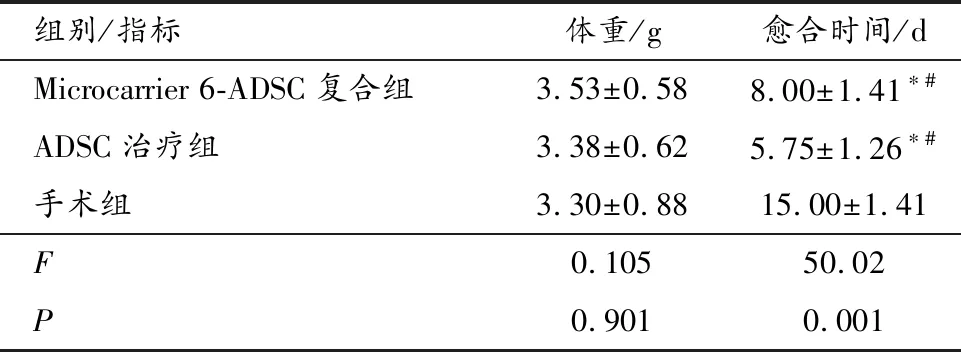
表1 Microcarrier 6-ADSC、自体ADSC移植与常规手术在肛瘘治疗中的愈合时间比较
3 讨论
近年来生物学治疗成为国内外专家共同研究的热点,特别是随着分子生物学技术进步,各类生物材质逐步应用于肛瘘的治疗术式中,其中比较新颖的技术用在肛瘘治疗的主要有:纤维蛋白凝胶封堵术、生物补片内口封闭术、皮肤胶原注射术、脂肪填充技术以及异体脱细胞真皮基质(肛瘘栓)填塞术[3]等;这些术式的出现,减少了对瘘管周围正常的结缔组织和括约肌的损伤,一定程度地保护了肛门括约肌的功能,但由于其治愈率不高,而且价格较贵,一直处于试验阶段,仍未进入临床应用中。肛瘘治疗方法主要有中西药物治疗、外科治疗、新兴的生物治疗模式及干细胞微创治疗。药物治疗有一定的疗效能缓解症状,中医药通过辨证施治,可以增强肛瘘患者体质,改善临床症状,促进术后创面愈合等,但都不能治愈肛瘘。经典传统的手术方式是肛瘘切开或肛瘘切除术,对于低位单纯性肛瘘治愈率高,括约肌损伤小,但其对于复杂性肛瘘则存在括约肌保护不足的问题,术后肛门失禁发生率较高,切割挂线术曾是治疗复杂性肛瘘的主要方法,在一定程度上可以保护括约肌功能。但研究表明,其术后肛门失禁率仍高达34%~63%,术后疼痛剧烈[8]。
国内外用ADSC移植治疗肛瘘特别是克罗恩的复杂性肛瘘疗效和安全性虽得到了初步认证[9],但目前仍停留在临床观察研究方面,且样本量少,疗效需待进一步提高。ADSC移植治疗肛瘘还存在诸多临床应用前需要解决的问题,其机理尚未明确。ADSC是一种间充质干细胞,在人体内大量存在,很容易地收获;ADSC具有自我再生和多向分化的潜力;其可以促进许多血管生成因子和抗凋亡因子的分泌[8]。因此,ADSC可用作肛门瘘的治疗,促进伤口组织修复和伤口表面愈合的种子细胞。目前,ADSC治疗肛瘘的研究仍处于探索阶段,关于ADSC脂肪组织的来源,分离和培养的工作流程,注射剂量和频率尚无共识。已发现使用支架可以提高移植细胞的存活率和生物学功能,支架提供了一种网状结构,ADSC黏附在其上以形成微结构,将其混合物注射到病变中后,它们可导致肛瘘创腔内微环境变化,从而对治疗产生协同作用。
本文结果显示Microcarrier 6-ADSC、ADSC的移植疗法都可改善肛瘘预后,通过比较Microcarrier 6-ADSC和自体ADSC移植治疗愈合后的肛瘘组织病理切片,我们发现少量淋巴细胞浸润了Microcarrier 6附近的组织,这可能是因为Microcarrier 6并未被周围组织完全吸收。因此,可以根据移植的ADSC的量减少Microcarrier 6的量,以达到肛瘘快速创面愈合的预期。根据我们的实验发现和现有临床研究的回顾,可以得出以下结论:与传统的外科橡皮筋挂线手术相比,Microcarrier 6-ADSC的移植治疗肛瘘具有较小的浸润性,对括约肌的无损害,疼痛较小且愈合速度更快的优点,可以初步确定Microcarrier 6能促进ADSC在瘘管创腔内更好的分化,但由于Microcarrier 6浓度高、吸收慢未达到理想的预期;如果用这次Microcarrier 6实验量的20%~50%或用自体脂肪制作3D支架会明显缩短愈合时间,这是下一步课题研究目标。随着生物降解材料的快速发展,ADSC可以与生物材料结合使用,以促进ADSC在临床治疗中的应用,有望为患者开发更个性化的治疗方案。
利益冲突:所有作者均申明不存在利益冲突。
