更昔洛韦联合单唾液酸四己糖神经节苷脂对病毒性脑炎伴精神行为异常患儿临床症状、神经营养因子及免疫功能的影响
2022-01-10成亚渝高航
成亚渝,高航
病毒性脑炎(viral encephalitis,VE)是一类常见的中枢神经系统感染性疾病,主要由病毒感染造成脑实质、脑膜病变,临床症状以头痛、发热和脑膜刺激征等为主,该病好发于儿童[1]。据相关临床资料显示,在我国VE的年发病率为0.04‰~0.05‰,该病可对患儿各个器官、系统造成损伤,甚至诱发多脏器功能障碍,危害性极高[2]。在我国,引起VE的常见病毒有腮腺炎病毒、单纯疱疹病毒、肠道病毒、日本脑炎病毒等,当机体免疫力低下、病毒侵袭性较强时,病毒可通过血-脑脊液屏障进入中枢神经系统,严重者可出现高级智能活动下降、意识障碍、精神行为异常等症状,甚至威胁患者的生命安全[3];部分患儿还会遗留听力损伤、脑积水、脑瘫等严重后遗症,这不仅影响患儿的生活质量,也给患儿家庭及社会带来了沉重的负担[4]。目前,临床上尚缺乏治疗VE的理想方法,常规药物治疗以利巴韦林、更昔洛韦等为主,其中更昔洛韦易通过血-脑脊液屏障,从而直接作用于神经中枢,故其抗病毒效果更好[5]。神经节苷脂是一类含唾液酸的糖鞘脂,可通过血-脑脊液屏障促进神经元修复、分化和发育,进而改善神经传导功能[6]。研究表明,神经节苷脂在神经系统中含量丰富,其是脑部发育的重要物质[7]。本研究旨在探讨更昔洛韦联合单唾液酸四己糖神经节苷脂对VE伴精神行为异常患儿临床症状、神经营养因子及免疫功能的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2019年9月至2020年10月武汉大学人民医院收治的83例VE伴精神行为异常患儿作为研究对象,均符合《神经系统感染性疾病诊断与治疗》[8]中的VE诊断标准及《情绪与行为障碍儿童的发展与教育》[9]中的精神行为异常诊断标准。排除标准:(1)合并其他脏器功能障碍、血液系统疾病及免疫系统功能异常患儿;(2)合并流行性乙型脑炎、结核性脑炎等神经系统疾病患儿;(3)合并缺血性脑疾病患儿;(4)先天性畸形患儿。根据随机数字表法将83例患儿分为治疗组(n=42)和对照组(n=41)。治疗组中男19例,女23例;年龄10个月~12岁,平均年龄(5.5±1.5)岁;病程3~6周,平均病程(4.1±1.1)周。对照组中男20例,女21例;年龄9个月~12岁,平均年龄(5.8±1.8)岁;病程3~6周,平均病程(4.3±1.4)周。两组患儿性别(χ2=0.105,P=0.746)、 年 龄(t=0.742,P=0.460)、 病 程(t=0.708,P=0.481)比较,差异无统计学意义。本研究经武汉大学人民医院伦理委员会审查通过(伦理编号:WDRM2020-K224),所有患儿家属对本研究知情同意。
1.2 治疗方法 两组患儿均接受降温、降颅压、抗病毒、解痉、营养支持等常规治疗。对照组患儿在常规治疗基础上给予更昔洛韦注射液(山东罗欣药业集团股份有限公司生产,国药准字H20100030)治疗,即更昔洛韦注射液5 mg/kg+5%葡萄糖注射液100 ml静脉滴注,2次/d。治疗组患儿在常规治疗基础上给予更昔洛韦注射液联合单唾液酸四己糖神经节苷脂钠注射液(海南益尔生物制药有限公司生产,国药准字H20080138)治疗,更昔洛韦注射液用法用量同对照组,单唾液酸四己糖神经节苷脂钠注射液40 mg+5%葡萄糖注射液250 ml静脉滴注,1次/d。治疗期间密切监测两组患儿肝肾功能,均连续治疗14 d。
1.3 观察指标 (1)比较两组患儿临床疗效。参照《小儿神经系统疾病基础与临床》[10]中的临床疗效判定标准,其中临床治愈:患儿意识障碍、精神症状、脑膜刺激征、呕吐、发热、抽搐等症状消失,各项生命体征恢复正常;显效:患儿意识障碍、精神症状、脑膜刺激征、呕吐、发热、抽搐等症状基本消失,脑电图和脑脊液检查结果基本正常;有效:患儿意识障碍、精神症状、脑膜刺激征、呕吐、发热、抽搐等症状明显好转;无效:患儿各项临床症状、体征无明显改变甚至加重。(2)统计两组患儿临床症状(意识障碍、精神症状、脑膜刺激征、呕吐、发热、抽搐)消失时间。(3)分别于治疗前后抽取两组患儿空腹肘静脉血5 ml,采用酶联免疫吸附试验检测血清神经营养因子〔脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)和神经营养因子3(neurotrophin-3,NT-3)〕水平;采用全自动多色分析仪检测免疫指标(CD3+T淋巴细胞百分比、CD4+T淋巴细胞百分比、CD8+T淋巴细胞百分比);采用酶联免疫吸附试验检测血清炎性因子〔肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、白介素(interleukin,IL)-6、IL-8〕水平。(4)记录两组患者治疗期间不良反应发生情况。
1.4 统计学方法 采用SPSS 21.0统计学软件进行数据处理。计量资料以(±s)表示,组间比较采用两独立样本t检验;计数资料以相对数表示,组间比较采用χ2检验;等级资料比较采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效 治疗组患儿临床疗效优于对照组,差异有统计学意义(Z=29.750,P<0.001),见表1。

表1 两组患儿临床疗效〔n(%)〕Table 1 Clinical efficacy of the two groups
2.2 临床症状消失时间 治疗组患儿意识障碍、精神症状、脑膜刺激征、呕吐、发热、抽搐消失时间短于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患儿临床症状消失时间比较(±s,d)Table 2 Comparison of disappearance time of clinical symptoms between the two groups

表2 两组患儿临床症状消失时间比较(±s,d)Table 2 Comparison of disappearance time of clinical symptoms between the two groups
精神症状消失时间组别 例数 意识障碍消失时间脑膜刺激征消失时间呕吐消失时间发热消失时间抽搐消失时间对照组 41 5.13±1.22 5.58±1.46 3.11±0.84 4.13±0.86 4.30±1.55 1.72±0.43治疗组 42 3.01±0.67 3.16±0.94 2.03±0.56 3.61±0.71 3.67±1.21 0.96±0.29 t值 9.844 9.000 6.907 3.007 2.067 9.461 P值 <0.001 <0.001 <0.001 0.004 0.042 <0.001
2.3 神经营养因子 治疗前,两组患儿血清BDNF、NT-3水平比较,差异无统计学意义(P>0.05);治疗后,治疗组患儿血清BDNF、NT-3水平高于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患儿治疗前后神经营养因子比较(±s,pg/L)Table 3 Comparison of neurotrophic factors between the two groups before and after treatment
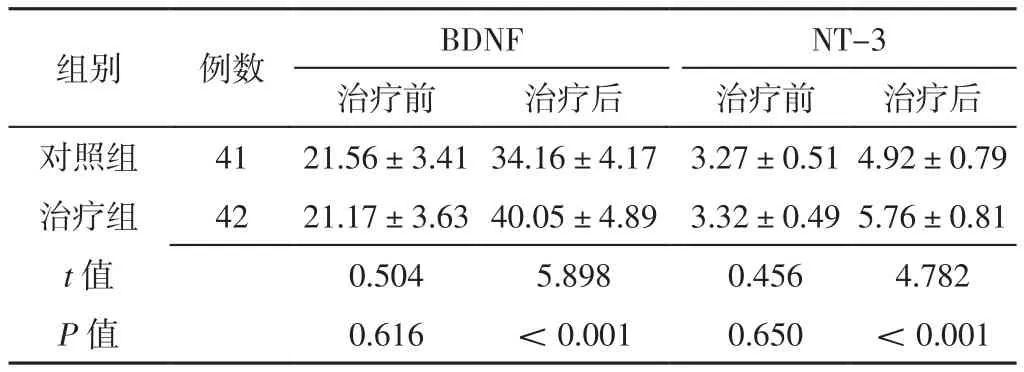
表3 两组患儿治疗前后神经营养因子比较(±s,pg/L)Table 3 Comparison of neurotrophic factors between the two groups before and after treatment
注:BDNF=脑源性神经营养因子,NT-3=神经营养因子3
组别 例数 BDNF NT-3治疗前 治疗后 治疗前 治疗后对照组 41 21.56±3.41 34.16±4.17 3.27±0.51 4.92±0.79治疗组 42 21.17±3.63 40.05±4.89 3.32±0.49 5.76±0.81 t值 0.504 5.898 0.456 4.782 P值 0.616 <0.001 0.650 <0.001
2.4 免疫指标 治疗前,两组患儿CD3+T淋巴细胞百分比、CD4+T淋巴细胞百分比、CD8+T淋巴细胞百分比比较,差异无统计学意义(P>0.05);治疗后,治疗组患儿CD3+T淋巴细胞百分比、CD4+T淋巴细胞百分比高于对照组,CD8+T淋巴细胞百分比低于对照组,差异有统计学意义(P<0.05),见表4。
表4 两组患儿治疗前后免疫指标比较(±s,%)Table 4 Comparison of immune indexes between the two groups before and after treatment
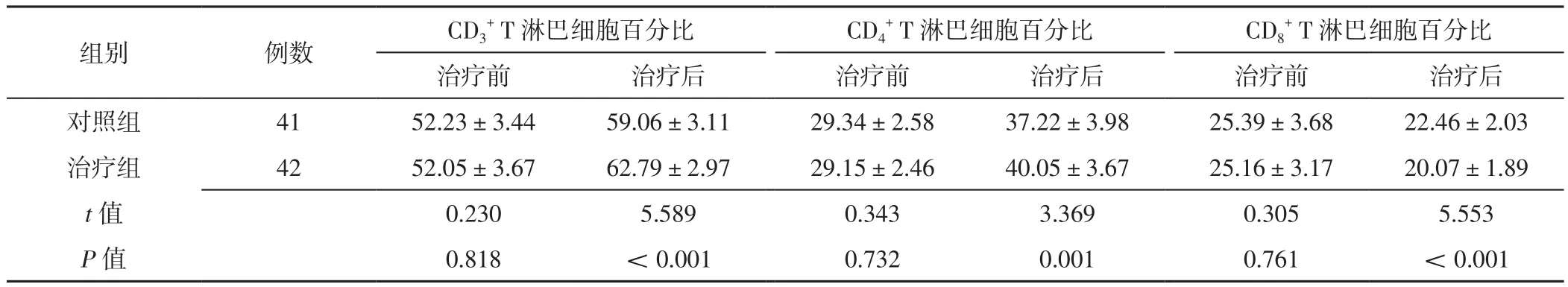
表4 两组患儿治疗前后免疫指标比较(±s,%)Table 4 Comparison of immune indexes between the two groups before and after treatment
+ T淋巴细胞百分比治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 41 52.23±3.44 59.06±3.11 29.34±2.58 37.22±3.98 25.39±3.68 22.46±2.03治疗组 42 52.05±3.67 62.79±2.97 29.15±2.46 40.05±3.67 25.16±3.17 20.07±1.89 t值 0.230 5.589 0.343 3.369 0.305 5.553 P值 0.818 <0.001 0.732 0.001 0.761 <0.001组别 例数 CD3+ T淋巴细胞百分比 CD4+ T淋巴细胞百分比 CD8
2.5 炎性因子 治疗前,两组患儿血清TNF-α、IL-6及IL-8水平比较,差异无统计学意义(P>0.05);治疗后,治疗组患儿血清TNF-α、IL-6及IL-8水平低于对照组,差异有统计学意义(P<0.05),见表5。
表5 两组患儿治疗前后炎性因子比较(±s,ng/L)Table 5 Comparison of inflammatory factors between the two groups before and after treatment
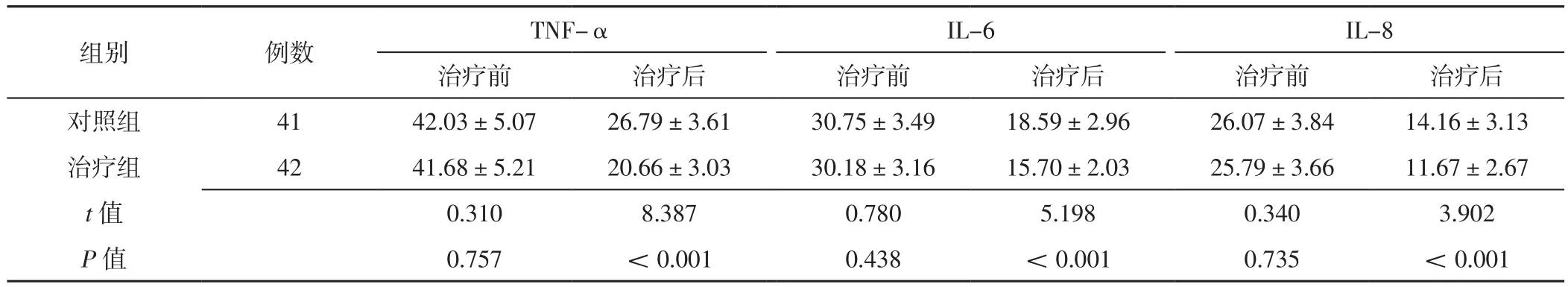
表5 两组患儿治疗前后炎性因子比较(±s,ng/L)Table 5 Comparison of inflammatory factors between the two groups before and after treatment
注:TNF-α=肿瘤坏死因子α,IL=白介素
组别 例数 TNF-α IL-6 IL-8治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 41 42.03±5.07 26.79±3.61 30.75±3.49 18.59±2.96 26.07±3.84 14.16±3.13治疗组 42 41.68±5.21 20.66±3.03 30.18±3.16 15.70±2.03 25.79±3.66 11.67±2.67 t值 0.310 8.387 0.780 5.198 0.340 3.902 P值 0.757 <0.001 0.438 <0.001 0.735 <0.001
2.6 不良反应发生情况 两组患儿治疗期间均未出现明显不良反应。
3 讨论
VE是临床常见的中枢神经系统感染性疾病,好发于儿童,其原因主要为儿童免疫功能尚未发育完全,病毒可通过血-脑脊液屏障[11]。VE患儿伴发的精神行为异常是病毒入侵中枢神经系统后的常见精神障碍表现,由于疾病早期临床症状不明显,故常被患儿家长或医生所忽视,但随着病情进一步发展,患儿会逐渐出现意识障碍、精神性运动障碍等症状[12-13],若不及时、积极治疗,则可能并发精神异常,进而严重威胁患儿的生命安全[14]。更昔洛韦是一类新的核苷类广谱抗DNA病毒药物,可通过阻断病毒DNA链的延伸而发挥抗病毒作用,其具体作用机制为抑制细胞内被磷酸化的脱氧尿苷三磷酸盐与DNA内的聚合酶结合,促使其与DNA内的病毒结合,从而抑制DNA病毒生长、繁殖[15-17]。更昔洛韦是目前临床治疗VE的主要药物之一,其易通过血-脑脊液屏障,起效快,临床疗效确切,且不易造成机体耐药[18]。神经节苷脂是营养因子增强剂,其广泛存在于哺乳动物细胞膜中,尤其是中枢神经系统,其作用机制是保护膜结构和功能、调节营养因子、促进神经元再生、调节神经递质功能等[19]。研究表明,神经节苷脂可促进神经元生长、抗神经元损伤[20]。本研究结果显示,研究组患儿临床疗效优于对照组,意识障碍、精神症状、脑膜刺激征、呕吐、发热、抽搐消失时间短于对照组;且两组患儿治疗期间均未出现明显不良反应,提示更昔洛韦联合单唾液酸四己糖神经节苷脂治疗VE伴精神行为异常患儿的临床疗效确切,可有效减轻患儿临床症状,且未增加药物相关不良反应。
BDNF和NT-3为信号传导通路配体,其与受体酪氨酸蛋白激酶(tyrosine protein kinase,Trk)亲和力较高,与TrkA、TrkB、TrkC结合具有明显选择性[21]。BDNF与TrkB结合可激活细胞内丝裂原活化蛋白激酶/细胞外信号调节激酶信号传导通路,这不仅可以促进神经元的发育、分化和再生,还对神经元的存活、形态学改变具有重要意义[22-23]。既往研究表明,BDNF可有效保护神经元免受损伤[24]。BDNF和NT-3为神经营养因子,二者均有助于损伤的髓鞘再生和神经元功能修复。本研究结果显示,治疗后治疗组患儿血清BDNF、NT-3水平高于对照组,提示更昔洛韦联合单唾液酸四己糖神经节苷脂可有效提高VE伴精神行为异常患儿的神经营养因子水平,加速神经元修复,进而改善患儿神经功能。
研究表明,免疫因素在VE的发生、发展过程中发挥着重要作用[25],病毒侵袭可导致免疫应答紊乱,丧失对自身和非自身抗原提呈的识别功能,产生自身细胞免疫或抗体,进而发展为自身免疫系统疾病[26-27]。免疫力对清除病毒具有重要作用,由T淋巴细胞介导的细胞免疫和B淋巴细胞介导的体液免疫可共同协助机体抵抗病原体侵袭[28]。一方面,T淋巴细胞作为免疫效应细胞主要介导细胞免疫;另一方面,T淋巴细胞可作为免疫调节细胞,促使或抑制其他免疫细胞分化和免疫应答[29-30]。T淋巴细胞可根据细胞表面分化抗原种类分为CD4+T淋巴细胞和CD8+T淋巴细胞两个亚群,CD3+T淋巴细胞为总T淋巴细胞,CD4+T淋巴细胞为辅助性T细胞( helper T cells,Th),其分泌的细胞因子又可进一步分化为介导迟发型超敏反应的T淋巴细胞和细胞毒性T淋巴细胞,进而介导细胞免疫、炎症反应。此外,由Th2分泌的IL-6等细胞因子也可辅助B淋巴细胞增殖和抗体产生[31-33]。CD8+T淋巴细胞是细胞毒性T淋巴细胞或抑制性T淋巴细胞,可杀伤或抑制靶细胞,且具有特异性[34]。Th1型的 CD4+T淋巴细胞和CD8+细胞毒性T淋巴细胞可相互影响,共同介导机体免疫调节。当CD+/CD+T淋巴细胞比值降低时,认为机体免疫48功能调节异常[35]。本研究结果显示,治疗后治疗组患儿CD+3T淋巴细胞百分比、CD+T淋巴细胞百分比高于对照组,CD+48T淋巴细胞百分比低于对照组,提示更昔洛韦联合单唾液酸四己糖神经节苷脂可有效改善VE伴精神行为异常患儿免疫功能。
除侵犯神经元、导致神经元坏死外,病毒还会促进各种细胞因子释放,引发炎症反应,促使血管内皮细胞通透性增加并形成水肿,同时炎症反应和水肿也会加重神经系统损伤[36]。TNF-α是炎症反应的始动因子,其加重VE患儿炎症反应和神经功能损伤的病理机制主要如下:(1)介导炎症级联反应;(2)上调诱导型一氧化氮合酶表达;(3)促进激活的白细胞迁移至缺血区,释放自由基并导致继发性损伤;(4)破坏血-脑脊液屏障的完整性,增加其通透性;(5)诱导细胞元凋亡;(6)诱发脑水肿[37-39]。此外,TNF-α还能促进急性期应激反应的发生,进而加重VE患儿病情。IL-6在机体炎症反应、免疫反应和防御等过程中均具有重要作用。研究表明,IL-6与中枢神经系统疾病密切相关[40]。VE患儿脑组织出现中性粒细胞浸润,而中性粒细胞又可释放各类细胞因子,如IL-6、TNF-α等,其中IL-6可直接损伤血管内膜、破坏血管通透性、增加血细胞黏附性、促进凝血、引起炎症递质增多,从而导致细胞死亡[41-42]。本研究结果显示,治疗后治疗组患儿血清TNF-α、IL-6、IL-8水平低于对照组,提示更昔洛韦联合单唾液酸四己糖神经节苷脂可有效降低VE伴精神行为异常患儿炎性因子水平。
综上所述,更昔洛韦联合单唾液酸四己糖神经节苷脂治疗VE伴精神行为异常患儿的临床疗效确切,可有效减轻患儿临床症状,提高患儿神经营养因子水平,改善患儿免疫功能,降低患儿炎性因子水平,且未增加药物相关不良反应。但本研究为单中心研究,观察时间较短,更昔洛韦联合单唾液酸四己糖神经节苷脂治疗VE伴精神行为异常患儿的远期临床疗效仍有待进一步研究探讨。
作者贡献:成亚渝进行文章的构思与设计,数据收集、整理、分析,负责撰写、修订论文;成亚渝、高航进行研究的实施与可行性分析,结果分析与解释;高航负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
