吸烟对下呼吸道微生物菌群结构的影响研究
2022-01-10王丽娜卢震钰王颖李媛云春梅孙德俊高笑宇
王丽娜,卢震钰,王颖,李媛,云春梅,孙德俊,高笑宇
吸烟每年造成约700多万人死亡,已成为全球重要公共卫生问题之一[1]。世界卫生组织估计,全世界每天死于吸烟者达8 000人;在发达国家中,吸烟与80%~90%肺癌患者的死亡有关,与75%支气管炎及肺气肿患者的死亡有关,与25%心脏病患者的死亡有关[2]。研究发现,30%癌症患者的死亡与吸烟有关[3]。在我国,吸烟者已超过3亿人,每年死于烟草相关疾病的人数高达百万[4]。
香烟烟雾通过口腔进入气道扩散至肺部,由香烟烟雾引发的机体改变从上、下呼吸道开始。痰液是机体自然状态下的气道分泌物,具有丰富的细胞和生化物质成分,能够客观反映气道状态以及肺部生理学特征。研究表明,微生物可通过“肺-肠轴”联合作用影响机体的病理生理状态,从而导致机体疾病的易感性[5]。本研究通过痰液微生物高通量测序技术分析吸烟对下呼吸道微生物菌群结构的影响,以预测其对机体生命活动的影响。
1 对象与方法
1.1 研究对象 选取2018年10月至2019年10月于内蒙古自治区人民医院健康体检中心招募的志愿者55例为研究对象。其中男30例,女25例;年龄18~65岁,平均(46.1±11.6)岁。纳入标准:(1)近1个月内未使用抗生素或免疫抑制剂;(2)年龄18~70岁;(3)近4周无发热、咳嗽和上呼吸道症状等急性呼吸道疾病;(4)对本研究知情同意,并签署知情同意书。排除标准:(1)已知有任何肺部疾病史或肺功能检测异常史者;(2)有严重的心脏、消化、神经、内分泌系统疾病者。按照吸烟情况,将研究对象分为吸烟组(22例)和不吸烟组(33例),其中吸烟的定义为一生中连续或累积吸烟6个月或以上[6]。吸烟组中男22例,女0例;年龄30~66岁,平均(51.9±9.8)岁。不吸烟组中男8例,女25例;年龄17~56岁,平均(42.2±11.1)岁。吸烟组男性占比(χ2=30.556,P<0.001)、年龄(t=-3.331,P=0.002)高于不吸烟组,差异有统计学意义。本研究经内蒙古自治区人民医院伦理委员会批准。本研究对象无职业暴露,生活燃料主要以天然气和电为主,无生物燃料暴露。
1.2 痰液微生物高通量测序技术
1.2.1 样本采集与处理 参考文献[7]对研究对象进行痰诱导,取0.3 g痰栓,加入0.1%二硫苏糖醇(dithiothreitol,DTT)混匀,37 ℃水浴处理15 min,室温10 000 r/min离心10 min(离心半径7 cm),弃上清液,将沉淀置于-80 ℃冰箱保存待用。
1.2.2 DNA提取与测序 使用基因组DNA提取试剂盒提取基因组总DNA,将其寄送至上海天昊生物科技有限公司进行微生物扩增子测序,该技术在Illumina HiSeq 2000平台上进行操作。
1.3 统计学方法 采用GraphPad Prism 9.0软件进行数据分析。符合正态分布的计量资料以(±s)表示,组间比较采用两独立样本t检验;计数资料以相对数表示,组间比较采用χ2检验。α多样性指数(包括Shannon指数和Simpson指数,用于度量微生物菌群丰度和多样性)、差异微生物比较采用Wilcoxon rank-sum test秩和检验。β多样性指数(用于测度群落的物种多样性沿着环境梯度变化的速率或群落间物种组成的多样性)比较采用Adonis检验,基于Bray-Curtis距离进行主成分分析(principal component analysis,PCA),采用散点图表示微生物菌群结构的多样性。以P<0.05为差异有统计学意义。采用韦恩图表示吸烟组和不吸烟组共有和独有的菌群数量。采用非参数Kruskal-Wallis秩和检验筛选不同分组间菌群相对丰度存在显著差异的物种,用线性判别分析(linear discriminant analysis,LDA)评估每个菌群相对丰度差异显著的物种的效应值(即LDA值,默认进行log以10为底的对数转化,绝对值越大则越易区分组别)(以|LDA值|>2且P<0.05作为差异筛选阈值)。优势物种网络图分析说明:选择至少在60%的样本中出现的操作分类单元(operational taxonomic units,OTU),计算物种之间的Pearson相关系数,选择P<0.05的相关OTU。功能预测分析中,对组间菌群相对丰度差异显著的功能基于京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库中富集的通路绘制条形图。
2 结果
2.1 吸烟对微生物丰度与菌群结构组成的影响吸烟组Shannon指数高于不吸烟组(χ2=0.418,P=0.016),Simpson指数低于不吸烟组(χ2=0.458,P=0.026),差异有统计学意义,见图1。Adonis检验及PCA结果显示,吸烟组与不吸烟组β多样性指数比较,差异有统计学意义(R2=0.096,P=0.048),见图2。韦恩图分析结果显示,吸烟组和不吸烟组共有菌群1 146个,不吸烟组独有菌群1 080个,吸烟组独有菌群841个,见图3。
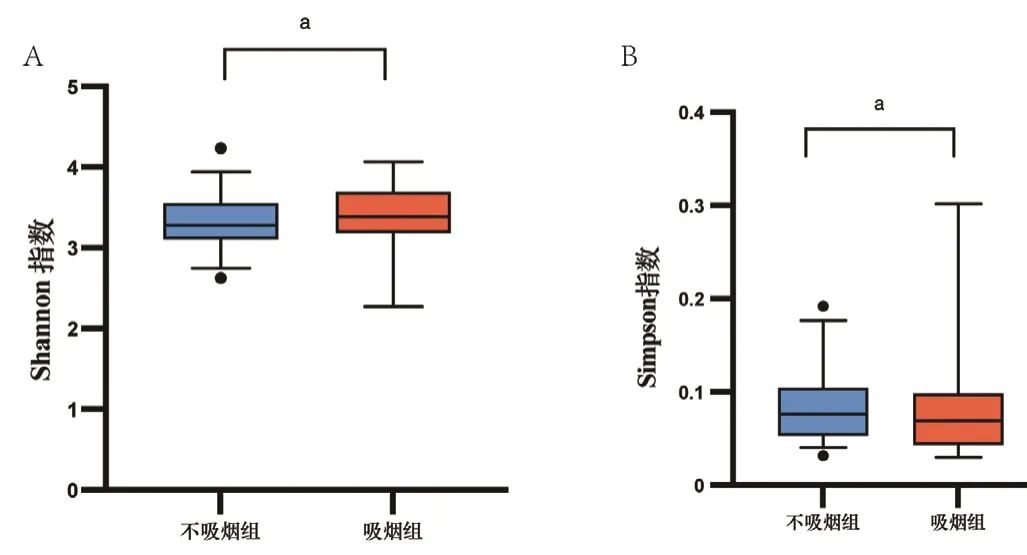
图1 吸烟组与不吸烟组α多样性指数比较的箱式图Figure 1 Box plot of α diversity index comparison between smoking group and non-smoking group
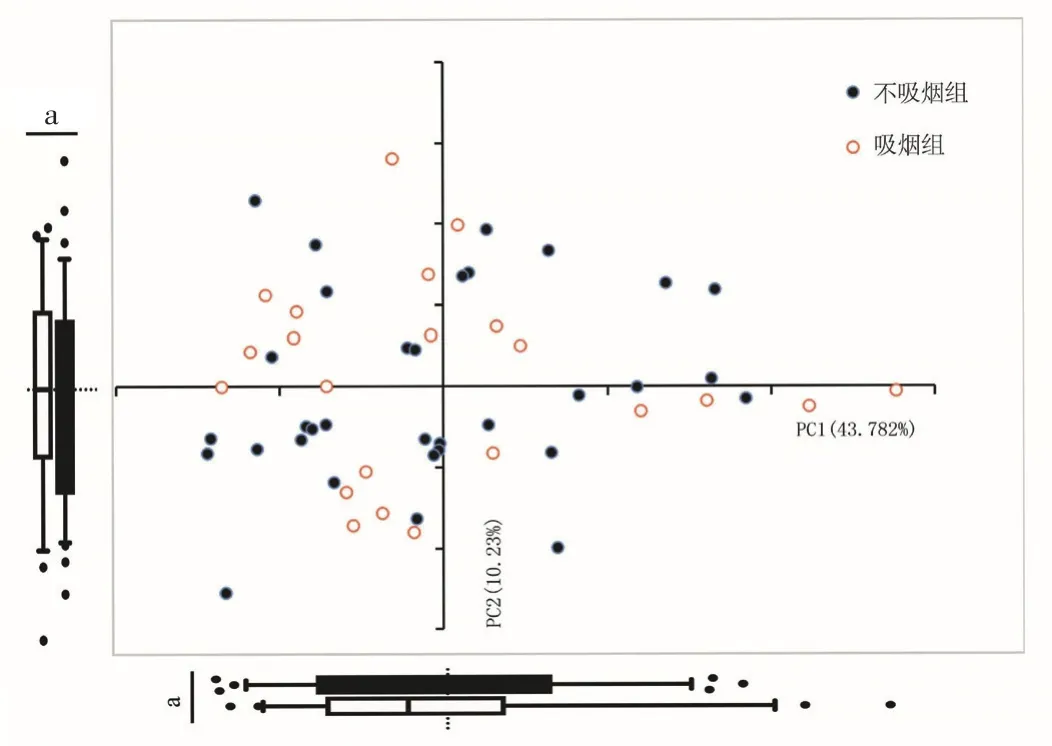
图2 吸烟组与不吸烟组β多样性指数比较的散点图Figure 2 Scatter plot of β diversity index comparison between smoking group and non-smoking group
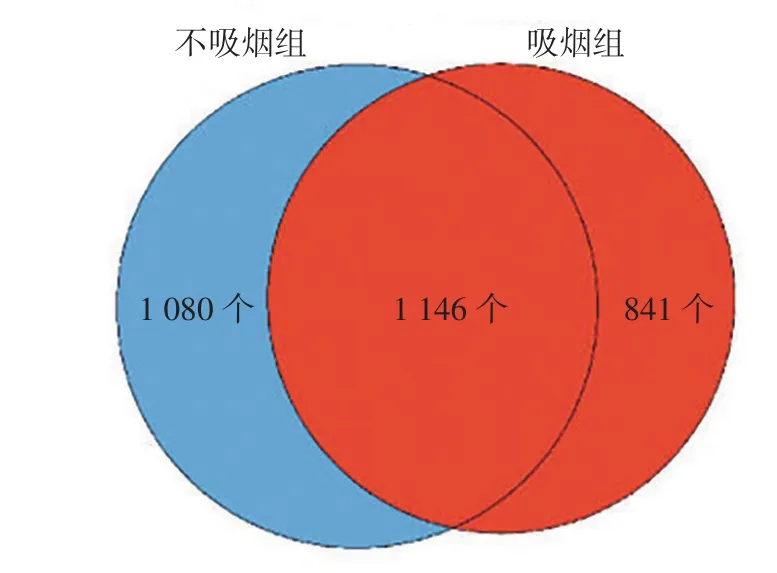
图3 吸烟组与不吸烟组菌群数量的韦恩图Figure 3 Venn diagram of the number of bacteria in smoking group and non-smoking group
2.2 吸烟对微生物菌群结构的影响 在纲水平上,按照菌群相对丰度降序排列,差异菌群分别是芽孢杆菌纲(Bacilli)、拟杆菌纲(Bacteroidia)、梭杆菌纲(Fusobacteria)、β-变形菌纲(Betaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、放线菌纲(Actinobacteria)、厌氧菌纲(Negativicutes)、梭菌纲(Clostridia)、黄杆菌纲(Flavobacteria)以及其他纲。纲水平微生物在吸烟组中的优势菌群为:Bacilli(不吸烟组占31.27%,吸烟组占30.19%)、Bacteroidia(不吸烟组占28.79%,吸烟组占29.33%)、Fusobacteriia(不吸烟组占5.96%,吸烟组占6.11%),见图4A。
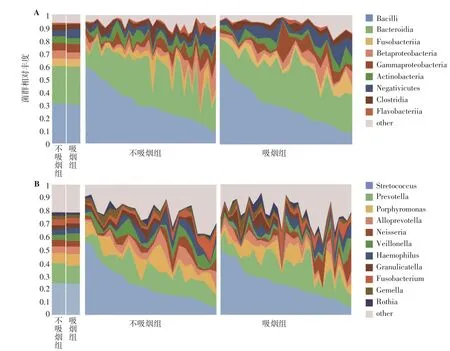
图4 吸烟组和不吸烟组优势物种网络图Figure 4 Map of dominant species networks in smoking group and non-smoking group
在属水平上,按照菌群相对丰度降序排列,差异菌群分别是链球菌属(Streptococcus)、普雷沃氏菌属(Prevotella)、卟啉单胞菌属(Porphyromonas)、拟普雷沃氏菌属(Alloprevotella)、奈瑟菌属(Neisseria)、韦荣氏球菌属(Veillonella)、嗜血杆菌属(Haemophilus)、颗粒链菌属(Granulicatella)、梭杆菌属(Fusobacterium)、孪生球菌(Gemella)、罗斯氏菌属(Rothia)以及其他菌属。属水平微生物在吸烟组中的优势菌群为:Streptococcus(不吸烟组占24.24%,吸烟组占23.71%)、Prevotella(不吸烟组占15.36%,吸烟组占14.06%)、Porphyromonas(不吸烟组占8.00%,吸烟组占9.05%),见图4B。
比较吸烟组和不吸烟组下呼吸道菌群相对丰度差异显著的微生物,共有1纲、2目、1科、8属及8种差异微生物。其中吸烟组增加的菌群为Selenomonadales目、巨球型菌属(Megasphaera)、Faucicola属、Sphaerochaeta属、Shuttleworthia属、Anaeroglobus属、巨球形菌(Megasphaera micronuciformis)、Spirochaeta canine oral taxon 379、未分类的普氏菌(UnculturedPrevotella)、Prevotella sp.oral clone FW035;不吸烟组增加的菌群为鞘脂杆菌纲(Sphingobacteriia)、鞘脂杆菌目(Sphingobacteriales)、噬几丁质科(Chitinophagaceae)、伯克霍尔德菌(Burkholderia)、弧菌属(Vibrionimonas)、罗尔斯通氏菌属(Ralstonia)、真口腔普雷沃氏菌(Prevotella veroralis)、Catonella sp.oral clone FL037、噬淀粉密螺旋体(Treponema amylovorum)、咽峡炎链球菌(Streptococcus anginosus),见图5。
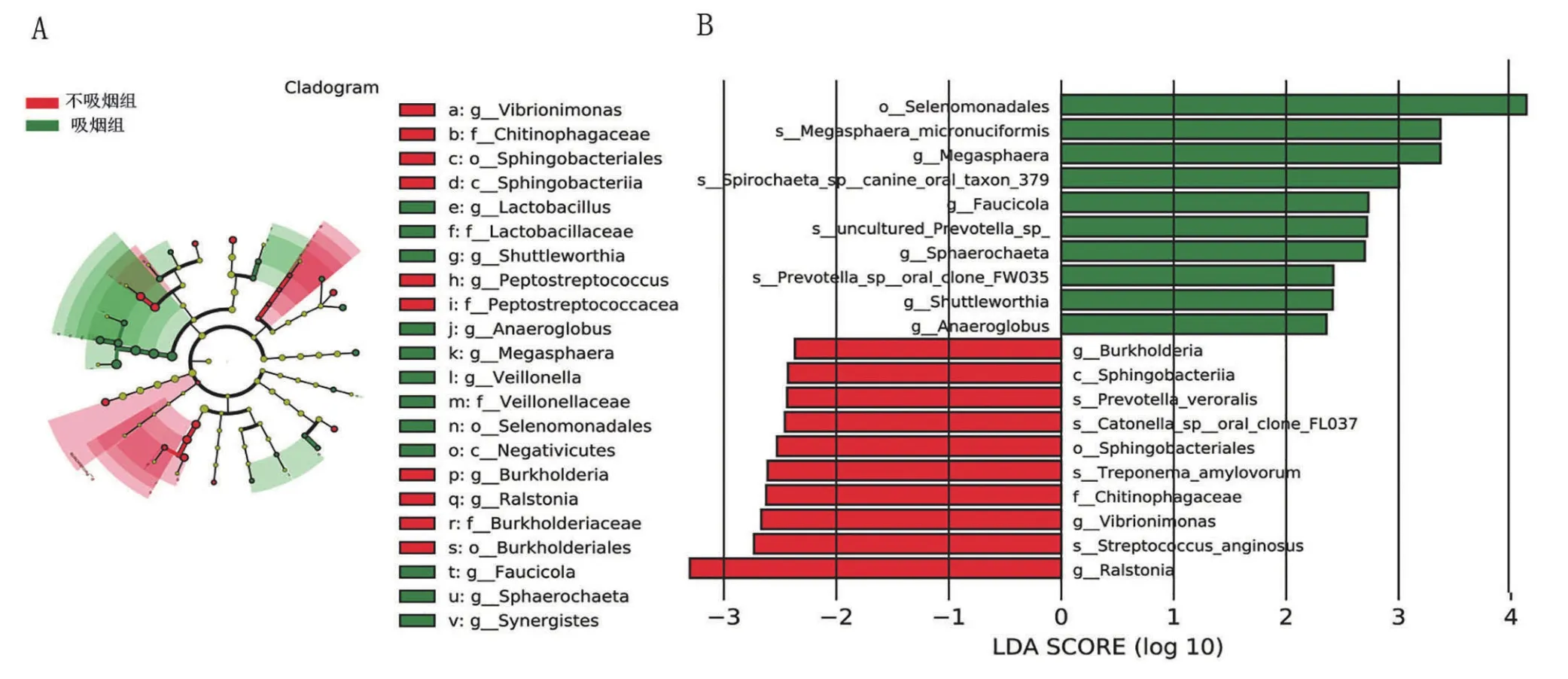
图5 吸烟组与不吸烟组的差异微生物Figure 5 Differential bacteria between smoking group and non-smoking group
2.3 差异微生物间的相关性分析 对吸烟组和不吸烟组的差异微生物(属水平)进行相关性分析,结果显示,吸烟组和不吸烟组的差异微生物(属水平)间均呈正相关(r≥0.6),这些差异微生物分别来自Negativicutes纲、Bacilli、Bacteroidia、Actinobacteria、Fusobacteria 和丹毒丝菌纲(Erysipelotrichia)的24个属,见图6。
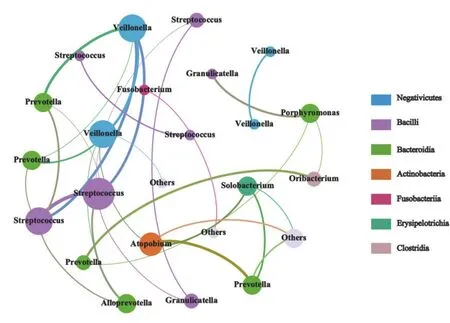
图6 吸烟组和不吸烟组差异微生物的相关性分析Figure 6 Correlation analysis of different microorganisms between smoking group and non-smoking group
2.4 差异微生物的功能预测 基于差异微生物的OTU结果,预测吸烟组和不吸烟组差异微生物的功能,见图7。吸烟组和不吸烟组主要在物质合成、降解和运输相关通路上存在差异。吸烟组功能富集的生命活动包括:安沙霉素类生物合成(ko01051)、赖氨酸生物合成(ko00300)、戊糖和葡萄糖醛酸的相互转化(ko00040)、泛酸盐和辅酶A生物合成(ko00770)、蛋白运输(ko03060)等;不吸烟组主要富集的生命活动包括:甲苯降解(ko00623)、霍乱弧菌致病循环(ko05111)、柠檬烯和蒎烯降解(ko00903)、光合作用(ko00195)、二噁英降解(ko00621)等。
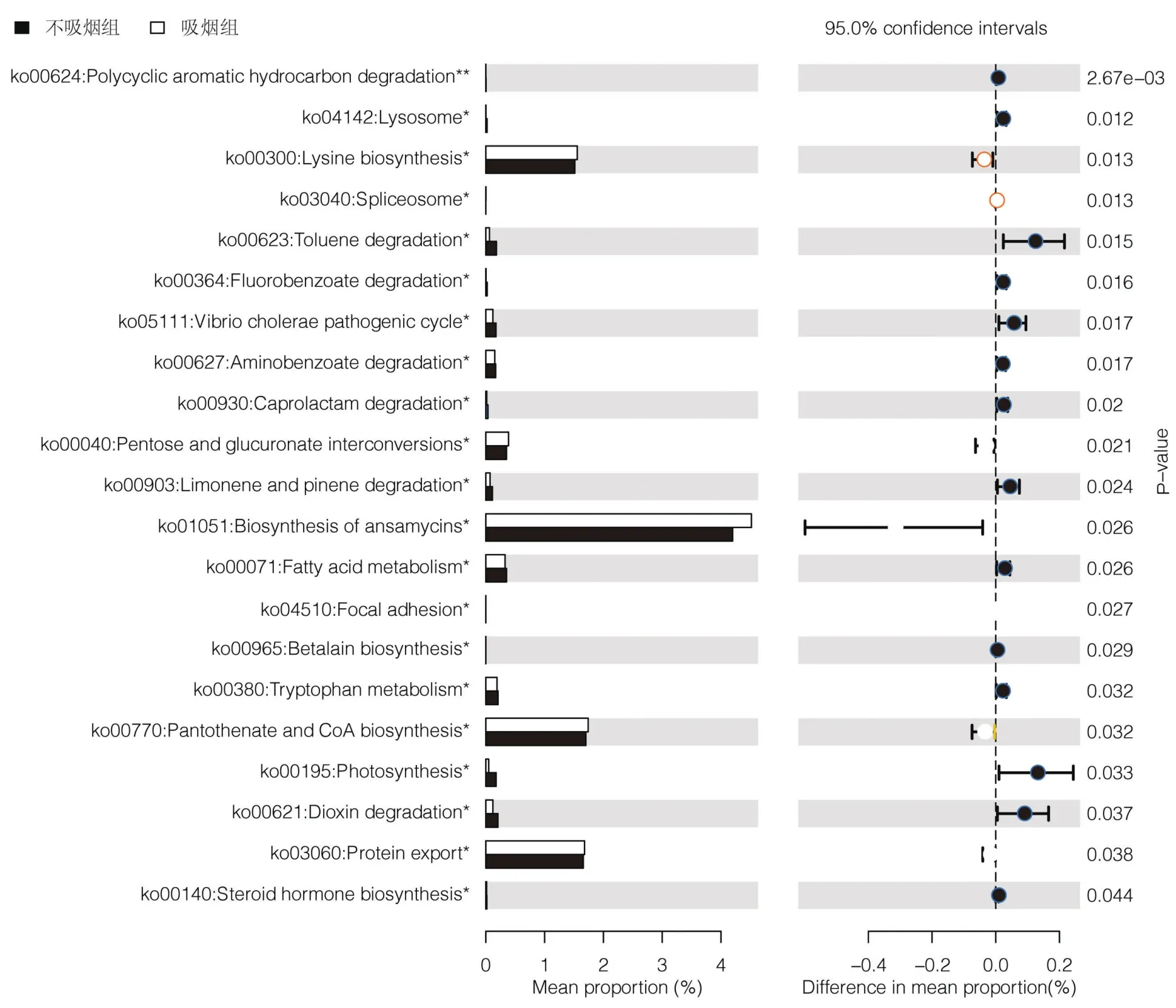
图7 吸烟组和不吸烟组差异微生物的功能Figure 7 Differential microbial function between smoking group and non-smoking group
3 讨论
吸烟是全球可预防的主要死因和致残原因,是世界上主要的公共卫生问题之一。中国吸烟者的比例在全球最高,卷烟消费量占全球40%以上[8],每年因吸烟死亡的人数占全球死亡人数的11.5%[9]。烟草可增加心血管系统疾病、呼吸系统疾病、生殖系统疾病、牙周疾病以及癌症等的发生风险,是导致疾病的重要危险因素[10]。香烟烟雾是一种气溶胶,由气体和固态颗粒组成,目前鉴定出其包含4 700多种物质,包括中性气体、碳氧化物、氮氧化物等[11],这些颗粒经气道吸入,大颗粒沉积到气管、支气管,小颗粒沉积到肺泡,不能被有效清除,从而导致慢性炎症,这可能在肺部疾病的进展中起到促进作用[12]。目前,吸烟的危害已经明确,但是其作用机制还不完全清楚。本研究通过痰液微生物高通量测序技术分析吸烟对下呼吸道微生物菌群结构的影响,从微生物角度评估吸烟的危害,以期揭示吸烟对机体产生危害的作用机制。
本研究结果显示,吸烟组男性占比、年龄高于不吸烟组,可能与样本量较小有关,但目前并没有文章表示患者年龄及性别会对气道菌群结构产生影响。本研究结果显示,吸烟组Shannon指数高于不吸烟组,Simpson指数低于不吸烟组,表明吸烟增加微生物菌群丰度。Adonis检验及PCA结果显示,吸烟组与不吸烟组β多样性指数比较有统计学差异,表明吸烟对微生物菌群结构组成的影响较大。韦恩图分析结果显示,吸烟组和不吸烟组共有菌群1 146个,不吸烟组独有菌群1 080个,吸烟组独有菌群841个,表明吸烟可以改变人体的气道菌群数量。
据报道,香烟烟雾处理后小鼠下呼吸道中相对丰度较高的菌群包括:γ-变形杆菌纲、α-变形杆菌纲、芽孢杆菌纲、β-变形杆菌纲、梭菌纲和放线菌纲[13];在属水平上最丰富的3种菌群为嗜盐单胞菌属、鞘脂单胞菌属和乳酸菌属[14]。本研究结果显示,在纲水平上,按照菌群相对丰度降序排列,排名前5位的差异菌群分别是 Bacilli、Bacteroidia、Fusobacteria、Betaproteobacteria、Gammaproteobacteria; 在 属 水 平上,按照菌群相对丰度降序排列,排名前5位的差异菌群 分 别 是 Streptococcus、Prevotella、Porphyromonas、Alloprevotella、Neisseria;表明人与小鼠下呼吸道菌群具有一定差异,提示不同物种间下呼吸道菌群结构可能有所不同。一项对吸烟者和非吸烟者口腔咽拭子微生物的研究发现,在属水平上,吸烟可增加放线菌属、韦荣氏球菌属、奈瑟菌属、罗斯氏菌属和普雷沃菌属的相对丰度[15]。本研究结果显示,吸烟组中Veillonella的相对丰度增加,Neisseria、Rothia以及Prevotella的相对丰度均下降,这可能是由于上、下呼吸道微生物菌群结构差异导致的。另一项研究发现,吸烟者口腔中链球菌属和巨球型菌属的相对丰度增加[16],且烟雾暴露程度越高,巨球型菌属的相对丰度越高[17]。本研究也发现,吸烟组中上述两个菌属的相对丰度增加了,表明吸烟这一暴露因素可能会对上、下呼吸道菌群造成相同的影响。在肠道中吸烟增加丹毒丝菌纲和链状细菌的相对丰度[18],本研究得到了类似的结果,吸烟会影响下呼吸道中Erysipelotrichia的数量。综上,吸烟对上、下呼吸道以及肠道微生物具有潜在的作用,并且受到影响的微生物的变化在不同组织器官中具有一致性。
据报道,健康肺组织中的优势菌群在属水平上为普氏菌、韦永氏菌、链球菌、假单胞菌、梭杆菌,并存在少量嗜血杆菌和奈瑟菌[19-20];在门水平上为变形杆菌、厚壁菌门、梭杆菌、放线菌和拟杆菌等[21-22]。本研究结果显示,纲水平微生物在吸烟组中的优势菌群为:Bacilli、Bacteroidia、Fusobacteria;属水平微生物在吸烟组中的优势菌群为:Streptococcus、Prevotella、Porphyromonas。对比发现,本研究结果与上述研究结果[19-20]有一定差异,主要为本研究吸烟组优势菌群没有假单胞菌,而增加了Porphyromonas、Gemella以及Rothia等。目前,关于吸烟对下呼吸道微生物菌群结构影响的相关研究较少,主要集中于口腔和肠道微生物。研究表明,无论吸烟者牙周状况如何(健康、牙龈炎或牙周炎),其牙周微生物菌群均处于失调状态,吸烟的牙龈炎/牙周炎患者经治疗后临床症状消失,但其微生物稳态仍然处于失调状态,分析原因为尼古丁暴露影响变形链球菌、血链球菌和念珠菌的生物膜形成[14]。在胃肠道中,吸入的香烟烟雾通过抗菌活性和肠道微环境调节等不同机制诱导胃肠道微生物菌群失调[23]。吸烟对肠道的影响包括肠道微生物组的变化、黏膜通透性增加和黏膜免疫反应受损。然而,吸烟对肠道微生物菌群结构失调的影响及潜在机制在很大程度上是未知的[24]。综上,吸烟对于机体不同部位微生物稳态的影响比较明确,其作用主要集中于对黏膜和免疫反应的影响,然而,上述作用的途径与机制尚不清楚。
长期吸烟会使机会性致病菌在相关组织器官持续定植,导致疾病持续加重或进展[25-27]。本研究结果显示,本研究对吸烟组和不吸烟组的差异微生物(属水平)进行相关性分析,结果显示,吸烟组和不吸烟组的差异微生物(属水平)间均呈正相关(r≥0.6),这些差异微生物分别来自Negativicutes纲、Bacilli、Bacteroidia、Actinobacteria、Fusobacteria和Erysipelotrichia的24个属,说明长期吸烟对下呼吸道菌群的数量变化具有影响。本研究基于差异微生物的OTU结果,预测吸烟组和不吸烟组差异微生物的功能,结果显示,吸烟组和不吸烟组主要在物质合成、降解和运输相关通路上存在差异。吸烟组功能富集的生命活动包括:安沙霉素类生物合成、赖氨酸生物合成、戊糖和葡萄糖醛酸的相互转化、泛酸盐和辅酶A生物合成、蛋白运输等;不吸烟组主要富集的生命活动包括:甲苯降解、霍乱弧菌致病循环、柠檬烯和蒎烯降解、光合作用、二噁英降解等。说明菌群结构的变化会影响人体代谢和多种生理功能。一项针对美国成年人的口腔微生物学研究发现,吸烟者中与有氧代谢(三羧酸循环和氧化磷酸化)途径相关的微生物菌群相对丰度降低,而与氧无关的代谢(糖酵解、果糖、半乳糖和蔗糖代谢以及光合作用)途径相关的微生物菌群相对丰度升高;并且差异菌群表征的代谢与苯乙烯和甲苯降解、三羧酸循环和氧化磷酸化呈正相关,而与糖酵解和其他碳水化合物代谢途径呈负相关[28]。这可能与吸烟造成的无氧或兼性厌氧环境有关。综上,吸烟通过作用于机体的代谢途径而影响其生命活动及状态。
本研究尚存在一定局限性:首先,吸烟组没有女性受试者入选,因为我国的吸烟者绝大部分是男性,女性较少;其次,本研究采集的样本为痰液,口腔中的微生物可能对测序结果造成影响;最后,本研究样本量较小。今后有必要在长期随访的更大样本量的队列研究中确定吸烟对下呼吸道菌群的影响。
综上所述,吸烟能够增加下呼吸道微生物菌群相对丰度,影响微生物菌群结构组成,改变相关物质合成、降解和运输通路,吸烟暴露下呼吸道微生物组的功能改变可能会影响宿主的内环境稳态,打破体内免疫系统的平衡,从而引发肺部疾病。
作者贡献:王丽娜进行文章的构思与设计,研究的可行性分析,撰写论文;王颖、李媛进行样本的收集和处理;云春梅、孙德俊进行文献的收集与整理;卢震钰进行文章校对;高笑宇负责文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。
