续断鉴别及川续断皂苷VI的含量测定
2021-12-24艾光丽艾青青
艾光丽,艾青青,高 鹏
(成都市食品药品检验研究院/国家药品监督管理局中药材质量监测评价重点实验室,四川 成都 610045)
续断为川续断科植物川续断DipsacusasperWall.ex Henry的干燥根,具有补肝肾、强筋骨、续折伤、止崩漏的功效[1]。现代研究表明,续断主要含有三萜皂苷、环烯醚萜苷、生物碱等成分[2-4],其中三萜皂苷类成分川续断皂苷Ⅵ为主要活性成分,具有促进骨髓间质干细胞增殖和向成骨细胞分化以及促进骨伤愈合、抗骨质疏松的作用[5-7]。续断主产于湖北、湖南、重庆、四川、贵州等省市[2-3]。《中国药典》2020版第一部“续断鉴别及含量测定”项下方法较为复杂,故本研究对其薄层鉴别及含量测定进行了改进,报道如下。
1 仪器与试药
仪器:Waters2695-2998高效液相色谱仪(美国Waters公司);Agilent 1200高效液相色谱仪(德国安捷伦科技有限公司);Thermo UltiMate 3000高效液相色谱仪(美国赛默飞世尔科技有限公司);CAMAG自动点样器;ME204E电子天平(瑞士梅特勒-托利多公司);SK250H超声波清洗器;默克(Merck)HPTLC高效薄层层析板等。
对照品:川续断皂苷VI(111685-201908,含量为94.3%);续断对照药材(121033-201812);均由中国食品药品检定研究院提供。
样品:续断样品32批,其中四川23批、贵州2批、云南7批。
2 方法与结果
2.1 薄层色谱鉴别
2.1.1 供试品溶液的制备 取续断粉末0.1 g,加20 mL甲醇,超声处理20 min,作为供试品溶液。
2.1.2 对照药材溶液的制备 取续断对照药材0.1 g,加20 mL甲醇,超声处理20 min,作为对照药材溶液。
2.1.3 对照品溶液的制备 取川续断皂苷VI对照品,加甲醇制成每 1 mL约含 0.2 mg的溶液,作为对照品溶液。
2.1.4 点样量 吸取续断对照药材溶液、续断供试品溶液、川续断皂苷VI对照品溶液各 10 μL,分别点于同一高效硅胶G薄层板上。
2.1.5 展开系统的筛选 (1)药典方法:参照2020年版《中国药典》一部“续断”项下鉴别(2)的方法,发现此方法显色不明显且处理方法较繁琐,故对其进行了改进。薄层色谱,见图1。
吴参谋没有跑,他让手下弟兄迅速抢占有利地形,阻击四周云集的鬼子,他深知自己挡不了鬼子多久,但只要多挡一分钟,孔老一他们就多一分活着逃脱的希望。

注:1.川续断皂苷VI;2.续断对照药材;3.CD-1;4.CD-2;5.CD-3;6.CD-4;7.CD-5;8.CD-6;9.CD-7;10.CD-8;11.CD-9;12.CD-10。图1 药典方法薄层色谱
(2)选定方法:将续断对照药材溶液、续断供试品溶液、川续断皂苷VI对照品溶液分别点于同一高效硅胶G薄层板上,以二氯甲烷-甲醇-水(14∶7∶2)的下层溶液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105 ℃下加热至斑点显色清晰,分别置日光和紫外光灯(365 nm)下检视。发现此方法下供试品与对照药材相对应的斑点更多,颜色更清晰,分离效果更好,操作更简便,且Rf值适中,故认为运用此方法分离续断中的有效成分较为适宜。薄层色谱,见图2、图3。

注:1.川续断皂苷VI;2.续断对照药材;3.CD-1;4.CD-2;5.CD-3;6.CD-4;7.CD-5;8.CD-6;9.CD-7;10.CD-8;11.CD-9;12.CD-10。图2 选定方法薄层色谱日光图
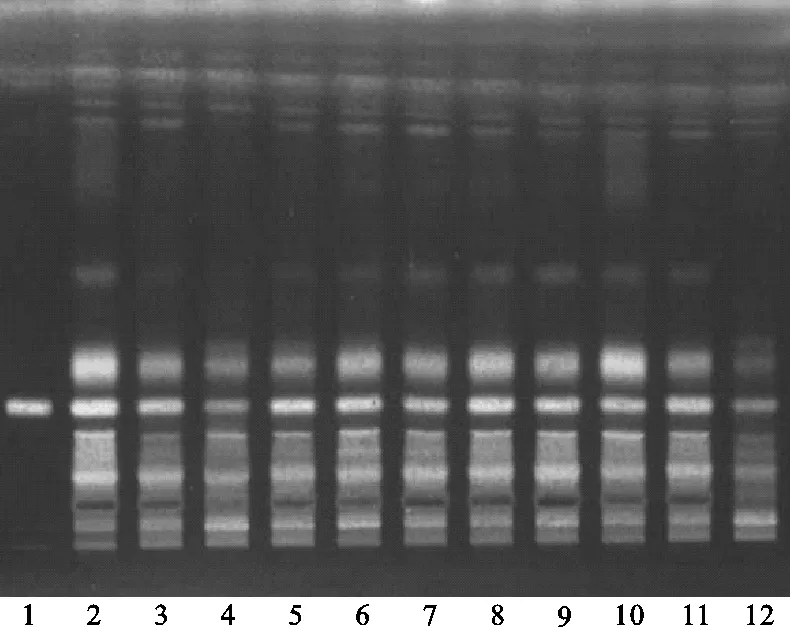
注:1.川续断皂苷VI;2.续断对照药材;3.CD-1;4.CD-2;5.CD-3;6.CD-4;7.CD-5;8.CD-6;9.CD-7;10.CD-8;11.CD-9;12.CD-10。图3 选定方法薄层色谱紫外图
(3)其他薄层色谱展开条件筛选:方法①:将续断对照药材溶液、续断供试品溶液、川续断皂苷VI对照品溶液分别点于同一高效硅胶G薄层板上,以二氯甲烷-甲醇-水(14∶6∶2)的下层溶液为展开剂,此方法薄层色谱中供试品与对照药材相对应的斑点多,颜色清晰,分离效果好,但川续断皂苷VI的Rf值较低,故该展开系统不适合用于续断定性鉴别。薄层色谱,见图4、图5。

注:1.川续断皂苷VI;2.续断对照药材;3.CD-1;4.CD-2;5.CD-3;6.CD-4;7.CD-5;8.CD-6;9.CD-7;10.CD-8;11.CD-9;12.CD-10。图4 方法①薄层色谱日光图
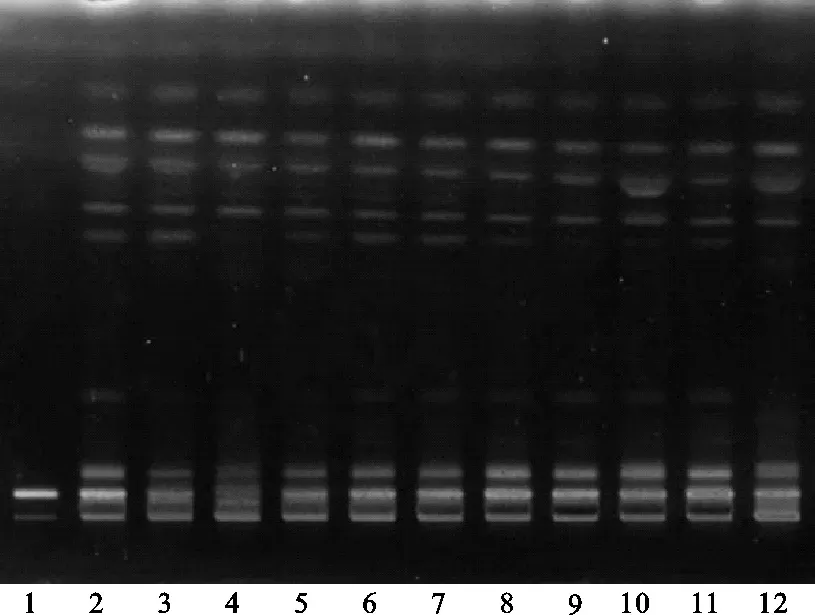
注:1.川续断皂苷VI;2.续断对照药材;3.CD-1;4.CD-2;5.CD-3;6.CD-4;7.CD-5;8.CD-6;9.CD-7;10.CD-8;11.CD-9;12.CD-10。图5 方法①薄层色谱紫外图
方法②:将续断对照药材溶液、续断供试品溶液、川续断皂苷VI对照品溶液分别点于同一高效硅胶G薄层板上,以二氯甲烷-甲醇-水(13∶6∶2)[8]的下层溶液为展开剂,此方法薄层色谱中供试品与对照药材相对应的斑点多,颜色清晰,分离效果好,但川续断皂苷VI的Rf值较低,故该展开系统不适合用于续断定性鉴别。薄层色谱,见图6、图7。

注:1.川续断皂苷VI;2.续断对照药材;3.CD-1;4.CD-2;5.CD-3;6.CD-4;7.CD-5;8.CD-6;9.CD-7;10.CD-8;11.CD-9;12.CD-10。图6 方法②薄层色谱日光图
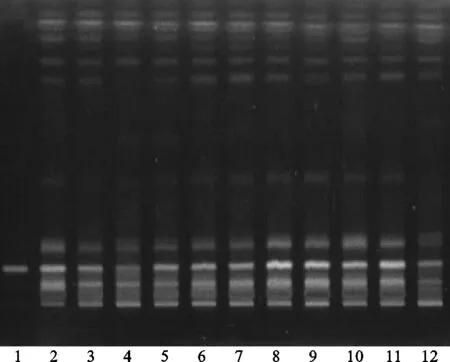
注:1.川续断皂苷VI;2.续断对照药材;3.CD-1;4.CD-2;5.CD-3;6.CD-4;7.CD-5;8.CD-6;9.CD-7;10.CD-8;11.CD-9;12.CD-10。图7 方法②薄层色谱紫外图
方法③:将续断对照药材溶液、续断供试品溶液、川续断皂苷VI对照品溶液分别点于同一高效硅胶G薄层板上,正丁醇-乙酸-水(4∶1∶5)[9]的上层溶液为展开剂,此方法薄层色谱中供试品与对照药材相对应的斑点颜色清晰,Rf值适中,但川续断皂苷VI的分离效果差,故该展开系统不适合用于续断定性鉴别。薄层色谱,见图8、图9。
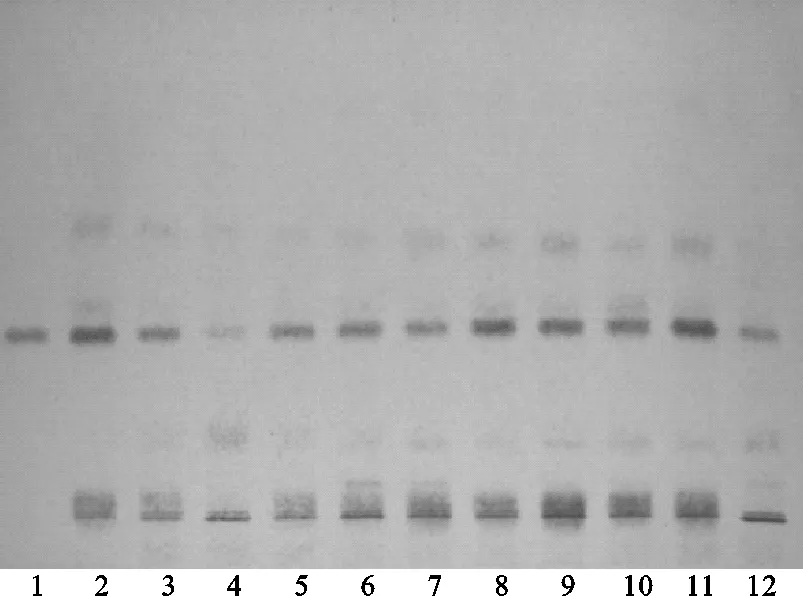
注:1.川续断皂苷VI;2.续断对照药材;4.CD-1;4.CD-2;5.CD-3;6.CD-4;7.CD-5;8.CD-6;9.CD-7;10.CD-8;11.CD-9;12.CD-10。图8 方法③薄层色谱日光图

注:1.川续断皂苷VI;2.续断对照药材;3.CD-1;4.CD-2;5.CD-3;6.CD-4;7.CD-5;8.CD-6;9.CD-7;10.CD-8;11.CD-9;12.CD-10。图9 方法③薄层色谱紫外图
方法④:将续断对照药材溶液、续断供试品溶液、川续断皂苷VI对照品溶液分别点于同一高效硅胶G薄层板上,正丁醇-冰醋酸-水(4∶1∶5)[10]的上层溶液为展开剂,此方法薄层色谱中供试品与对照药材相对应的斑点颜色清晰,Rf值适中,但川续断皂苷VI的分离效果差,故该展开系统不适合用于续断定性鉴别。薄层色谱,见图10、图11。
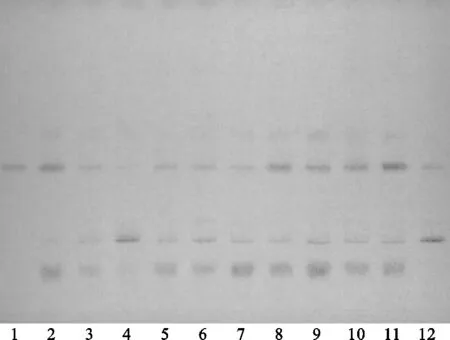
注:1.川续断皂苷VI;2.续断对照药材;4.CD-1;4.CD-2;5.CD-3;6.CD-4;7.CD-5;8.CD-6;9.CD-7;10.CD-8;11.CD-9;12.CD-10。图10 方法④薄层色谱日光图

注:1.川续断皂苷VI;2.续断对照药材;3.CD-1;4.CD-2;5.CD-3;6.CD-4;7.CD-5;8.CD-6;9.CD-7;10.CD-8;11.CD-9;12.CD-10。图11 方法④薄层色谱紫外图
2.2 川续断皂苷VI的含量测定
2.2.1 色谱条件 以C18(250 mm×4.6 mm,5 μm)为色谱柱;以乙腈∶水(30∶70)为流动相;体积流量为1 mL/min;检测波长212 nm,柱温35 ℃,进样量 10 μL。在上述色谱条件下,川续断皂苷VI与其他色谱峰分离较好,分离度>1.5,且空白溶剂无干扰。见图12。

注:A.对照品;B.样品;C.空白溶剂;1.熊果酸。图12 川续断皂苷VI专属性色谱图
2.2.2 对照品溶液的制备 取川续断皂苷VI对照品适量,精密称定,加甲醇制成每1 mL含0.2 mg的对照品溶液。
2.2.3 供试品溶液的制备 取本品细粉0.5 g,置具塞锥形瓶中,精密加入甲醇100 mL,密塞,称定重量,超声处理(功率250 W,频率40 kHz)20 min,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.2.4 线性关系与标准曲线 精密称取川续断皂苷VI对照品7.915 mg,置10 mL容量瓶中,加甲醇使溶解并稀释至刻度,作为对照品溶液。精密吸取上述溶液各0.1、0.2、0.3、0.4、0.5、0.6 mL,分别置10 mL容量瓶中,加甲醇稀释至刻度。测定结果显示川续断皂苷VI进样浓度在7.463 8~44.783 1 μg/mL范围内与峰面积呈良好的线性关系;回归方程:y=3446.113 5x-4 860.733 3;相关系数R2=0.999 9。
2.2.5 精密度试验 精密吸取川续断皂苷VI对照品溶液10 μL(0.182 2 mg·mL-1),注入液相色谱仪中,连续进样6次,测得其峰面积并计算川续断皂苷VI峰面积的RSD<3.0%,结果表明仪器的精密度良好。
2.2.6 稳定性试验 精密吸取同一供试品溶液10 μL(批号CD-3),分别在0、6、10、12、14、16、20、24 h依次进样,测定其峰面积并计算,川续断皂苷VI峰面积的RSD<3.0%,结果表明供试品溶液在24 h 内稳定性良好。
2.2.7 重复性试验 精密称取同一批样品6份(批号CD-3),按“2.2.3”项下方法制备供试品溶液,进样10 μL依法测定峰面积并计算,川续断皂苷VI含量的RSD为<3.0%,表明该方法重复性较好。
2.2.8 加样回收率试验 取已知含量的供试品(CD-2)9份,每份0.25 g,精密称定,分成3组,每组3份,3组分别加入川续断皂苷VI对照品溶液(浓度为4.640 7 mg/mL)0.5 mL,1 mL,1.5 mL。按拟定的方法制成供试品溶液,计算9份供试品的加样回收率。结果显示,川续断皂苷VI的加样回收率为101.37%~102.68%,RSD为0.45%,<3.0%,表明该方法准确度良好。见表1。

表1 川续断皂苷VI加样回收率试验结果
2.2.9 样品含量测定 取收集的32批续断样品,按选定方法测定川续断皂苷VI的含量。见表2。

表2 32批续断样品含量测定结果
3 讨论
续断有效成分主要是皂苷或苷类成分,易溶于甲醇,故选择甲醇作为提取溶剂。三氯甲烷、二氯甲烷对皂苷类成分分离效果较好,故选择毒性相对较小的二氯甲烷作为展开剂的主要试剂。
取川续断皂苷VI对照品溶液,在波长 200~400 nm 范围内进行紫外光谱扫描,并记录光谱图。结果显示其在近紫外端下具有较强吸收,参照2020年版《中国药典》一部[1]“续断含量”项下,故本研究选用 212 nm 作为检测波长。
依据相关文献方法[1,11-13],本实验比较了乙腈-水(30∶70)、甲醇-0.1%盐酸溶液(68∶32)、乙腈-0.05%甲酸溶液(30∶70)、乙腈-0.1%磷酸溶液(30∶70)四种流动相,结果以乙腈-水(30∶70)为流动相,基线平稳,色谱峰峰形对称,操作简便。
本实验对提取溶剂(50%甲醇、70%甲醇、甲醇、乙醇)、超声时间(20、30、40 min)、回流(30、40、60 min)等进行研究,在考察了分离度、色谱峰形以及过滤速度后,最终确定了甲醇超声20 min作为供试品溶液的制备方法。
本实验所建立的续断薄层鉴别方法及川续断皂苷VI的含量测定方法,方法简便,专属性强,耐用性好,能够为续断的质量控制和进一步开发利用提供实验依据。
