不同蛋白水平日粮对小尾寒羊羔羊瘤胃真菌群落多样性与结构的影响
2021-12-23李海琴贾建磊侯生珍
李海琴 ,贾建磊*,侯生珍 ,魏 涛
(1.青海大学 农牧学院,青海 西宁 810016;2.山东省烟台市蓬莱市畜牧兽医站,山东 蓬莱 265699)
反刍动物的瘤胃内栖居着大量的微生物(包括细菌、原虫和真菌)[1],当饲料蛋白质进入瘤胃后,微生物在降解饲料蛋白质的同时,在饲料发酵过程中产生的挥发性脂肪酸(VFA)、能量(ATP) 和部分寡肽、氨基酸和氨以及内源性的氨能合成微生物蛋白,这些微生物蛋白连同饲料非降解蛋白(包括瘤胃中完整蛋白和部分小肽)随食糜流动进入真胃和小肠,被动物分泌的消化酶分解成小肽或游离氨基酸,供动物机体利用[2]。
羔羊瘤胃的发育处于一个动态变化的过程,瘤胃微生物菌群的变化受到羔羊日龄、饲料种类、营养水平、饲养管理等多种因素的影响[3]。在羔羊初生时,羔羊不具备反刍功能,瘤胃内微生物会由母羊产道、哺乳或者外界环境等进入羔羊瘤胃内,此后羔羊的饮食结构由母乳逐渐过渡到固体饲料,瘤胃内微生物组成会随之改变,微生物的功能也可能发生改变[4]。有研究表明,随日粮蛋白(CP)水平的升高试验动物瘤胃液中有关纤维分解的产琥珀酸丝状杆菌、白色瘤胃球菌数量显著升高[5];瘤胃液氨态氮的浓度则能够反映日粮粗蛋白在瘤胃中的降解情况及微生物蛋白的合成情况,粗蛋白的含量变化会影响提供给反刍动物氮源的多少,进而影响瘤胃微生物的组成以及数量的多少[6]。
早期断奶羔羊的饲养管理,是规模化养殖场提高生产效益的关键。本试验选择 50日龄断奶的小尾 寒羊双胎羔羊,饲喂不同蛋白水平的日粮,通过研究蛋白水平对瘤胃真菌结构和多样性的影响,为羔羊的规模化管理提供基础数据,为提高羔羊生产效率奠定理论基础。
1 材料与方法
1.1 试验设计选择初始体质量(3.17±0.52) kg、体况、胎次相近的青海省海东地区小尾寒羊双胎羔羊 120 只,采用单因素试验设计,于 50 日龄断奶,随机分为 3 组(Ⅰ、Ⅱ、Ⅲ),每组 40 只;Ⅰ、Ⅱ、Ⅲ 3组能量水平相同均为 12.00 MJ/kg[7],蛋白水平依次为 12%,14%,16%,日粮配方见表 1。

表1 羔羊日粮组成和及营养水平(干物质基础) %
1.2 饲养管理所有试验动物从出生后 7 日龄开始饲喂开食料,饲料(精饲料)营养水平同 14%蛋白水平组。所有羔羊于 50 日龄断奶后分别饲喂蛋白水平为 12%,14%,16%的日粮。本试验通过调整精饲料中原料比例来调整蛋白水平,所有羔羊每日饲喂量相同,每 5 d按比例增加饲喂量(精饲料∶青贮米玉∶燕麦干草=7∶2∶1,干物质计算),其中精料每次每只羔羊增加 15.13 g。3组羔羊 50~90 日 龄每日每只每次饲喂量见表 2;每日饲喂 2 次(8:00 和 17:00),自由饮水。羔羊进圈舍之前对圈舍进 行彻底消毒,此后,每日对羔羊圈舍进行清扫处理。对各组试验羔羊进行常规的免疫注射及内外寄生 虫防治。

表2 羔羊日粮饲喂量(干物质基础) g/d
1.3 样品采集及分析
1.3.1试验样品的采集 所有羔羊于 50 日龄断奶称体质量,羔羊饲养至 90 日龄后,每组随机选择 6 只羔羊,早上空腹称体质量后,颈动脉放血屠宰,解剖,取出瘤胃内容物用匀浆机混匀,取上层液体4层纱布过滤,将滤液装于 5 mL 冻存管中,液氮带回实验室-80℃冷冻保存,用于后期瘤胃细菌多样性的测定。
1.3.2样品分析方法 日粮配方中干物质(DM)、粗蛋白质(CP)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、钙(Ca)、磷(P)、粗脂肪(EE) 测定分别按照 GB/T 6435-2006、GB/T 6432-1994、GB/T 20806-2006、ISO13906-2008、GB/T6436-2002、GB/T 6437-2002、GB/T 6433-2006 的方法测定。
消化能计算公式为[8]DE(MJ/kg)=0.209×CP%+0.322×EE%+0.084×CF%+0.002×NFE%2+0.046×NFE%-0.627瘤胃真菌的测序工作外包给百迈克生物公司(北京,中国)。每组选择 6 只试验动物,提取 DNA后根据真菌 18S rDNA 基因的 ITS1 区域通用引物序列ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′,2043R(5′-GCTGCGTTCTTCATCGATGC-3′),在引物末端加上测序接头,进行 PCR 扩增并对其产物进行纯化、定量和均一化形成测序文库。建好的文库先进行文库质检,质检合格的文库用 Illumina HiSeq 2500进行测序。
1.4 数据分析根据UCLUST[9]的方法,对 Tags 在 97%的相似度水平下的优质序列进行操作分类单元(op-eration taxonomic units,OTUs)聚类分析,并过滤 OTUs(0.005% 作为阈值),筛选出OTUs 的代表性序列。将 OTU 的代表序列与微生物参考数据库进行比对可得到每个 OTU 对应的物种分类信息,进而在各水平统计各样品群落组成,利用QIIME软件生成不同分类水平上的物种丰度表[10],再利用 R 语言工具绘制 OTU-Venn 图,同时对微生物群落进行 Unifrac 分析,判断不同样品在遗传学上距离的远近,比较样品间的差异。
试验数据通过 Excel 2013 进行初步整理,应用 SAS 9.0 软件进行单因素方差分析(One-way ANOVA),试验数据以均值和标准误表示,P<0.05 表示差异显著。
2 结果
2.1 蛋白水平对羔羊日增体质量的影响从图 1 中可知,在蛋白水平为 14%(Ⅱ组)90 d 体质量最高,但3组差异不显著,从图 2 中可知,蛋白水平对羔羊日增体质量影响显著,Ⅱ组羔羊日增体质量显著高于其他组(P<0.05),Ⅰ与Ⅱ组间差异不显著。

注:不同小写字母间表示差异显著(P<0.05)。下同图2 不同蛋白水平羔羊日增体质量

图1 不同蛋白水平羔羊 50 d 断奶体质量和90 d体质量
2.2 蛋白水平对瘤胃真菌 OTUs 的影响基于97%的物种相似性下所有样本中共有278个OUTs,其中有213个为3组共有OTUs,图3中Good'scoverage(覆盖率)大于0.99,本试验测序深度能够准确反映羔羊瘤胃细菌的组成;3组羔羊中Ⅱ组瘤胃微生物(细菌)丰富性和多样性优于其他蛋白水平组。利用UniFracPCA对饲喂不同蛋白水平日粮的羔羊瘤胃中细菌群落差异进行研究,PCA运用方差分解,将多组数据的差异反映在二维坐标图上,两个样品间的距离越接近,则样品的组成相越似性。从图4可知,饲喂不同蛋白水平羔羊瘤胃液样品中细菌群落结构差异明显,彼此间可以很好地分隔开,采食相同日粮的样品可以很好地聚在一起,菌群相似度很高。

图3 不同蛋白水平羔羊瘤胃液真菌 Venn 图
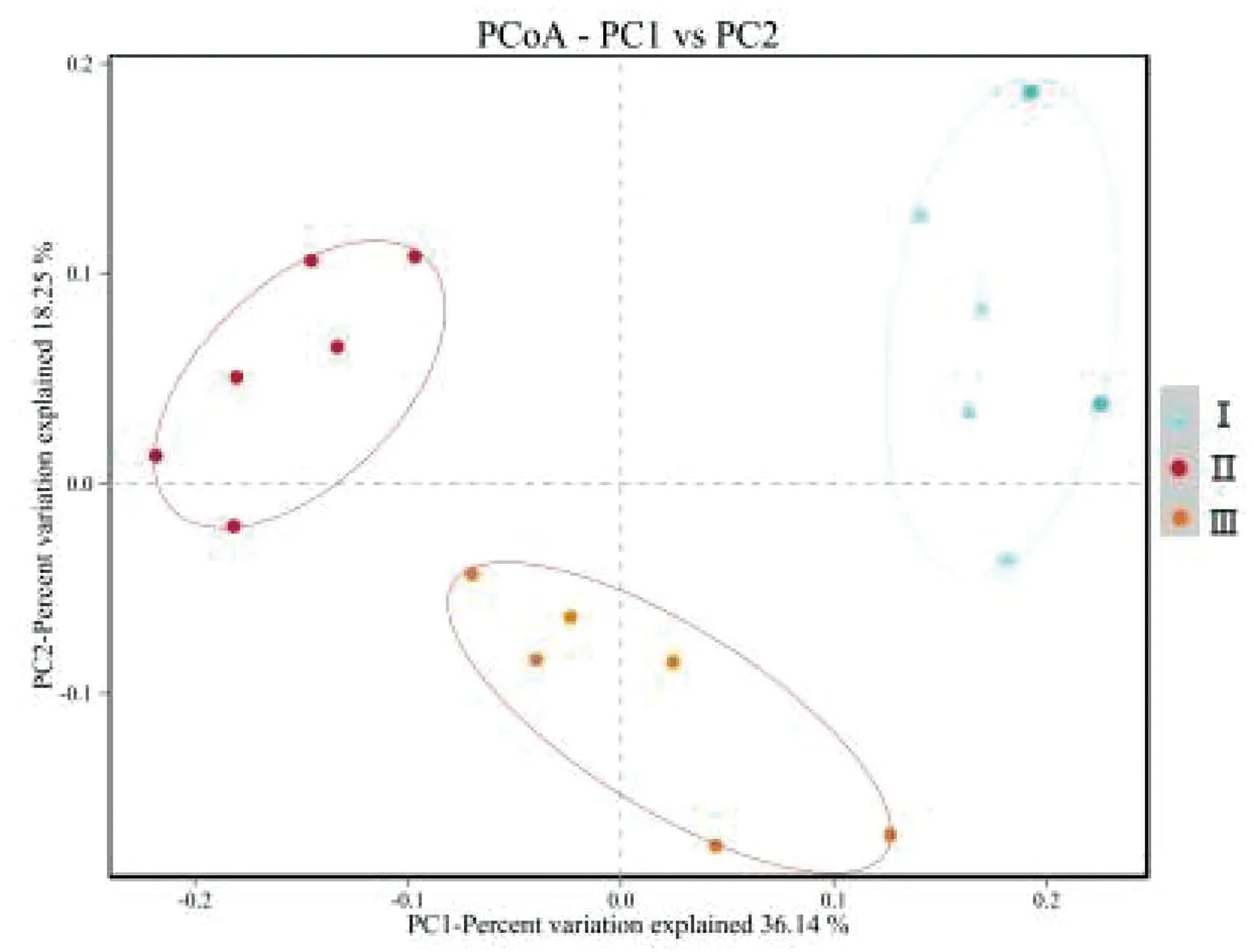
图4 Unifrac加权主坐标分析图
2.3 Alpha 多样性分析Alpha多样性(Alpha diversity)反映的是单个样品物种丰度多样性;Chao1 和Ace 指数衡量物种丰度即物种数量的多少,Shannon 和 Simpson 指数用于衡量物种多样性,Shannon 指数值越大,Simpson 指数值越小,说明样品的物种多样性越高。从表 4 中可知,不同蛋白水平对瘤胃菌群的丰富度的影响差异不显著(P>0.05),多样性指数中,Ⅱ、Ⅲ组 Shannon 指数显著高于Ⅰ组(P<0.05),Simpson指数Ⅱ、Ⅲ组显著低于Ⅰ组(P<0.05),Ⅱ、Ⅲ组间Shannon和Simpson指数差异均不显著(P>0.05)。
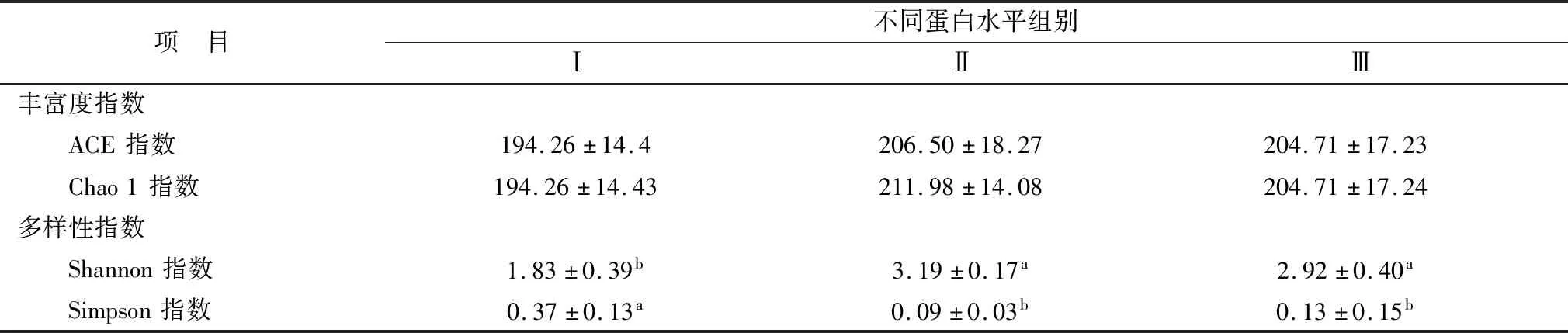
表4 样品多样性指数
2.4 瘤胃真菌菌群结构差异变化分析
2.4.1门水平 从表5中可知,羔羊瘤胃液在门水平共检测出 5个菌门,其中子囊菌门(Ascomycota)是3组羔羊瘤胃液优势菌门。Ⅰ组 Ascomycota 丰度显著高于其他2组(P<0.05); 担子菌门(Basidiomycota) Ⅱ、 Ⅲ 组丰度显著高于Ⅰ组 (P<0.05 );新丽鞭毛菌门(Neocallimastigomycota)、毛霉门(Mucoromycota)、丝足虫门(Cercozoa),3组间差异不显著(P>0.05)。

表5 瘤胃真菌菌群在门水平物种丰度表 %
2.4.2属水平 3组羔羊属水平丰度前 10 的真菌见表 6,由表知青霉属(Penicillium)为本试验优势菌,PenicilliumⅠ、Ⅱ组丰度显著高于Ⅲ组(P<0.05),Ⅰ、Ⅱ组间差异不显著(P>0.05);德巴利酵母属(Debaryomyces)Ⅰ组丰度显著高于其他2组(P<0.05),Ⅱ、Ⅲ组间差异不显著(P>0.05);帚枝霉属(Sarocladium)、曲霉属(Aspergillus)Ⅱ、Ⅲ组丰度显著高于Ⅰ组(P<0.05),Ⅱ、Ⅲ组间差异不显著(P>0.05);麦角菌属(Claviceps)Ⅲ组丰度显著高于Ⅰ、Ⅱ组(P<0.05),Ⅰ、Ⅱ组间差异不显著;节担菌属(Wallemia)Ⅱ组丰度显著高于Ⅰ、Ⅲ组(P<0.05),Ⅰ、Ⅲ组间差异不显著(P>0.05)。

表6 瘤胃真菌菌群在属水平物种丰度表
3 讨论
3.1 日粮蛋白水平对羔羊瘤胃真菌多样性的影响早期断奶羔羊瘤胃的发育还不完善,断奶后的羔羊所需营养物质全部由日粮提供,营养物质的调节对羔羊的生长发育起到了很大的作用[11]。日粮蛋白水平的不同造成的最直观结果是影响羔羊对营养物质的消化利用造成生长速度的不同[12]。本试验中Ⅱ组羔羊日增体质量显著高于Ⅰ组与Ⅲ组差异不显著。羔羊瘤胃内微生物的数量的变化受多种因素的影响,其中日粮变化是最重要的因素之一,且日粮蛋白质水平的影响大于能量水平[13]。本试验3组羔羊瘤胃液真菌,在基于 97%的物种相似性下所有样本中共有 278 个 OTUs,3组共有 OTUs 213 个,Ⅱ、Ⅲ 组特有OTUs 高于Ⅰ组。Alpha 多样性分析结果中,蛋白水平的不同对羔羊瘤胃真菌丰富度影响不显著;多样性指数中Ⅱ、Ⅲ组Shannon指数显著高于Ⅰ组。Simpson指数Ⅱ、Ⅲ组显著低于Ⅰ组.Shannon指数值越大,Simpson 指数值越小,样品的物种多样性越高,Ⅰ组(蛋白水平为 12%)微生物的多样性较小。郭凯等[14]在不同蛋白水平对犊牛瘤胃微生物多样性的研究结果中表明,高蛋白水平组的多样性指数要优于低蛋白水平。在本试验中日粮蛋白水平的不同影响了羔羊瘤胃微生物的结构变化,Ⅱ组、Ⅲ组,瘤胃内真菌的多样性显著高于Ⅰ组,Ⅱ、Ⅲ组间差异不显著。
3.2 日粮蛋白水平对羔羊瘤胃菌群结构的影响对瘤胃菌群结构的分析发现,在门水平下3组羔羊瘤胃液共检测出5个菌门。Ascomycota是3组羔羊优势菌,丰度均在 70%以上,而Ⅰ组 Ascomycota丰度达到 96%,显著高于其他2组,Ⅰ组菌群几乎集中在Ascomycota下。其余菌门中 BasidiomycotaⅡ、Ⅲ组丰度达到 4%以上显著高于Ⅰ组,Ⅰ组丰度为 1.28%;Neocallimastigomycota、Mucoromycota、 Cercozoa,3组间差异不显著且丰度均低于1%。在属水平下丰度前10的真菌中Penicillium是3组优势菌,3组丰度均达到15%以上。Ⅰ组属水平下的菌群多集中在隶属于Ascomycota的Penicillium、Debaryomyces,其丰度分别达到了 20%和 50%以上,显著高于Ⅲ组,Penicillium丰度Ⅰ组与Ⅱ组差异不显著。Ⅱ、Ⅲ组菌群除在优势属Penicillium的丰度达到 15%以上外,在其余属上Sarocladium、AspergillusⅡ、Ⅲ组丰度显著高于Ⅰ组,Ⅱ、Ⅲ组间差异不显著;ClavicepsⅢ组丰度最高,WallemiaⅡ组丰度最高,Ⅰ组瘤胃真菌多集中在同一菌门下的2个属水平中,多样性显著低于Ⅱ组和Ⅲ组。日粮营养水平的不同,对瘤胃中微生物的组成造成影响。
不同的微生物对饲料的降解能力不同,长时间的饲喂不同营养水平日粮,使羔羊瘤胃菌群的数量和结构均发生改变[15-16]。在瘤胃中的 Ascomycota 是真菌界最大的一类微生物,主要参与营养循环中顽固有机物质的降解;Ascomycota 门中部分真菌也可通过分泌胞外酶将有机质分解为小分子物质后再将小分子吸收进胞内代谢,它们可以分泌降解纤维素和木质素的酶类[17]。隶属于子囊菌门的Penicillium是丝状真菌中最具代表性的菌属之一,丝状真菌对纤维素、半纤维素和木质素有很强的分解作用,能分泌胞外酶,其菌丝具有机械穿插作用,能降解难降解有机物如纤维素和木质素,促进生物化学作用[18]。3组羔羊在蛋白水平为 14%时Penicillium的丰度达到了 22.49%,在3组中最高;帚枝霉 属能水解纤维素和木聚糖[19],Aspergillus真菌是一类分布广泛的丝状真菌,可降解纤维素、半纤维素和 木质素[20-21],这2种真菌在Ⅱ、Ⅲ组羔羊瘤胃中的丰度均显著高于Ⅰ组。在Ⅱ组和Ⅲ组,即蛋白水平为 14%和 16%的日粮饲喂下,羔羊瘤胃内各纤维消化菌的种类分布较为均匀。
真菌在瘤胃中主要在植物纤维的降解过程中起主要作用,本试验中通过提供不同的蛋白水平饲料,发现Ⅰ组瘤胃真菌的多样性显著低于Ⅱ、Ⅲ组。不同的纤维降解菌,在降解过程中执行着不同的功能,日粮饲料的配置会选用不同的纤维性饲料,这些饲料的物理结构上也不尽相同。因此,瘤胃内微生物种类的多样性,是提高瘤胃对纤维性饲料降解能力的重要因素[22]。有研究结果表明[23],在日粮蛋白(11%,12%,13%)水平增加至 13%时显著提高了 DM 和 NDF 的表观消化率;崔晓鹏等[24]对藏羔羊的研究发现蛋白质水平影响早期断奶藏羔羊的生长发育,在3种蛋白水平中(10.8%,12.0%,13.2%)12%蛋白水平可提高藏羔羊的日增体质量;LUDDEN等[25]给2月龄绵羊饲喂不同蛋白水平(13%,15%,17%)的日粮发现,随着蛋白水平的提高,NDF和ADF的消化率逐渐上升。从以上研究结果中可以发现,当蛋白水平过低时会降低羔羊的生长发育及消化代谢能力,适当提高蛋白水平能够更好地,为羔羊胃肠道的发育提供基础。本试验中蛋白水平增加至 14%和 16%时,羔羊瘤胃内真菌的菌群结构和多样性优于低蛋白水平组,能够为羔羊的生长发育提供良好的发育基础。
