头孢噻呋钠在肉牛组织中的残留消除
2021-12-23张东辉程富胜张继瑜周绪正
陈 晨,董 朕,张东辉,李 敏,李 冰,程富胜,张继瑜,周绪正
(中国农业科学院 兰州畜牧与兽药研究所 农业部兽用药物创制重点实验室/甘肃省新兽药工程重点实验室,甘肃 兰州 730050)
头孢菌素是目前常用于动物和人类的一种重要的抗菌剂,已经进化了四代,它们都有在青霉素内首次发现的β-内酰胺类结构[1]。头孢噻呋是第三代头孢菌素[2],是专门按照兽医用途开发的抗生素,与人类使用头孢菌素不同,头孢噻呋仅限于治疗细菌性感染,不能用于病毒和真菌感染[3]。头孢噻呋的杀菌机理是破坏细菌细胞壁的合成,靶向位于细菌细胞壁内部的青霉素结合蛋白(PBPs)[4]。头孢噻呋在全球范围内被批准用于猪、反刍动物和马的呼吸道疾病,还被批准用于牛的子宫炎和足腐病[5-8]。在临床应用中,头孢噻呋常以钠盐或盐酸盐的形式存在,即头孢噻呋钠和盐酸头孢噻呋。
兽药残留会对人体产生毒害作用,在体内蓄积导致人体中毒,因此,药物的合理使用以及休药期的制定就显得尤为重要[9-10]。我国头孢噻呋钠才刚刚被批准用于牛,该药有关牛的休药期尚未明确制定。因此,开展了头孢噻呋钠在肉牛中的残留消除试验,以便全面的了解该药在牛体内的残留情况,为制定相应的休药期,以便临床合理用药提供理论依据。
1 材料与方法
1.1 主要仪器高效液相色谱-串联质谱仪(LC-MS/MS),配电喷雾离子源,购自美国Agilent公司;美国Thermo公司通用台式离心机Heraeus Multifμge X3R;赛多利斯有限公司pH计和电子天平;美国 LABCONCO公司样品快速蒸发仪;昆山市超声仪器有限公司数控超声清洗器;美国Scilogex公司MXS可调式涡旋振荡仪;天津市富诚达科技有限公司固相萃取装置;上海优普实业有限公司优普超纯水制造系统;上海知楚仪器有限公司振荡培养箱。
1.2 主要试剂与材料乙腈、甲醇以及甲酸:质谱纯,购自赛默飞世尔科技(中国)有限公司;磷酸,色谱纯,购自天津市科密欧化学试剂有限公司;二甲基亚砜(DMSO)及碘乙酰胺,购自上海阿拉丁试剂有限公司;屈臣氏饮用水、二硫赤藓醇、十四水合硼酸钠、氯化钾、磷酸二氢钠、氢氧化钠和正己烷,购自国药集团化学试剂有限公司;针筒式微孔滤膜过滤器(孔径0.22 μm),购自天津市津腾实验设备有限公司;Waters Oasis HLB固相萃取柱(500 mg,6 mL);色谱柱:Poroshell 120 EC-C18(2.6×100 mm 2.7 Micron Agilent),购自美国Agilent公司。
1.3 溶液配制准确称取10 mg头孢噻呋标准品,加入4 mL DMSO溶解,用水定容至10 mL,配成1 g/L 的头孢噻呋储备液,用水稀释成不同浓度的标准工作溶液;取25 mL磷酸,加水溶解并稀释至100 mL,配成25%磷酸溶液;称取19 g十四水合硼酸钠和3.7 g氯化钾溶于900 mL水中,用水定容至1 L,配成0.05 mol/L硼酸缓冲液;称取1 g二硫赤藓糖醇,用0.05 mol/L硼酸缓冲液定容至250 mL,配成0.4% DTE提取液(现配现用);称取3.5 g磷酸二氢钠溶于900 mL水中,调节pH至7.0,用水定容至1 L配成0.025 mol/L磷酸缓冲液;称取14 g碘乙酰胺,用0.025 mol/L磷酸缓冲液定容至100 mL,配成14%的碘乙酰胺溶液;复溶液(0.1%甲酸水∶0.1%甲酸乙腈=80∶20)。
1.4 实验动物选取20头体况良好、年龄相近、体质量200 kg左右健康的地方杂交牛,雌雄各10头。按常规饲养,自由饮食饮水,饲养2周,临床表现健康,期间不使用任何抗菌药物。将20头肉牛随机分为5组,每组4头,雌雄各2头。
1.5 给药和样品采集由河北远征药业有限公司提供注射用头孢噻呋钠粉针剂,规格为1.0 g,用注射用水配制成10%的头孢噻呋钠溶液,试验肉牛按推荐剂量2.2 mg/kg颈部肌内注射给药,连续3 d,1次/d。分组如下:第1组(12 h组),第2组(3 d组),第3组(5 d组),第4组(7 d组),第5组(9 d组)。分别在最后1次给药后0.5,3,5,7,9 d宰牛。每头牛均采集背最长肌0.5 kg;注射部位肌肉:注射部位皮肤去毛后,以注射部位为中心,采10 cm×10 cm×6 cm(深)的肌肉样本;肝脏:取肝脏外缘纵切0.5 kg;肾脏:双肾各取一半;脂肪:取肾周脂肪0.5 kg。样品采集后立即装进自封袋并标记,保存于-20℃冰箱,待测。
1.6 样品前处理匀浆:用组织匀浆机匀浆背最长肌、注射部位肌肉、肝脏、肾脏以及脂肪,标记并分装,-20℃保存。
提取:已匀浆组织在室温条件下自然解冻,称取(1.00± 0.01) g 组织样品于50 mL离心管中,空白匀浆组织中加入标准工作溶液20 μL,采集的组织样品不需要这一步骤,加入11 mL的0.4% DTE提取液,涡旋2 min混匀,55℃水浴振荡15 min,放置室温。
衍生:用锡纸将离心管包住,避光加3 mL 14%的碘乙酰胺溶液,涡旋混匀2 min,黑暗衍生30 min,用25%磷酸溶液调节pH至2.3左右,背最长肌、注射部位肌肉、脂肪加入1 mL正己烷,肝脏和肾脏加入1 mL乙腈,4 500 r/min,4℃离心20 min,吸取上清液转移至另一离心管中,待用。
净化:用10 mL甲醇、10 mL水活化HLB SPE柱,将上清液过柱,然后用5 mL水淋洗,90%的甲醇水洗脱,15 mL的离心管接洗脱液,再用样品快速蒸发仪将洗脱液吹干,0.5 mL复溶液复溶残余物,超声10 min,将其过0.22 μm的滤膜打入液相小瓶中,10 μL进样检测。
1.7 色谱和质谱条件
1.7.1色谱条件 色谱柱:Poroshell 120 EC-C18(2.6×100 mm 2.7 Micron Agilent);流动相:A液是0.1%甲酸乙腈,B液是0.1%甲酸水;流速:0.4 mL/min;柱温:30℃;进样量:10 μL。流动相梯度洗脱条件:0~0.5 min,80% B~80% B;0.5~1.5 min,80% B~20% B;1.5~5 min,20% B~20% B;5~6 min,20% B~80% B;6~7 min,80% B~80% B。
1.7.2质谱条件 离子源为电喷雾离子源,扫描方式为正离子扫描,质谱扫描模式采用多反应监测。定性离子对(m/z):487>210;定量离子对(m/z):487>241;离子源温度:100℃;脱溶剂温度:350℃;毛细管电压:4 000 V;脱溶剂气流速:11 L/min;锥孔电压:110 V;碰撞能量:15 eV。
1.8 标准曲线准确称取空白匀浆组织样品(1.00±0.01) g,添加20 μL头孢噻呋标准工作溶液,使肌肉组织、注射部位肌肉、脂肪和肝头孢噻呋浓度为100,200,500,1 000,2 000,5 000 μg/kg,使肾组织中头孢噻呋浓度为100,200,500,1 000,2 000,4 000,6 000,12 000 μg/kg。按照1.6方法进行样品前处理,按照1.7方法进行样品检测。以药物浓度为横坐标,峰面积为纵坐标,制作标准曲线,计算回归方程以及相关系数(R2)。
1.9 检测限和定量限将已知浓度的头孢噻呋标准工作溶液加入空白组织样品中,依次降低浓度,按照1.6的方法处理样品,LC-MS/MS检测。以信噪比S/N≥3时样品最低浓度作为检测限,以信噪比S/N≥10时样品最低浓度作为定量限。
1.10 准确度和精密度以回收率评价准确度,以变异系数评价精密度。空白组织样品加入标准工作溶液,分别选取各组织的LOQ、1/2MRL、MRL、2MRL浓度添加,按照1.6所示前处理,并进行检测,最终计算回收率和变异系数,各组织LOQ、1/2MRL、MRL、2MRL具体浓度如表1所示[11]。

表1 各组织LOQ、1/2MRL、MRL、2MRL浓度 μg/kg
1.11 数据处理使用安捷伦液质联用仪自带的分析软件(Quantitative Analysis)进行数据分析,采用WT 1.4软件计算各组织休药期。
2 结果
2.1 检测方法的有效性在本研究建立的方法条件下,待测药物与组织中其他物质分离度高,相互之间无干扰;空白肌肉、空白肌肉加标,肌肉样品的色谱图如图1~3所示。各组织方法的检测限是25 μg/kg,背最长肌、注射部位肌肉、脂肪、肾的定量限是100 μg/kg,肝的定量限是500 μg/kg。各组织在其线性范围内,线性关系良好,相关系数大于0.99。各组织的添加回收率和变异系数如表2所示。从表2可以得出,该方法特异性好,灵敏度高,符合兽药残留检测的要求。

表2 各组织添加回收率和变异系数
图1 空白肌肉组织离子色谱图
2.2 头孢噻呋钠在牛组织中的残留消除按照2.2 mg/kg 连续3 d肌内注射头孢噻呋钠后,于0.5,3,5,7,9 d采集各组织样品进行前处理,并进行LC-MS/MS检测。检测结果如表3所示,从中可以看出,头孢噻呋钠在牛体内消除迅速,0.5 d时采集的各组织样品中头孢噻呋钠残留浓度较高,注射部位肌肉和脂肪的浓度较接近最大残留限量(MRL),但所有组织均低于规定的最大残留限量(MRL)。0.5 d 时肾组织中残留浓度最高为3 772.02 μg/kg。所有组织在9 d时头孢噻呋钠的浓度均低于检测限(LOD=25 μg/kg)。

图2 空白肌肉组织加标(500 μg/kg)特征离子色谱图

图3 肌肉组织样品特征离子色谱图

表3 不同时间点头孢噻呋残留量(n=4) μg/kg
2.3 头孢噻呋钠在牛体内的休药期参照EMEA规定的头孢噻呋钠在各组织的MRL[12],肌肉(背最长肌和注射位点)的MRL是1 000 μg/kg,肝的MRL是2 000 μg/kg,肾的MRL是6 000 μg/kg,脂肪的MRL是2 000 μg/kg。运用计算机软件WT 1.4计算头孢噻呋钠在各组织的休药期(95%的置信区间)[13](图4~8,表4)。

表4 头孢噻呋钠在牛组织中的休药期 h

图4 头孢噻呋钠在背最长肌组织中的消除规律
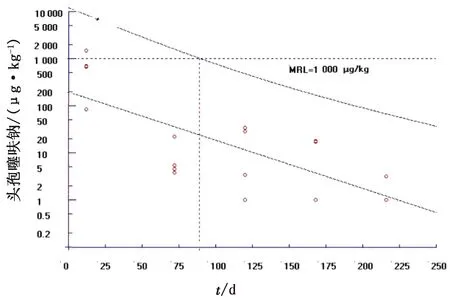
图5 头孢噻呋钠在注射部位肌肉组织中的消除规律
3 讨论
3.1 样品前处理以及色谱条件优化头孢噻呋钠进入动物体内,很快被代谢为去呋喃甲酰基头孢噻呋(DFC)以及其他二级代谢产物,将DFC作为头孢噻呋的残留标识物,但在试验过程中,由于DFC不稳定,常需要用碘乙酰胺衍生化为乙酰胺去甲基头孢噻呋(DCA)进行检测[14]。有人在固相萃取柱上进行衍生化,有人在过柱前进行衍生化[15],本研究通过在其基础上进行改进,选择过柱前衍生化,衍生化完成后,调节pH到2.3,确保其充分衍生化。有报道称采用MCX固相萃取小柱净化及高效液相色谱(HPLC)检测[16]。农业农村部目前最新的国家标准依次采用HLB、SAX、SCX 3根固相萃取柱净化,采用HPLC检测[15]。本研究在他人研究的基础上进行了优化,使用HLB固相萃取小柱进行净化,采用液相色谱串联质谱(LC-MS/MS)检测。本研究采用的方法操作简单,灵敏度高,一个样品检测只需要7 min,可用于大批量样品的检测,效率高。

图6 头孢噻呋钠在肝脏组织中的消除规律

图7 头孢噻呋钠在肾脏组织中的消除规律
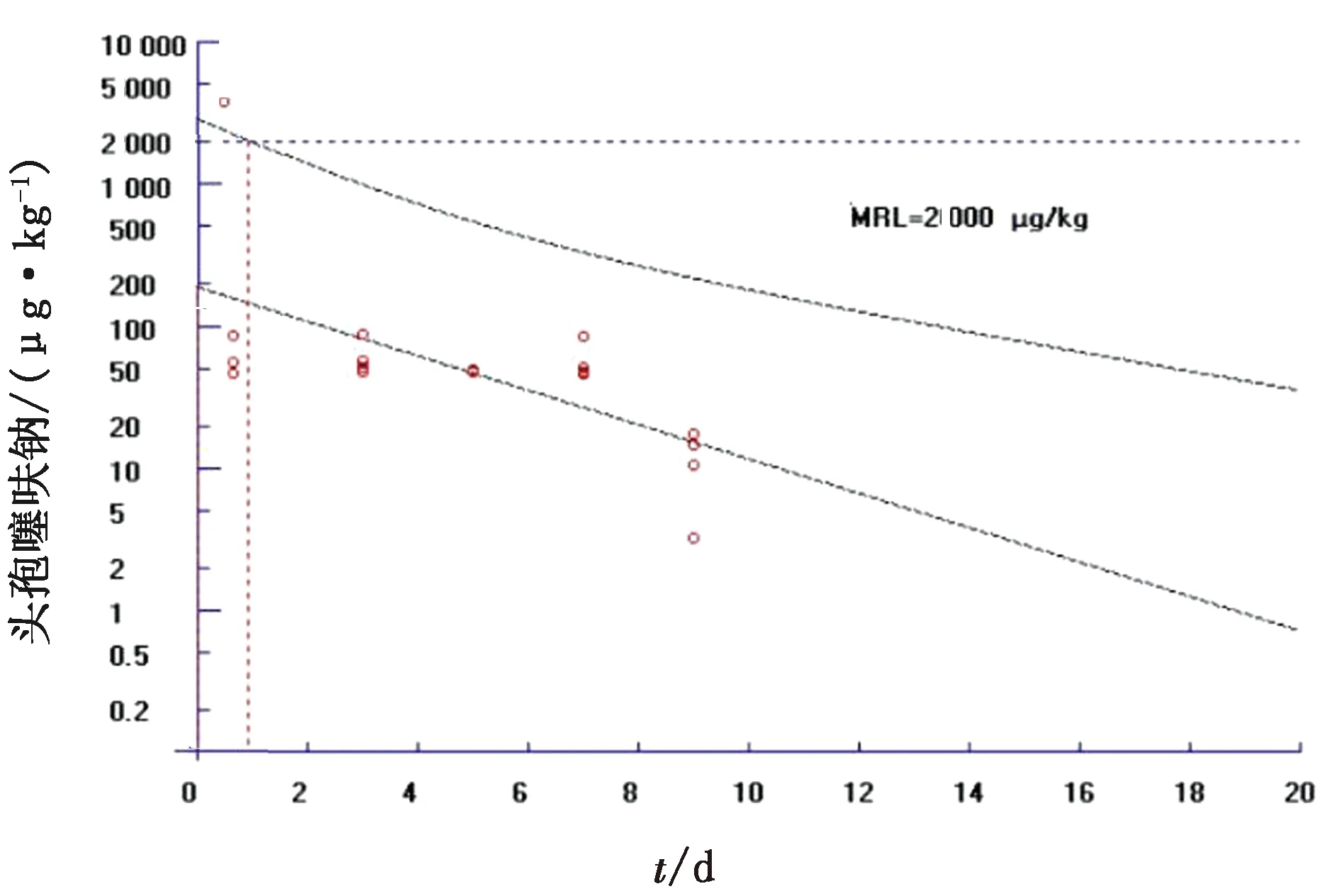
图8 头孢噻呋钠在脂肪组织中的消除规律
3.2 头孢噻呋钠在牛体内的消除试验牛按2.2 mg/kg 颈部肌内注射给药,连续给药3 d,在最后1次给药后0.5 d,各组织药物浓度达到最高。其中,肾组织中药物浓度最高,达到3 772.02 μg/kg,0.5 d 注射部位以及脂肪的药物浓度接近规定的MRL,但均低于肾组织的药物浓度,说明头孢噻呋在牛体内吸收迅速。且背最长肌、注射部位、肝、肾以及脂肪在0.5 d时浓度均低于规定的MRL,说明头孢噻呋在牛体内消除迅速。
3.3 头孢噻呋钠的休药期参照EMEA制定的头孢噻呋在牛组织中的MRL[14],本研究采用计算机软件WT1.4处理药物浓度与时间数据(95%置信区间),测得各组织的休药期分别为背最长肌0 h、注射部位92.01 h、肝31.77 h、肾68.13 h、脂肪25.74 h,根据WT1.4软件计算的休药期并联合临床应用,建议休药期定为4 d。
综上所述,试验牛按照按2.2 mg/kg颈部肌肉注射给药,连续给药3 d,建议将注射用头孢噻呋钠用于牛的休药期定为4 d。
