可诱导表达结核分枝杆菌ESAT-6的THP-1细胞系的建立
2021-12-23唐亦然戴鑫钧胡燕萍毕斯琪孟祥苗宋厚辉
唐亦然,戴鑫钧,胡燕萍,毕斯琪,孟祥苗,杨 杨,宋厚辉
(浙江农林大学 动物科技学院/动物医学院 浙江省畜禽绿色生态健康养殖应用技术研究重点实验室/动物健康互联网检测技术浙江省工程实验室,浙江 杭州 311300)
尽管结核分枝杆菌(Mycobacteriumtuberculosis,MTB)早在100多年前就被发现,但其所造成的结核病仍持续流行,成为了全球性公共卫生问题,对人类的健康造成严重危害[1]。6 kDa早期分泌抗原靶标(6-kDa early secretory antigenic target,ESAT-6) 是MTB独有分泌系统ESX-1分泌的小分子蛋白,该基因位于MTB RD-1区的开放阅读框的Rv3875处[2-3]。RD-1区仅存在于致病性分枝杆菌中,包括MTB、牛分枝杆菌、非洲分枝杆菌等,而不存在于所有减毒BCG疫苗株中,其与毒力密切相关[4]。作为MTB重要的毒力因子,ESAT-6参与MTB的致病过程,包括促进MTB在宿主细胞内复制与细胞间的扩散、诱导细胞凋亡发生、成孔和裂解膜、引起Ⅰ型IFN释放等[5]。ESAT-6可以增加细胞内Ca2+的浓度,促进活性氧(ROS)的产生,从而触发内质网的激活,调控内质网介导的下游信号通路eIF2a/ATF4/CHOP引起细胞凋亡的发生[6-7]。另外,ESAT-6具有成孔功能,可以导致细胞中吞噬溶酶体的破裂,从而使MTB从吞噬体向细胞质转运,从而激活一系列的胞内反应[8-9]。
本试验首次采用Tet-On 3G诱导表达系统中的反应质粒pLVX-TRE3G和调控质粒pLVX-Tet3G,将ESAT-6基因和红色荧光蛋白mCherry融合插入到pLVX-TRE3G中,与调控质粒pLVX-Tet3G分别包装成慢病毒后感染THP-1细胞,在Puromycin和G418双重压力下筛选可经Dox诱导表达ESAT-6的细胞系,并分析不同浓度的Dox和不同诱导的时间对THP-1中ESAT-6表达的影响以及诱导表达蛋白ESAT-6的生物活性功能,为深入研究ESAT-6在MTB感染中的作用机制奠定了基础。
1 材料与方法
1.1 材料大肠杆菌DH5α由本实验室保存。质粒pLVX-TRE3G、pLVX-Tet3G、pMD2.0G和psPAX2购自长沙优宝生物科技有限公司。真核表达质粒pmCherry-ESAT-6为本试验自行构建,在质粒pmCheryy-N1的基础上插入了MTBESAT-6基因片段。限制性内切酶SmaⅠ和EcoRⅠ购自NEB公司;DL2000 DNA Marker、DNA连接酶购自TaKaRa公司;DNA聚合酶2×Phanta Max Master Mix购自南京诺维赞生物科技有限公司;转染试剂Lipofectamine 2000购自Invitrogen公司;强力霉素(Doxycycline,Dox)、嘌呤霉素(Puromycin)、G418购自Sigma-Aldrich公司;南美胎牛血清(FBS)和细胞培养基(DMEM、1640)购自Gibco公司;HRP标记的山羊抗鼠 IgG、山羊抗兔 IgG以及Human IL-1β ELISA试剂盒购自上海优宁维公司;mCherry单克隆抗体购自Abcam公司;脂多糖LPS和尼日利亚菌素Nigericin;CellTiter-Glo Luminescent Cell Viability Assay试剂盒购自Promega。
1.2 细胞培养人肾上皮细胞HEK-293T用含有10%的胎牛血清的DMEM培养基培养,人单核细胞THP-1用含有10%的胎牛血清的1640培养基培养,均置于含有5% CO2的37℃培养箱中。
1.3 mCherry-ESAT-6融合基因的扩增以实验室构建的质粒pmCherry-ESAT-6为模板,设计特异性引物(序列如表1所示)用来PCR扩增ESAT-6和荧光标签mCherry的融合片段。反应体系如下:DNA模板1 μL,2×Phanta Max Master Mix 25 μL,上下游引物各1 μL,ddH2O补足至50 μL。设置PCR反应条件如下:预热94℃ 3 min,变性94℃ 30 s,退火60℃ 30 s,延伸68℃ 30 s,循环35次,延伸68℃ 7 min。经1%琼脂糖核酸电泳验证PCR产物。

表1 引物序列
1.4 重组质粒pTRE3G-mCherry-ESAT-6的构建使用限制性内切酶SmaⅠ和EcoRⅠ酶切质粒pLVX-TRE3G以及 ESAT-6基因的PCR产物,37℃孵育4 h。纯化回收酶切产物后,用DNA连接酶16℃连接2 h,转到大肠杆菌DH5α感受态细胞中,并涂布于含Kana抗性的LB平板上过夜培养。挑取单菌落,经菌落PCR筛选阳性克隆,扩大培养后提取质粒,将重组质粒送至浙江有康生物科技有限公司测序。将测序成功的重组质粒命名pTRE3G-mCherry-ESAT-6。
1.5 重组质粒诱导表达目的蛋白的初步验证将HEK293T细胞以5×105个/mL的细胞密度铺于12孔细胞培养板中,过夜培养。将质粒pTRE3G-mCherry-ESAT-6和pLVX-Tet3G按照质量比 4∶1混合,用Lipofectamine 2000转染试剂转染到细胞中,同时加入100 μg/L的 Dox。转染24 h后,通过荧光显微镜观察荧光表达情况。加入200 μL NP40裂解细胞,收取细胞总蛋白,用10%的分离胶进行SDS-PAGE后,105 V转膜40 min;5%的脱脂奶粉封闭1 h,TBST洗涤3次,5 min/次;用mCherry单克隆抗体(1∶1 000稀释)4℃孵育过夜后,TBST洗涤5次;用 HRP标记的山羊抗兔室温孵育1 h,TBST洗涤3次;用ECL发光底物进行显影曝光。
1.6 慢病毒包装将 HEK293T细胞以5×105个/mL的细胞密度铺于10 cm培养皿中,过夜培养12~16 h。将pTRE3G-mCherry-ESAT-6与慢病毒包装质粒psPAX2和pMD2.0G以2∶2∶1的比例混合后,用Lipofectamine 2000转染上述混合质粒到细胞中,转染3 d后收集含病毒的上清,并且用0.45 μm滤器过滤除菌,所获得病毒命名为LV-TRE3G-ESAT-6。用上述相同方法获取LV-Tet3G慢病毒上清,分装保存于-80℃。
1.7 可诱导表达目的蛋白的THP-1细胞系的筛选与鉴定将THP-1细胞以每孔5×105个/mL的细胞密度铺于6孔细胞培养板中,过夜培养。吸去原有培养基,加入含有病毒的培养基(1 mL培养基中含有6 mg/L的polybrene、50 μL LV-TRE3G-ESAT-6和50 μL LVX-Tet3G),300 r/min离心1 h后,再加入1 mL培养基(含有6 mg/L的polybrene)。感染第2天换掉含病毒的培养基,待感染72 h后,换含有1 mg/L Puromycin和800 mg/L G418的新鲜完全培养液,同时设置空白对照。每2~3 d更换1次含有抗生素的培养基,直到空白组细胞全部死亡。阳性细胞克隆扩大培养、传代、冻存,将所获得的细胞株命名为THP-1/ESAT-6。将THP-1/ESAT-6细胞铺于24孔细胞培养板中,添加100 μg/L的Dox诱导剂,培养24 h后,提取细胞的总蛋白,Western blot检测 ESAT-6表达情况。加入不同浓度的Dox培养24 h或者用100 μg/L的Dox培养不同时间后,Western blot检测 ESAT-6的表达与诱导剂浓度和作用时间的关系。
1.8 可诱导表达目的蛋白的THP-1细胞系稳定性检测为了检测不同代次细胞系的ESAT-6蛋白的表达稳定性,在将细胞传至第2,8,14和20代时分别铺于24孔细胞培养板中,添加100 μg/L的Dox,诱导表达24 h后进行Western blot检测 ESAT-6的表达。
1.9 可诱导表达目的蛋白的生物活性检测将筛选获得的细胞系THP-1/ESAT-6铺于96孔细胞培养板中, 加入100 μg/L的Dox分别处理6,9,12,18,24,36和48 h后,通过CellTiter-Glo Luminescent Cell Viability Assay试剂盒测定细胞的存活率。此外将THP-1/ESAT-6细胞铺于24孔细胞培养板中,添加100 μg/L的Dox诱导剂培养20 h后,加入脂多糖1 mg/L LPS刺激细胞3 h,10 μmol/L尼日利亚菌素Nigericin作用1 h后,收集细胞上清,通过ELISA试剂盒检测细胞上清中的IL-1β的分泌情况。

2 结果
2.1 ESAT-6基因的PCR扩增以实验室构建的真核表达质粒pmCherry-ESAT-6为模板,PCR扩增ESAT-6和mCherry融合片段,预期片段大小为1 107 bp。PCR扩增产物经过 1%的琼脂糖凝胶电泳检测,与预期片段大小基本一致(图1)。
2.2 pTRE3G-mCherry-ESAT-6 重组质粒的构建双酶切ESAT-6和mCherry融合片段后,使用DNA连接酶将其插入载体pLVX-TRE3G上,转入大肠杆菌DH5α中。挑选23个单菌落克隆,经菌落PCR验证获得5个阳性克隆(图2)。将阳性克隆扩增,提取质粒送往公司进行测序验证,结果表明出入的基因片段与已公布的基因序列完全相同,这说明重组质粒pTRE3G-mCherry-ESAT-6构建成功。

M.DL2000 DNA Marker;1.ESAT-6基因片段图1 mCherry-ESAT-6 基因的PCR扩增
2.3 重组质粒诱导表达ESAT-6的初步验证将质粒pTRE3G-mCherry-ESAT-6和pLVX-TRE3G分别与调控质粒pLVX-Tet3G按质量比4∶1共转染HEK293T细胞,并加入 100 μg/L的Dox诱导24 h后,荧光显微镜下观察荧光表达情况,并收集细胞蛋白进行 Western blot分析。结果表明,pTRE3G-mCherry-ESAT-6和 pLVX-Tet3G共转时,Dox可以诱导细胞发出红色荧光,并且Western blot可检测到ESAT-6的表达(图3),这说明重组质粒pTRE3G-mCherry-ESAT-6可用于后续的试验。
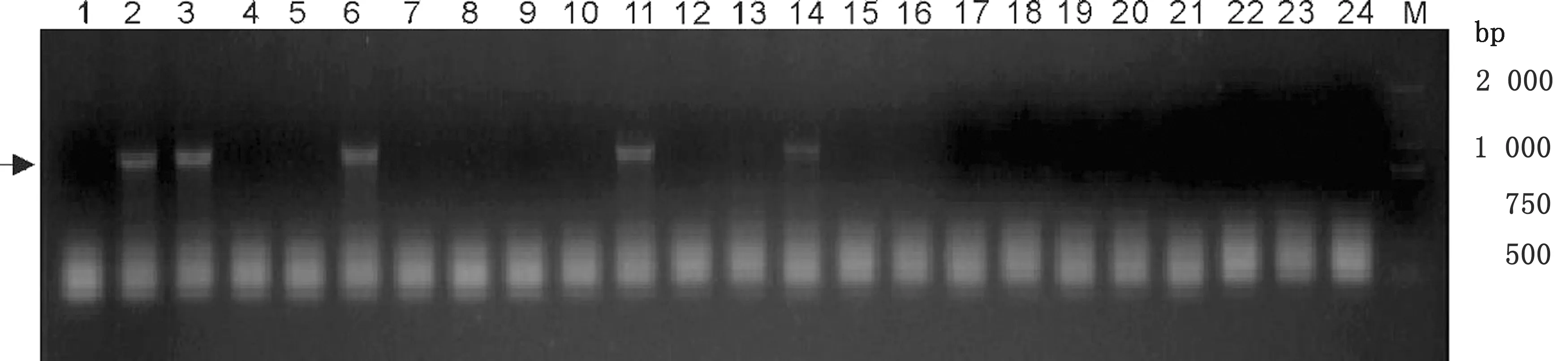
M.DL2000 DNA Marker;1.阴性对照;2~24.待验证的菌落图2 菌落PCR鉴定

A.荧光显微镜观察荧光表达情况;B.Western blot检测ESAT-6蛋白表达情况图3 重组质粒在HEK293T细胞中诱导表达ESAT-6
2.4 可诱导表达的 THP-1/ESAT-6细胞系稳定性筛选与鉴定用慢病毒LV-TRE3G-ESAT-6和LV-Tet3G按照一定的比例感染THP-1细胞,并用Puromycin和G418双重压力筛选获得稳定细胞THP-1/ESAT-6,对不同细胞代次用Dox进行诱导,提取细胞的总蛋白进行Western blot分析。结果表明,筛选获得的THP-1/ESAT-6细胞在 Dox的诱导下可检测到ESAT-6的表达,未诱导组未检测到ESAT-6表达(图4),这表明THP-1/ESAT-6细胞系构建成功,且能够稳定表达ESAT-6。

图4 不同细胞代次Dox诱导THP-1/ESAT-6细胞稳定表达ESAT-6
2.5 ESAT-6表达与Dox质量浓度和诱导时间的关系用不同质量浓度的 Dox(0,100,200,400,600和800 μg/L)处理THP-1/ESAT-6细胞,在诱导24 h 后收集细胞蛋白,采用Western blot方法检测 ESAT-6的表达。结果表明ESAT-6的表达随着Dox质量浓度的增加而增加,呈正相关性(图5)。用100 μg/L的Dox处理细胞,分别在0,6,9,12,18,24,36,48,60和72 h后检测 ESAT-6表达情况。结果表明Dox诱导9 h后可明显检测到ESAT-6,并且ESAT-6的表达具有时间依赖性(图6)。

A.Western blot检测不同质量浓度的Dox诱导ESAT-6表达情况;B.灰度分析图5 Dox质量浓度对THP-1/ESAT-6细胞中ESAT-6表达的影响
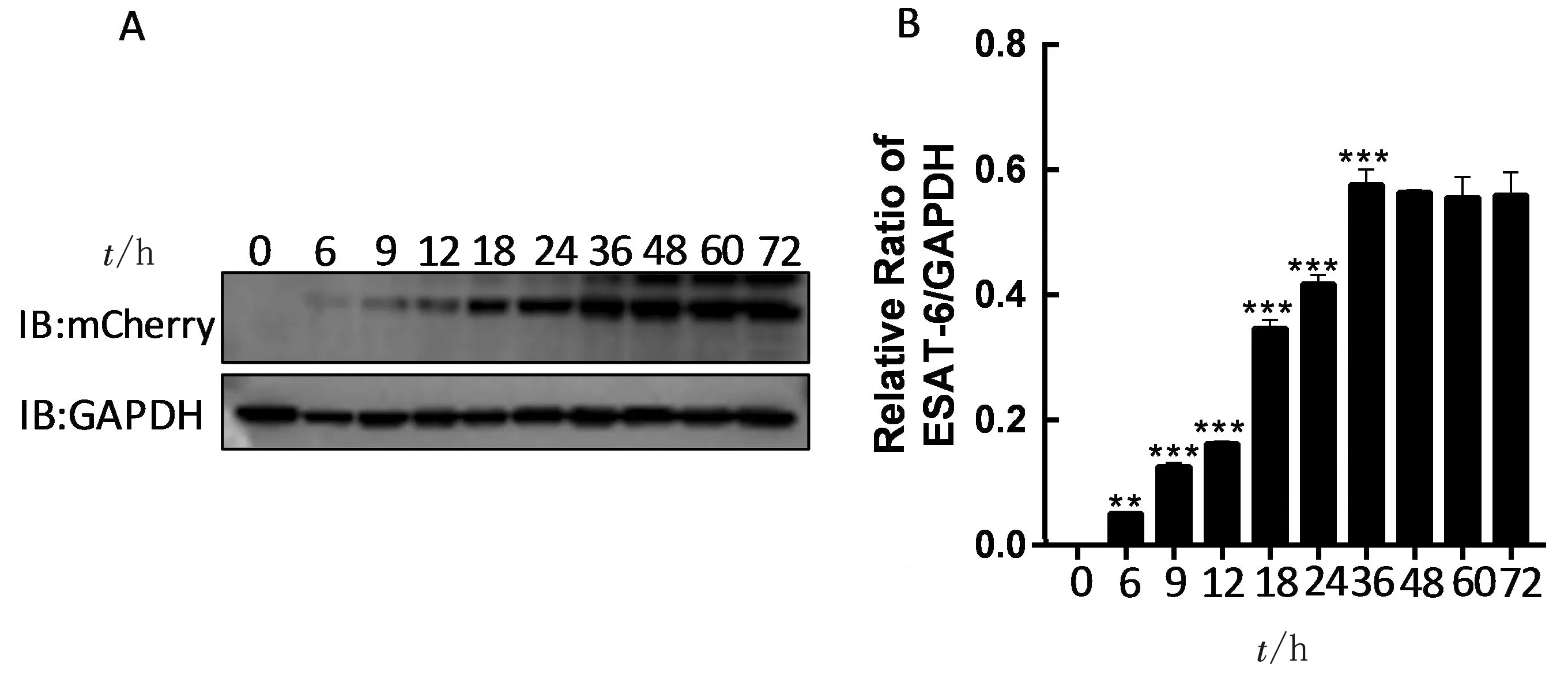
A.Western blot检测Dox不同诱导时间下ESAT-6表达情况;B.灰度分析图6 Dox诱导时间对THP-1/ESAT-6细胞中ESAT-6表达的影响
2.6 可诱导表达目的蛋白的生物活性检测有研究发现MTB ESAT-6能够引起NLRP3炎症小体的激活介导IL-1β的分泌从而促进细胞死亡[10]。为了验证诱导表达ESAT-6蛋白对细胞存活的影响,本试验用100 μg/L的Dox处理细胞,分别在0,6,9,12,18,24,36 和48 h后检测细胞的存活率。结果表明Dox诱导18 h后细胞的存活率显著下降(图7A),说明随着Dox诱导时间的增加ESAT-6的表达的增强可以促进细胞的死亡。此外,为了验证诱导表达ESAT-6蛋白对NLRP3激活剂Nigericin(Nig)所引起的IL-1β分泌的影响,使用100 μg/L的Dox诱导剂培养THP-1/ESAT-6细胞20 h后,再加入1 mg/L脂多糖LPS刺激细胞3 h,10 μmol/L尼日利亚菌素Nigericin作用1 h,通过ELISA检测细胞上清IL-1β的变化。结果表明ESAT-6能够促进由尼日利亚菌素Nigericin引起的IL-1β的分泌(图7B)。这些结果表明诱导表达蛋白ESAT-6具有促进IL-1β的分泌产生和细胞死亡的生物活性。
3 讨论
ESAT-6是MTB的免疫优势抗原和主要的毒力因子,参与调控宿主细胞的多种固有免疫反应。有研究表明MTB ESAT-6能够介导NLRP3炎症小体的激活,触发下游因子Caspase-1的活化,从而促进IL-1β的分泌和细胞焦亡的发生[10-11]。ESAT-6还能够触发I型干扰素的产生,这主要是通过激活STING-TBK1-IRF3信号转导轴特异性激活配体导致的[5]。目前,对ESAT-6功能的研究主要通过蛋白纯化表达和缺失菌株的构建来完成。通过大肠杆菌原核表达所获得的ESAT-6蛋白中往往含有大肠杆菌本身的菌体物质,如脂多糖(LPS),或者含有在纯化过程中添加的去污剂。然而,这些物质的存在有时会造成试验结果出现误差。多项研究报道发现ESAT-6以酸性pH依赖性方式诱导脂质泄露,具有膜溶解的功能[12-13]。但是,CONRA等[14]发现ESAT-6本身不具备溶解细胞膜的功能,之前的研究发现ESAT-6之所以能够溶剂细胞膜,完全归因于ESAT-6中残留的去污剂ASB-14。因此,本试验通过Tet-On 3G系统构建可诱导表达ESAT-6的细胞系,避免大肠杆菌菌体物质和去污剂等造成的影响。

A.ELISA检测Dox对LPS+Nig引起THP-1/ESAT-6细胞中IL-1β分泌的影响;B.Dox不同诱导时间对THP-1/ESAT-6细胞存活的影响图7 可诱导表达ESAT-6蛋白的生物活性鉴定
Tet-On 3G系统对Dox具有相当高的特异性和敏感度,且Tet毒性低,不影响细胞内的其他基因活性。并且,Tet-On 3G系统诱导基因表达的效果与Dox的浓度及诱导时间存在一定的关系,可以自由控制靶基因表达的时间和强度[15]。鉴于Tet-On 3G系统的上述特性,本试验中利用该系统构建了可诱导表达ESAT-6蛋白的THP-1细胞。当未加入Dox的条件下,THP-1细胞不表达ESAT-6;当加入Dox时,THP-1细胞可诱导表达ESAT-6,并且100 μg/L 的Dox诱导6 h即可观察到ESAT-6的表达,诱导9 h后ESAT-6表达量明显上升,在36 h达到最大值,此后表达量保持稳定。
THP-1分化的巨噬细胞是研究MTB的主要体外细胞模型。THP-1细胞是典型的悬浮细胞,其转染并瞬时表达外源蛋白相对比较困难。Lipofectamine 2000对THP-1毒性较大,转染效率极低,不适合THP-1细胞转染。腺病毒对THP-1细胞毒性较低,并且具有极高的转染效率,但腺病毒免疫原性较高,高MOI极大影响THP-1细胞免疫状态,有影响后续试验的风险。相比腺病毒来说,慢病毒同样对THP-1的毒性较低,但其转染效率有所降低[16]。不过,它具有较低的免疫原性,对细胞免疫状态的影响小。考虑3种转染方式的优缺点,本试验包装了LV-TRE3G-ESAT-6和LV-Tet3G这2种慢病毒用以感染THP-1细胞。
综上,本试验首次采用Tet-On 3G诱导表达系统成功构建了由Dox稳定诱导表达ESAT-6的THP-1细胞系,分析了不同诱导浓度和诱导时间对ESAT-6表达量的影响以及ESAT-6的生物活性,为探究ESAT-6功能提供了新的试验方法,也为深入探究ESAT-6参与MTB调控细胞通路的作用机制奠定了基础。
