维生素D缺乏和基因多态性与自身免疫性甲状腺疾病相关性研究进展
2021-12-22杨芸瑞甄东户
杨芸瑞,甄东户
(1.兰州大学第一临床医学院,兰州 730000; 2.兰州大学第一医院内分泌科,兰州 730000)
维生素D在本质上属于类固醇衍生物,其作为一种骨保护因子可以调节钙磷稳态及骨代谢[1]。具有生物活性功能的1,25-二羟维生素D3[1,25-dihydroxy vitamin D3,1,25-(OH)2D3]通过与维生素D受体(vitamin D receptor,VDR)结合,诱导靶基因表达,而VDR广泛存在于血管内皮细胞、免疫细胞、内分泌腺体等细胞器官中,其中免疫细胞也能合成与维生素D活化相关的1α-羟化酶,25-羟维生素D[25-hydroxy vitamin D,25-(OH)D]经羟化酶作用转化为具有生物活性的1,25-(OH)2D,通过自分泌或旁分泌方式发挥其生物学功能,证实维生素D作为一种免疫调节剂参与多种自身免疫性疾病的发生[2]。目前也有研究证实,维生素D缺乏与多种自身免疫性疾病的发生有关,包括类风湿关节炎、系统性红斑狼疮、多发性硬化和1型糖尿病等[3]。自身免疫性甲状腺疾病(autoimmune thyroid disease,AITD)是由于甲状腺自身抗原暴露、免疫耐受紊乱而导致产生针对甲状腺组织的自身抗体,通过抗原抗体反应及细胞免疫介导使甲状腺组织受到破坏,进而引起甲状腺功能紊乱的器官特异性自身免疫性疾病,其发病机制涉及环境、遗传等多种因素,临床常见的类型包括格雷夫斯病(Graves′ disease,GD)和桥本甲状腺炎(Hashimoto thyroiditis,HT),成人发病率约为5%,且更倾向于女性[4]。目前,有关维生素D缺乏与AITD的关系尚未阐明。研究表明,维生素D缺乏可以导致AITD患病风险明显升高,补充维生素D可以降低其发病率[5]。此外,VDR基因多态性可能通过基因调控改变VDR的结构与数量,进而影响VDR发挥生物学功能,表明VDR基因多态性与AITD遗传易感性相关,如GD和HT患者VDR基因多态性等位基因分布频率有显著差异,且在不同种族之间也存在差异[6]。现就维生素D缺乏和基因多态性与AITD的相关性研究进展予以综述。
1 维生素D的合成、代谢及作用
维生素D的主要来源有饮食和体内合成两个途径,如皮肤中的7-脱氢胆固醇经紫外线B作用会转化为维生素D3。维生素D3的主要循环形式是在肝脏内被细胞色素P450家族27亚家族R成员1羟基化,合成25-(OH)D[25-(OH)D2或25-(OH)D3],生物活性较低。在血液中,维生素D需与其结合蛋白(GC基因编码)结合而被转运至肾脏,在肾脏由细胞色素P450家族27亚家族B成员1转化为具有生物活性的代谢产物1,25-(OH)2D3[7-8]。1,25-(OH)2D3主要(85%~90%)与维生素D结合蛋白和白蛋白(10%~15%)结合运输,仅有极少量以游离形式存在的维生素D发挥重要生理作用[9]。研究表明,维生素D通过与VDR结合而产生生物学效应,VDR是一种胞核受体,属于类固醇/甲状腺核受体家族,维生素D结合蛋白和羟化酶对维生素D的活性有重要调控作用[8]。1,25-(OH)2D3与VDR结合后,与类视黄醇X受体发生聚合反应,并与靶基因启动子区维生素D反应元件结合,诱导或抑制靶基因的表达[10]。此外,维生素D还可通过与免疫细胞VDR结合,维持免疫细胞稳态平衡,从而参与自身免疫性疾病的发生发展。
2 AITD的发病机制
目前,关于AITD的发病机制尚未完全清楚。一般认为,环境因素和个体固有的基因遗传易感性在AITD的发生发展中起关键作用。如病毒、射线、药物和碘的摄入等外在环境因素通过干扰正常的甲状腺代谢,或对甲状腺细胞的直接破坏导致机体免疫调节机制紊乱,其中甲状腺组织内淋巴细胞浸润,浆细胞产生针对甲状腺组织的自身抗体是AITD的特征性表现,可以导致GD的甲状腺中毒症状以及HT的甲状腺功能减退,说明甲状腺微环境的改变和各种机制导致的机体免疫耐受降低与AITD的发病有密切联系,其中T/B淋巴细胞免疫平衡紊乱导致甲状腺组织细胞破坏起主要作用[11]。
2.1T/B淋巴细胞 T淋巴细胞的主要来源为胎儿肝脏和骨髓前体祖细胞,迁移至胸腺分化成熟。原始T细胞主要分化为CD8+和CD4+T细胞,CD4+T细胞在抗原刺激下分化为辅助性T细胞(helper T cell,Th细胞)和调节性T细胞(regulatory T cell,Treg细胞)等亚型[12]。其中,Th1细胞能够分泌肿瘤坏死因子-α、γ干扰素、白细胞介素(interleukin,IL)-2等细胞因子,参与细胞免疫应答,介导炎症和变态反应。Th2细胞主要分泌IL-5、IL-6、IL-10等细胞因子,促进B细胞的分化和抗体的生成,参与体液免疫应答过程[13]。Th1和Th2细胞分化方向受遗传、抗原、细胞因子、激素、环境污染等多种因素的影响[14]。正常机体针对不同抗原及病原体会选择相应的细胞免疫或体液免疫应答机制,两者保持动态平衡,AITD患者由于免疫耐受遭到破坏,Th1或Th2细胞免疫反应亢进,两者分泌不同细胞因子介导免疫反应,产生针对甲状腺细胞的自身抗体,甲状腺组织被破坏导致甲状腺功能紊乱。见图1。
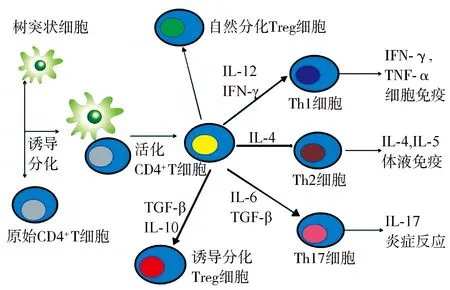
Treg细胞:调节性T细胞;IL:白细胞介素;IFN-γ:γ干扰素;TGF-β:转化生长因子-β;TNF-α:肿瘤坏死因子-α
2.2AITD与免疫调节 HT的特征性表现为甲状腺组织淋巴细胞弥漫性浸润、甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPO-Ab)和甲状腺球蛋白抗体(thyroglobulin antibody,TGAb)产生,其中Th1细胞介导的免疫反应在HT的发病机制中占主导地位[15]。Th细胞功能的增强能够诱导B细胞分化产生抗甲状腺细胞抗体,抗体沉积于甲状腺滤泡基膜,激活补体系统,从而引起细胞坏死。此外,活化的Th1细胞主要分泌IL-1β、IL-12、γ干扰素、肿瘤坏死因子-α等细胞因子,其中肿瘤坏死因子-α能够诱导IL-1、IL-6细胞因子分泌,两者与γ干扰素有协同作用,通过激活细胞毒性T细胞和巨噬细胞释放颗粒酶和穿孔蛋白,而γ干扰素能够促进甲状腺滤泡淋巴细胞浸润,引起甲状腺组织破坏,导致甲状腺功能低下[16-18]。有研究发现,Fas/Fas配体(Fas ligand,FasL)及B细胞淋巴瘤/白血病-2(B-cell lymphoma/leukemia-2,Bcl-2)细胞凋亡机制对AITD具有重要的调节作用,Fas/FasL是调控细胞凋亡相关基因表达的一对跨膜蛋白,而Bcl-2通过阻碍由Fas系统诱导的细胞凋亡途径,从而抑制细胞凋亡[19]。另有研究发现,AITD患者的甲状腺滤泡细胞及浸润淋巴细胞均高表达Fas和FasL,其中浸润淋巴细胞通过分泌细胞因子,诱导促凋亡蛋白Fas/FasL和抗凋亡分子Bcl-2表达失调,从而导致甲状腺细胞凋亡[20]。
Th2细胞通过分泌细胞因子激活B淋巴细胞产生对促甲状腺激素(thyroid stimulating hormone,TSH)受体高反应性的促甲状腺激素受体抗体(thy-rotropin receptor antibody,TRAb),是GD引起甲状腺功能亢进的主要发病机制。与HT相比,GD的发病机制主要表现为Th2细胞分泌的细胞因子(如IL-4、IL-5、IL-6)水平升高,从而进一步诱导B细胞分化成熟并合成TRAb,这一过程主要通过下调Fas/FasL或上调抗凋亡分子Bcl-2信号通路调节[21]。GD患者由于甲状腺组织浸润的Th2淋巴细胞分泌IL-4、IL-5等细胞因子,从而使Bcl-2抗凋亡分子表达增加,进而进一步阻止甲状腺细胞凋亡[20]。对于GD,Th1/Th2细胞因子分泌水平不是恒定的,因此GD患者甲状腺功能既可以表现为甲状腺功能亢进,也可以表现为甲状腺滤泡破坏导致甲状腺功能减退。
3 维生素D缺乏和VDR基因多态性与AITD的关系
3.1维生素D通过免疫调节机制对AITD的影响 人体免疫系统的主要细胞均表达VDR,包括树突状细胞(dendritic cell,DC)、单核细胞、T/B淋巴细胞等,其主要靶细胞为DC[22]。DC作为免疫反应初始阶段的启动因素,是最强大的抗原呈递细胞。1,25-(OH)2D3通过与胞内受体VDR结合调控基因表达,参与免疫调节过程,这也是维生素D参与AITD发病机制的细胞分子学基础。维生素D可以增强先天性免疫反应,同时也可抑制适应性免疫应答体系,这种机制使机体免疫耐受增加,从而减少自身免疫性疾病的发生。Treg细胞在建立及维持机体的免疫耐受、抑制自身免疫性疾病的发生中扮演重要角色,其能够调节免疫系统的正常运转。体外研究发现,维生素D通过增强Treg细胞的功能,促进Th2细胞分化成熟,而抑制Th1细胞激活[23]。一方面1,25-(OH)2D3通过抑制B细胞向浆细胞增殖、分化,导致针对甲状腺细胞的自身抗体分泌受抑,另一方面直接或间接地通过Th细胞途径促进浆细胞凋亡[24],阻止补体活化介导的甲状腺细胞死亡。外来抗原刺激DC活化,激活初级免疫应答反应,DC识别自身抗原并诱导T淋巴细胞产生免疫耐受,从而抑制可能损害宿主的自身免疫反应。1,25-(OH)2D3能够抑制与DC分化成熟相关的细胞因子(IL-12和IL-23)的分泌,促使T细胞向Th2细胞表型分化;同时,1,25-(OH)2D3也可以促进DC介导的Treg细胞分泌IL-10,进而抑制Th1细胞活性,阻止细胞介导的细胞毒性甲状腺组织破坏[25]。此外,1,25-(OH)2D3还可以通过阻止核因子κB的激活以及与核因子κB的共识序列结合,下调IL-8和IL-12细胞因子的分泌,导致DC的抗原呈递和激活免疫应答功能减弱,从而使甲状腺组织T细胞数量及活性下降[26-27]。见图2。综上可知,1,25-(OH)2D3通过多个途径抑制反应性T淋巴细胞对自身抗原的攻击,抑制异常免疫反应,减少促炎因子产生,调控细胞凋亡保护甲状腺组织免受破坏。维生素D作为一种免疫调节剂参与调控AITD发病的多个环节,表现为内分泌-免疫系统相互交织的网络结构,同时维生素D的合成分泌、运转、VDR结构等多个方面影响其功能,尤其是VDR基因多态性成为学术研究热点。
3.2VDR基因多态性与AITD的关系 维生素D与靶细胞VDR结合进而调控目的基因的表达,VDR功能异常可以影响维生素D的免疫调节和抗炎功能,与AITD的发病机制密切相关。VDR基因的遗传变异会导致受体功能异常,已有研究报道VDR基因多态性与AITD的遗传易感性显著相关[28]。VDR基因位于第12号常染色体(q13~q14)。其多态性可能通过调节信使RNA的稳定性,从而影响基因的表达[29]。目前关于VDR基因多态性与AITD的研究,主要集中于FokI、TaqI、BsmI和ApaI 4个常见的单核苷酸多态性位点。Inoue等[30]对139例GD患者、116例HT患者和76例甲状腺功能正常人群(对照组)进行研究发现,HT组VDRFokI多态性的CC基因型和C等位基因分布频率显著高于对照组,且与血清维生素D水平较低相关,因此推测VDRFokI多态性与HT易感性相关。同时该研究还发现,CC基因型GD患者的TRAb水平较CA+AA基因型高51%。以上研究提示,C等位基因可以通过调控TRAb的产生与GD的发病有关,提示VDR基因的遗传差异可能参与了AITD的发生发展。另一项研究发现,与不携带B等位基因的患者相比,携带VDR B等位基因的患者VDR信使RNA水平明显降低[31]。此外一项关于塞尔维亚人群的研究发现,FokI多态性与HT高发病风险显著相关[32]。FokI多态性C等位基因与细胞因子IL-12的产生有关,IL-12可以诱导激活Th1细胞,通过细胞毒性T淋巴细胞和Th1细胞的相互作用,引起甲状腺细胞被破坏[32-33]。一项Meta分析发现,BsmI和TaqI多态性与降低AITD发病风险显著相关,而ApaI和FokI多态性与AITD发病风险无明显相关性[34],这可能与VDR基因多态性影响维生素D代谢水平相关。一项荟萃分析发现,TaqI和FokI多态性仅与降低HT风险有关;基于种族的分层分析中,TaqI多态性在亚洲和非洲人群中与降低AITD风险相关,而在欧洲人群中无此相关性,FokI多态性仅在亚洲人群中与降低AITD风险相关[35]。值得注意的是,BsmI多态性与欧洲和非洲人群的AITD风险降低有关,而与亚洲人群的AITD风险增加有关,提示VDR基因多态性在种族、地域方面也存在差异。研究发现,汉族人群中APaI的A等位基因与中国汉族人群的GD有相关性[36]。可见,VDR基因多态性是AITD遗传易感性的重要因素之一,且GD和HT患者VDR基因多态性等位基因的频率分布有显著差异。目前关于VDR基因多态性与AITD发病遗传易感性的相关研究仍存在争议,但能肯定的是VDR基因多态性可以增加AITD的遗传易感性,这为AITD发病与基因遗传标记提供了更多检测手段,未来需要更多的循证医学证据解释两者相关性。
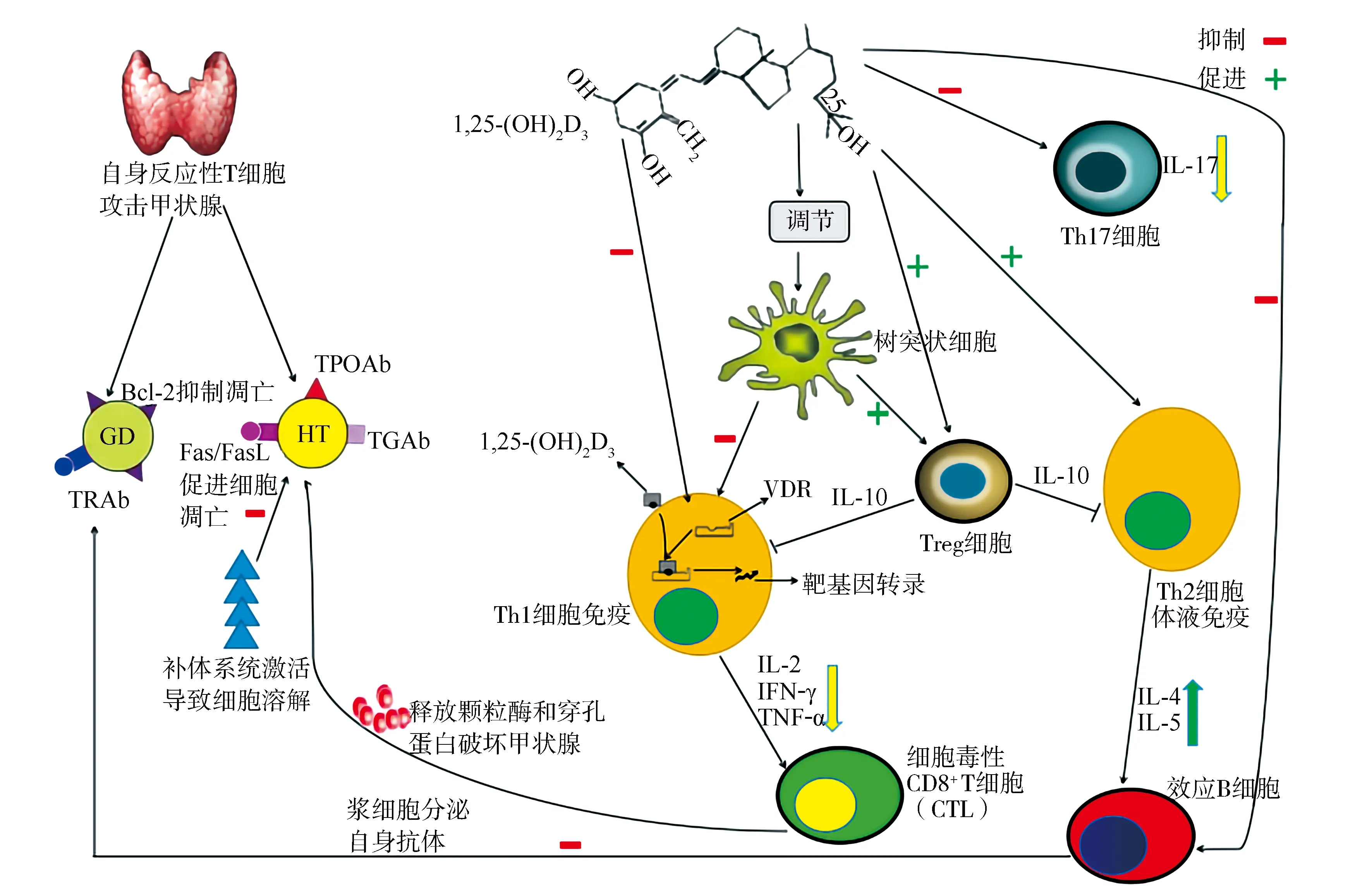
Bcl-2:B细胞淋巴瘤/白血病-2;TPOAb:甲状腺过氧化物酶抗体;GD:格雷夫斯病;HT:桥本甲状腺炎;TGAb:甲状腺球蛋白抗体;TRAb:促甲状腺激素受体抗体;FasL:Fas配体;1,25-(OH)2D3:1,25-二羟维生素D3;Th:辅助性T细胞;VDR:维生素D受体;IL:白细胞介素;IFN-γ:γ干扰素;TNF-α:肿瘤坏死因子-α;Treg细胞:调节性T细胞;CTL:细胞毒性T淋巴细胞;AITD:自身免疫性甲状腺疾病
3.3维生素D缺乏与AITD的关系 目前,关于健康人群血清维生素D的最佳水平与多种因素有关尚未达成共识,维生素D缺乏的界值及分级水平尚无统一标准。血清25-(OH)D水平是评价维生素D是否缺乏的主要诊断依据,目前专家建议的判断标准为血清25-(OH)D<50 nmol/L为缺乏,50~75 nmol/L为不足,75~250 nmol/L为正常[37]。Treg细胞具有可以调控机体外周免疫耐受、抑制炎症因子分泌等重要生理功能,而体内1,25-(OH)2D3缺乏可以引起Treg细胞数量减少,免疫调节功能缺陷,两者相互作用共同维持机体免疫系统正常运转[38]。一项Meta分析表明,AITD患者的血清25-(OH)D水平较健康对照者明显降低,且血清25-(OH)D缺乏的患者AITD的患病率较对照者升高约3倍,提示维生素D缺乏可能在AITD的病理过程中发挥重要作用;此外亚组分析显示,与对照者相比,GD和HT患者合并25-(OH)D缺乏的风险分别升高约3.5倍和4倍,提示血清25-(OH)D水平较低与AITD发病相关[39]。
维生素D缺乏与AITD的高风险患病率之间是否存在因果关系,目前尚无定论。一项随机对照试验发现,与健康对照组相比,甲状腺功能异常组患者的维生素D缺乏比例明显升高,尤其是AITD患者,相对于GD患者,这一现象在HT患者中表现更为突出[40]。在AITD患者中,与维生素D>10 ng/mL患者相比,维生素D缺乏患者甲状腺功能异常比例明显升高;此外,维生素D缺乏患者体内普遍存在抗甲状腺抗体,提示维生素D缺乏与抗甲状腺抗体的存在和甲状腺功能异常有关[40]。Ma等[41]的一项横断面病例对照研究发现,AITD患者的血清25-(OH)D水平低于非AITD对照者,且血清25-(OH)D水平每降低5 nmol/L,GD、HT发病风险分别升高1.55、1.62倍。该研究共纳入168例老年受试者,其中维生素D缺乏人数约占70%,与正常25-(OH)D[25-(OH)D≥20 ng/mL]水平组相比,维生素D缺乏[25-(OH)D<20 ng/mL]组AITD的患病率明显升高。此外,AITD患者25-(OH)D水平与游离三碘甲腺原氨酸和TPO-Ab水平显著相关,尤其是25-(OH)D缺乏患者游离三碘甲腺原氨酸和TPO-Ab水平明显升高,而与TGAb、游离甲状腺素和TSH无相关性,表明维生素D水平一定程度上可以反映自身免疫性疾病的严重程度以及由此导致的甲状腺功能减退[42]。一项关于补充维生素D对AITD影响的研究表明,维生素D替代治疗后甲状腺抗体滴度显著降低,但甲状腺功能与维生素D水平无明显相关性,维生素D缺乏可能是TGAb和TPO-Ab阳性的潜在危险因素[43]。以上研究结果表明,维生素D缺乏是AITD患病的高风险因素,但维生素D水平与甲状腺功能和甲状腺抗体水平的相关性仍存在争议,两者之间的因果关系需进一步研究阐明。
4 小 结
维生素D的缺乏与AITD发生发展有重要联系,但发病机制尚不完全清楚。一方面维生素D与免疫细胞VDR结合能够发挥免疫调节作用,抑制自身免疫反应;另一方面,VDR基因多态性与AITD的遗传易感性相关,这些基因多态性变化可能影响相关基因表达、RNA转录效率或蛋白质结构,提示维生素D在AITD的发展过程中扮演重要角色。未来,为进一步研究维生素D与AITD之间的相互关系和作用机制,以及补充维生素D是否可作为AITD的一种可行性治疗手段,补充维生素D对AITD患者治疗的预后及疗效评估,需进行长期的追踪研究以及高质量的循证医学证据和更广泛的前瞻性研究。
