食源性致病菌活菌检测方法的应用现状及展望
2021-12-21王纯张若鸿王晓芳李晓然杨洋崔生辉郭云昌
王纯,张若鸿,王晓芳,李晓然,杨洋,崔生辉,郭云昌
(1.河北科技师范学院 食品科技学院,河北 秦皇岛 066600;2.中国食品药品检定研究院,北京 100050;3.国家食品安全风险评估中心,北京 100022)
近年来,因食源性致病菌污染食品供应链,引发食品安全问题,造成食源性疾病频繁发生,对其预防与控制已引起世界各国的高度关注。这些致病菌易受到各种环境因素(温度、pH值、湿度、压力、光照辐射、极端环境等)的影响,可能会暂时或永久地破坏细胞的主要结构(细胞膜、核酸、蛋白质等)而丧失功能,使其展现出不同的代谢状态:亚致死状态、活菌非可培养状态(viable-but-non-culturable,VBNC)或持留状态和休眠[1]。因此,在食源性致病菌检测过程中,某些代谢微弱的活菌无法被检出,导致漏检,致病菌仍然存在于食品中,从而威胁消费者健康。反之,如果死菌被检测成活菌,则会出现假阳性结果,不仅阻碍食品的正常生产,还会造成不必要的产品召回,影响安全食品的供应,而且干扰食品监管部门对食品中致病菌的生长情况的正确判断,不能及时发现食品安全隐患并有效控制食品安全风险,对食品产业的健康持续发展造成严重危害。因此,如何区分死菌与活菌是有效检测食源性致病菌的关键环节,提高活菌检测的速度、效率和灵敏度对保障安全食品的供应和预防食源性疾病尤为重要。
基于细胞培养的传统食源性致病菌检测方法耗时较长且无法有效区分处于不同代谢状态的食品微生物[2]。为克服细胞培养方法的局限性,人们提出了各种可替代的、更快速的非细胞培养方法来检测区分食源性致病菌中的死菌或活菌。本文重点介绍了荧光定量聚合酶链式反应(quantitative polymerase chain reaction,qPCR)和信使核糖核酸(messenger RNA,mRNA)检测法及其它基于噬菌体的检测方法,并讨论了其在活体食源性致病菌检测方面的应用及发展前景,以期为进一步探究食源性致病菌的代谢状态,研发更加快速高效的检测方法提供参考。
1 基于细胞培养的方法
传统的细胞培养方法灵敏度较高,成本较低且操作简单,易于使用,成为食源性致病菌检测的“金标准”,因此该方法仍然是目前许多食品检测实验室的首选方法。但是传统的致病菌检测过程相对比较繁琐,需要经过多步完成,如前增菌、选择性增菌、分离纯化、镜检,然后生化鉴定,整个培养时间较长,最多可能需要7 d的时间才能得出检测结果[3],不能满足市场快速准确测定结果的要求。
此外,由于食品基质的异质性,病原体分布不均匀以及食物中目标病原体的含量低等原因可能会干扰选择性鉴定,影响结果的准确性,限制检测方法的灵敏度[4]。如果在被检测的食品中存在处于受损状态、VBNC状态或休眠状态的微生物,基于细胞培养方法的检测能力可能会受到很大限制,不能有效区分死菌或活菌,造成病原菌感染扩散,成为食品安全的潜在隐患,对人类健康造成严重威胁。
2 非细胞培养的方法
非细胞培养方法本质上分为两种,即基于核酸和基于噬菌体的检测方法,它们在检测食源性致病菌活菌方面具有广阔的应用空间。
2.1 基于核酸的方法
以核酸为基础的方法是通过检测特定的DNA或RNA序列来鉴定食源性致病菌。尽管常规及定量PCR检测方法等具有特异性强、灵敏度高和检测快速等特点,但由于无法区分是来自活菌还是死菌的DNA或RNA,难以消除死菌残留DNA导致的假阳性结果,因此单独使用无法证明细胞活性[5]。
2.1.1 qPCR检测法
叠氮溴化乙锭(ethidiummonoazide,EMA)或叠氮溴化丙锭(propidium monoazide,PMA)染料是插入型荧光核酸结合染料。EMA(10 μg/mL)[6]或 PMA(4 μg/mL)[7]在强光下可选择性地透过受损的细胞膜与DNA发生不可逆的共价交联反应,从而抑制PCR扩增,最终只有来自细胞膜完整的细胞DNA才会被扩增[8]。
ZHOU等[9]将PMA作为前处理手段,结合qPCR,用于检测牛奶中的活蜡状芽孢杆菌。选择催产芽孢杆菌的蜡状内酯合成酶基因作为引物,并利用3 μg/mL的PMA处理,以抑制死细胞DNA的PCR扩增。在优化的测定参数下,以纯培养物和加标牛奶为基质,测得活菌的检出限(limitofdetection,LOD)均为 102CFU/mL。值得关注的是,EMA/PMA可能在细菌细胞壁合成期间的某个时刻穿孔,抑制DNA扩增导致假阴性结果。而且细胞膜保持完整状态的细胞不一定具有代谢活性(如VBNC状态的细胞),可能产生假阳性结果[10],无法对致病菌进行准确定量检测,给食品安全带来潜在的不可控风险。此外,在检测时需优先使用PMA,因为EMA能够穿透细胞膜完整的活细胞,容易导致假阴性结果。
2.1.2 mRNA检测法
致病菌的DNA是稳定的核酸分子,并且死菌的DNA降解较慢,因此细菌内是否存在DNA不能作为判断细菌是否存活的标志。而mRNA的半衰期较短,仅仅只有几分钟,在细菌死后很快降解,通常只存在于活细胞中,因此,测定RNA比DNA更适合作为评估细菌活力的靶标[11]。逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)是最常用的基于RNA的分子技术之一,而且是快速检测食品中食源性致病菌的首选方法。BAI等[12]基于磁性捕获探针结合RT-qPCR的mRNA提取法快速检测牛奶中活的沙门氏菌,其中探针和目标序列的复合体直接用作检测沙门氏菌的模板,而无需变性和纯化步骤。通过磁性捕获探针来分离稀释10倍的沙门氏菌人工污染的牛奶中的mRNA,然后利用RT-qPCR检测mRNA,活菌的检测灵敏度可达104CFU/mL,经过12 h增菌培养后可以提高到10 CFU/mL。FOUT等[13]从水样浓缩物中提取病毒的RNA,采用RT-qPCR定量测定饮用水中的肠病毒和诺如病毒的浓度,建立标准曲线,作为RT-qPCR的阳性对照,以每升病毒RNA的基因组拷贝数计算病毒浓度。在处理RNA样品时应需格外小心,以减少RNA的降解。
由于互补脱氧核苷酸(complementary DNA,cDNA)生成步骤需要更长的时间,且提取RNA比较复杂,因此RT-qPCR方法应用于检测食源性致病细菌不太常见。XIAO等[14]利用RT-qPCR方法检测活的单核增生李斯特氏菌细胞,分别在未热处理及经过热处理(98℃,30 min)的单核增生李斯特氏菌样品中提取RNA进行RT-qPCR分析。热处理的细胞在室温(25℃)下保存24 h仍可以检测到RT-qPCR扩增信号,并且信号强度与细胞数量相关,其结果与靶向RNA稳定性有关。可见,不是所有的研究都证明mRNA寿命短,也可能会出现假阳性结果;而且被测样品中致病菌RNA易降解,也可能导致假阴性结果。因此,以mRNA为基础的RT-PCR方法不能够完全区分死菌或活菌,且检测灵敏度受到mRNA提取不稳定的限制。
2.2 基于噬菌体的方法
因噬菌体仅能高特异性地感染具有代谢活性的细菌,并且在活细胞内复制,因此基于噬菌体的方法可以用来检测细胞活性[15]。目前,大多数基于噬菌体的检测方法均把裂解性噬菌体作为裂解剂来检测新的子代噬菌体或根据目标细菌细胞内释放的物质来区分细胞活性。
2.2.1 噬菌体扩增方法
将人工污染致病菌的食品样品与特异性噬菌体一起培养,开始裂解循环,在潜伏期结束之前,用化学杀毒剂(含氯消毒剂、碘伏等)或物理处理(激光、高温等)[16]杀死所有的外源性噬菌体。在受感染的细菌完成裂解循环后,释放新的噬菌体颗粒,感染周围的细菌,12 h培养后产生清除或斑块的区域,如图1所示。
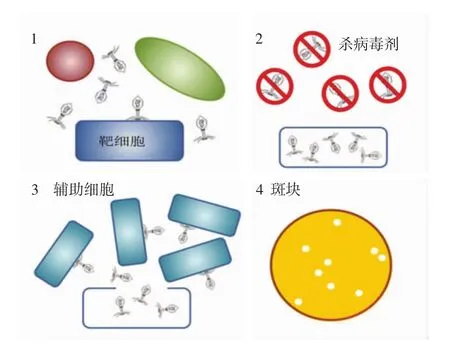
图1 噬菌体扩增(噬斑)试验Fig.1 Phage amplification(plaque)test
由于噬菌体扩增操作简单,具有较高的宿主特异性和较短的扩增时间,而且具有区分活菌和死菌细胞的能力,因此目前已被应用于检测不同的食源性致病菌,例如金黄色葡萄球菌[17]、沙门氏菌[18-19]、大肠杆菌[20]等。如ALCAINE等[20]建立了一种利用生物工程T7噬菌体菌株来提高基于噬菌体扩增的侧向流动的方法检测活菌。该方法在加标肉汤中测得活的大肠杆菌的检出限为103CFU/mL。此外,该方法在加标河水中的检出限为100 CFU/100 mL。然而,噬菌体扩增步骤较为繁杂,不适合高通量测试。如果不能完全杀死外源性噬菌体,可能留下假阳性斑块。虽然可以通过PCR检测来确定斑块中心DNA的身份[21],但可能会延长检测时间。
2.2.2 噬菌体扩增+qPCR/免疫测定方法
随着分子生物学技术的进步,研究发现免疫学[22]或分子检测[23]与噬菌体扩增偶联分别检测子代噬菌体或噬菌体DNA,可以达到更快速的检测时间,检测原理如图2所示。噬菌体扩增释放出子代噬菌体,这些噬菌体可通过qPCR、酶联免疫吸附测定或侧流免疫层析方法进行定量检测。
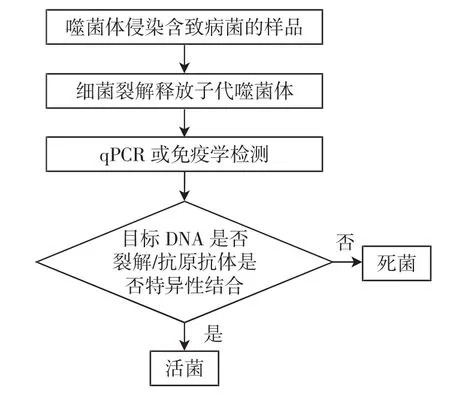
图2 噬菌体扩增+qPCR/免疫学方法检测致病菌活菌原理Fig.2 The principle of phage amplification+qPCR/immunological method to detect live pathogenic bacteria
目前,研究表明噬菌体扩增结合qPCR可以分别在8 h和2 h内从不同的基质(包括加标牛肉汤[23]和人工污染的水样品[24])中高度敏感地检测出活的大肠杆菌O157:H7。将样品进行增菌培养后,检出限分别为10CFU/mL和100 CFU/mL。值得注意的是,噬菌体或宿主DNA要释放到尽可能小的体积,才能最大限度地提高检测灵敏度,否则可能需要进行DNA沉淀和柱提。
MIDO等[22]通过 LuminexMAGPIX仪器上的噬菌体MS2(一种大肠杆菌雄性特异性噬菌体)扩增偶联免疫测定方法来检测活的大肠杆菌。在大肠杆菌缓冲液中存在死细胞(95℃水浴加热15 min)的情况下,MS2仅与活细胞选择性结合,而且大肠杆菌增菌培养3 h之后测得活细胞的灵敏度为 1×102细胞/mL。MARTELET等[25]开发了一种高速灵敏的方法用于检测食品基质中活的大肠杆菌,该方法首先通过特异性噬菌体复制进行信号放大,然后进行免疫捕获和靶向质谱分析。该检测细菌无需进行增菌培养,能够在不到12 h的时间内直接检测到加标牛奶中含有1 CFU/mL活的大肠杆菌。该方法可以进一步改进,通过使用大量噬菌体来促进噬菌体宿主识别或使用免疫纯化的抗体,可能会获得更高的特异性和灵敏度。
2.2.3 噬菌体扩增+酶测定方法
在噬菌体裂解周期完成后,不仅释放子代噬菌体,而且还释放细胞的内容物,包括必需的生物标志物[26]。样品产生的生物发光与细胞内化合物的释放量和样品中最初的活菌的细胞数量成正比,因此可以通过酶和底物反应来测定化合物的释放量。由于β-半乳糖苷酶(β-gal)是大肠杆菌乳糖运输和代谢系统中的必需酶,可以用作检测其活性的指标。因此CHEN等[27]通过监测和测量β-gal活性,并进一步利用大肠杆菌特异性噬菌体进行检测。研究发现在大肠杆菌缓冲液中活菌的检出限可达1×105CFU/mL,该检测在3 h以内完成。此外,基于荧光素酶[28]、蛋白酶[29]和碱性磷酸酶[30]的噬菌体检测方法在测定食品样品中的应用更为广泛。这些操作方法的测定原理基本相同,都是基于酶催化与发光产物的反应。PACZESNY等[26]将携带磷酸酶基因phoA的大肠杆菌噬菌体T7添加到样品中,如果样品中存在活的大肠杆菌,则会发生噬菌体感染、复制和碱性磷酸酶表达,然后使用多种底物检测碱性磷酸酶表达分子,原理如图3所示。
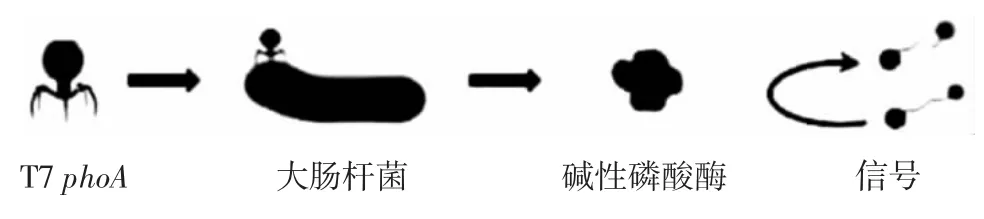
图3 噬菌体扩增+酶测定方法检测原理Fig.3 Detection principle of phage amplification+enzyme assay method
2.2.4 电化学噬菌体生物传感器
噬菌体作为一类特异性感染活细菌的病毒,具有较高的特异性和选择性,而且能够被快速、廉价的大量制备。近年来,利用电化学阻抗谱检测食源性致病菌的研究越来越多。FAROOP等[31]开发了一种将从污水中分离出的金黄色葡萄球菌特异性噬菌体作为生物识别元件,固定于细菌纤维素为基质的电化学生物传感器,通过电流响应可以有效区分细胞混合物中的活菌和死菌。该方法在中性pH值下,30 min以内分别在磷酸盐缓冲液和加标牛奶中检测到低至3 CFU/mL和5 CFU/mL的活的金黄色葡萄球菌。NIYOMDECHA等[32]开发了一种基于沙门氏菌特异性M13噬菌体/金电极并结合电容技术的生物传感器,其中M13噬菌体修饰的电极可以特异性结合活的沙门氏菌。该系统提供了良好的重现性,相对标准偏差为1.1%。此外,当以5倍稀释度的加标鸡肉样品用于活的沙门氏菌检测时,样品进入传感器系统后,该方法能够在40 min内测得沙门氏菌活菌200 CFU/mL的检出限。可见,基于噬菌体的电化学生物传感器在检测食源性致病菌活菌方面具有较大的应用潜力。
3 食源性致病菌活菌检测方法存在的问题及展望
食源性致病菌活菌检测技术在不断进步,每种方法都有各自的优势,然而随着技术的不断进步,缺陷和不足也逐渐暴露出来。传统的细胞培养方法是评估病原体生存能力的“金标准”,但检测速度较慢,而且也存在对持留菌、休眠菌及代谢异质菌无法成功培养的缺陷。近年来,基于核酸的检测方法可以提供较快的检测速度,特别是基于mRNA的检测方法,是一种潜在的快速检测食源性致病菌活菌的解决方案。通常情况下,RT-qPCR方法检测病毒的应用较为普遍。然而,细菌mRNA易降解的特性阻碍了RT-qPCR在食品检测中的大规模应用。而基于噬菌体的检测方法特异性强(100%),灵敏度高,且操作简便、快速,已被广泛应用于食品、临床等样品致病菌活菌的检测,基于噬菌体检测方法的应用见表1。该方法是目前检测食源性致病菌活菌的最佳替代方法,在食源性致病菌活菌检测领域具有巨大的应用前景。
由表1可知,噬菌体扩增+免疫测定与噬菌体扩增+qPCR方法相比,灵敏度略低。噬菌体扩增+qPCR方法可将裂解物直接用作目标噬菌体DNA,用于qPCR分析,而无需任何DNA提取和纯化步骤,已应用于不同基质(食品和临床样品)中,能够高度灵敏、快速地检测不同的食源性致病菌活菌,而且在药代动力学研究和噬菌体治疗期间体内噬菌体繁殖的评估方面具有潜在的应用价值,相信未来在食源性致病菌活菌检测领域将得到更普遍的应用。目前,尽管噬菌体扩增+酶测定方法在食品中检测致病菌活菌的应用较少,但工程化噬菌体与特定蛋白酶结合可以实现对活菌病原体的多重检测[29],且易于在实验室中使用,如沙门氏菌和李斯特氏菌[35]的特异性噬菌体已得到充分证明,这种噬菌体-蛋白酶-肽的组合将为样品中活菌病原体的特异性、灵敏的多重检测提供新的平台。可见,噬菌体单独使用或与酶(从酶抑制剂到磷酸酶)结合使用在食源性致病菌活菌检测领域具有较好的发展潜力。基于噬菌体的生物传感器在食源性致病菌活菌检测方面具有较高的特异性和灵敏度,并且检测快速。然而,由于不同细菌对应的特异性噬菌体不同或者某些细菌对噬菌体具有抗性,因此,在某些特殊情况下这种技术手段在有效区分细菌病原菌的活性方面还面临挑战,相关技术有待进一步深入研究。

表1 基于噬菌体检测方法的应用Table 1 Application based on phage detection methods
此外,目前基于噬菌体的检测方法仍存在一些尚未解决的问题,例如自然界中不同的食源性致病菌可能不存在对应的特异性噬菌体,无法有效检测细菌活性。因此,随着分子生物学和生物工程技术的发展,有待进一步构建新型噬菌体(对噬菌体进行基因工程改造)或重组噬菌体(构建新型的酶标记的目标噬菌体),进而研究开发出灵敏度更高、更快速的低成本检测方法,更好地应用在一些特殊的细菌中,并进一步扩大基于噬菌体的检测方法在实际样品中的应用范围。基于噬菌体的检测方法面临的另一个重要挑战是靶细胞的状态。环境条件、温度、细菌生长速率和细胞损伤等都是影响噬菌体感染成功和感染效率的重要因素[36]。受损细胞即为受到亚致死损伤的细胞,处理方法(加热、冷冻、辐射、发酵等)所造成的损伤是可逆性损伤[37]。尽管不是所有的亚致死致病菌都能够在常规增菌培养条件下修复,但目前研究比较多的食源性亚致死致病菌(包括沙门氏菌、大肠杆菌[38]、李斯特氏菌[39]等)在适当的培养温度下(处理方式不同,所需的最优温度和修复时间不同),受损细胞在营养丰富的非选择性培养基中培养1 h~6 h就能得到修复并进行选择性增殖以达到检测所需的细菌浓度水平。一般对于大部分细菌来说,低温条件下复苏效果较好。可见,处于亚致死损伤状态的致病菌在进行基于噬菌体的方法检测之前,受损细胞需要经过非选择性修复培养(对损伤关键部位进行修复)后再进行选择性增菌来确保细胞处于有利于感染的状态,保证靶细胞的正常生长和成功检测。若受损细胞无法正常修复增殖,则较常应用于PCR的检测方法[40],而不适用于基于噬菌体的检测方法。因此,细菌在检测之前需要进行增菌培养,在适宜的增菌培养条件下以确保细胞处于有利于感染的状态。在未来的研究中,无论是基于过滤还是基于噬菌体的磁珠分离[27],在适当的增菌培养条件下进行细菌浓缩可以确保目标细菌达到必要的细胞浓度,进而加快食源性致病菌活菌的检测速度,提高检测灵敏度,对保障食品安全及开发食源性致病菌活菌的研究具有重要意义。
4 结论
本文对食源性致病菌活菌的检测方法进行了分类与总结,介绍了其在食源性致病菌活菌检测方面的应用及其优势与存在的局限性,并对其面临的机遇和挑战进行了讨论。综上所述,基于噬菌体的检测方法凭借特异性强、灵敏度高和检测时间更短等优势,尤其是噬菌体扩增结合qPCR方法能够快速检测食源性致病菌的细胞活力,区分死菌/活菌,在食源性致病菌活菌检测领域具有广阔的应用前景。因此,随着人们不断的深入研究,新型噬菌体的构建及噬菌体扩增试验与一些技术的交联使用可以有效克服检测中的缺陷,大大提高我国食源性致病菌的监测和预警能力,以期能为相关研究者开发食源性致病菌活菌的检测方法提供参考。
