自然发酵椰子水中拮抗乳酸菌筛选鉴定及抑菌特性
2021-12-21王雅姜海燕马泽威王学梅李从发刘四新
王雅,姜海燕,马泽威,王学梅,李从发,刘四新
(1.海南大学 食品科学与工程学院,海南 海口 570228;2.海南大学 动物科技学院,海南 海口 570228;3.海南大学 理学院,海南 海口 570228)
椰子(Cocos nucifera L.)是海南特有的经济作物和观赏植物,对海南的经济发展有重要作用[1]。目前,椰子加工产品从椰衣到椰壳再到椰子食品,种类丰富多样[2],是海南唯一开发和加工利用度最高的作物果实。椰子食品加工的原料一般可分椰肉和椰子水两大类,绝大多数椰子加工食品都是以成熟椰肉为原料,椰子水是其加工副产物[3-4],这种椰子水不同于饮料用的新鲜椰子水,营养和风味较次[5],取椰肉的工艺也决定了其极易遭受污染而失鲜、变味,不适于饮用。过去,这种椰子水主要用作椰纤果(nata de coco)发酵生产的原料[6],目前,由于经济和环保因素,国内椰纤果的发酵生产基本消失,椰纤果压缩果片原料基本靠从国外进口,导致国内成熟椰子水无法得到有效利用而废弃,既污染环境又浪费资源[7]。据估测,目前,国内每天废弃成熟椰子水可能达数百吨,经济损失十分严重,因此寻找成熟椰子水的新利用方式迫在眉睫。众所周知,椰子水营养成分种类丰富、全面,浓度适中,常温下极易繁殖各种微生物而变味、变质[8-9]。基于高效利用资源原则,本研究拟将椰肉生产中失鲜、欠鲜的成熟椰子水利用益生菌进行培养和发酵,制成禽类饲用添加剂、投喂到海南文昌鸡的养殖中,以有效促进鸡的肠道健康并充分利用椰子水资源,减少浪费和损失,同时可极大提高椰子水的综合利用附加值。
近年来,由于养殖业抗生素的大量使用而造成的耐药性致病菌危害问题日趋严峻。在欧盟、日韩陆续禁用促生长类抗生素之后[10],我国农业农村部也于2020年7月1日全面禁止商品饲料中添加促生长类药物(中药类除外)[11]。在“饲料禁抗、养殖减抗”的大背景下,养殖产业因动物产生肠道疾病或亚健康造成养殖成本上升,经济损失风险明显加大[12]。因此,针对性研发有益于肠道健康、增强免疫活性、效率高、成本低的饲料或者饲料添加剂势在必行。乳酸菌对动物机体的健康和肠道菌群的平衡有重要的作用[13-14],其资源在自然界广泛存在,常常可从发酵果蔬、动物肠道或者粪便中筛选获取到优良乳酸菌[15-17]。本试验从海南自然发酵的椰子水中筛获乳酸菌,以筛自病死鸡、具有多重耐药性的致病性大肠杆菌和沙门氏菌为指示菌,首先进行抑菌活性筛选和耐受性测试,然后将益生特性优良的菌株进行椰子水高密度发酵培养,再对其抑菌作用特性进一步研究。基于自然发酵椰子水中筛选获取的高活性益生菌在椰子水高密度发酵培养后进行饲料用途的开发研究未见报道,可为失鲜而不宜食用的成熟椰子水开发成饲料添加剂提供参考。
1 材料与方法
1.1 材料与试剂
椰子水:市售成熟椰子,破壳取水后纱布过滤。每批次约150个椰子的水混匀、立即分装后置-20℃保存备用。使用前经105℃、15 min灭菌。沙门氏菌(Salmonella)(编号:SWX、SXS)、大肠杆菌(Escherichia coli)(编号:ECJX、ECHN、ECXT、ECDY、ECXS):来源于病死肉鸡,由华中农业大学动物科技学院预防医学实验室提供。
供试菌:共29株乳酸菌(编号64-1、131-1、32-1-2、32-2-1、A32、A33、A35、B20、L6、L11、L20、L25、L26、L31、L35、L37、L39、L40、L44、L45、L48、L50、L51、L57、L63、L64、L65、L67、L70),来源于自然发酵椰子水,由海南大学食品科学与工程学院保存提供。培养基:乳酸菌使用MRS培养基、鸡源致病菌使用LB培养基。环丙沙星、阿米卡星药敏实验纸片、有机酸标准品、中性蛋白酶(200 U/mg)、胰蛋白酶(250 U/mg):北京索莱宝科技有限公司;胃蛋白酶(250 U/mg):SIGMA公司。
1.2 仪器与设备
高效液相色谱仪(Agilent 1260):美国安捷伦公司;紫外分光光度计(T6新世纪):北京普析通用仪器有限责任公司。
1.3 试验方法
1.3.1 指示菌的耐药性测试
指示菌的培养:将斜面和液体活化过的7株鸡源致病菌 SWX、SXS、ECJX、ECHN、ECXT、ECDY 和ECXS分别以3%的接种量接种到LB液体培养基中,37℃培养24 h。
耐药性测试:分别取100μL指示菌液(活菌数约为109cfu/mL)以倾注法制备指示菌培养基平板。分别用无菌镊子将阿米卡星、环丙沙星药敏实验纸片放置于平板内,37℃培养24 h,观察并测量药片的抑菌圈大小[18]。
1.3.2 拮抗乳酸菌的筛选和菌种鉴定
供试乳酸菌的培养:将29株供试乳酸菌以3%接种量分别接种到灭菌的椰子水中,37℃培养1 d~2 d。
抑菌活性初筛:以无菌打孔器于倾注法制备的指示菌平板上打孔(6 mm),注入80 μL乳酸菌发酵椰子水,每株菌3个平行,37℃培养24 h,观察并测量抑菌圈大小。
耐受性复筛:对抑菌活性大的乳酸菌进行耐受性测定,参考文献[19]测定在 pH 值为 2.0、3.0、4.0,胆盐质量浓度为0.3%、0.6%、0.9%和未经处理的MRS培养基下培养了16 h的OD600值,计算耐受存活率。
菌种鉴定:将筛选到的目标菌株送深圳华大基因公司进行菌种鉴定。
1.3.3 目标乳酸菌在椰子水中的生长规律
以系列稀释-平板涂布法测定目标乳酸菌在椰子水中培养时的活菌数变化规律。
1.3.4 目标乳酸菌发酵椰子水的抑菌特性
参考文献[20],以 SWX、SXS、ECJX 为指示菌,测定目标乳酸菌发酵椰子水经不同蛋白酶(胃蛋白酶、胰蛋白酶、中性蛋白酶)、在不同 pH 值(4.0、5.0、6.0)以及不同温度(60、80、100℃)处理后抑菌活性的变化规律。
测定目标乳酸菌在椰子水中培养的pH值、总酸、有机酸种类及含量[21]随时间的变化。
1.4 数据处理与统计分析
采用SPSS 22.0进行单因素方差分析(Duncan),使用GraphPad Prism进行绘图,数据结果用平均值±标准差表示。
2 结果与分析
2.1 指示菌的耐药性
环丙沙星和阿米卡星是常用治疗革兰氏阴性致病菌的抗生素。本研究使用来自于病死肉鸡的常见致病菌——大肠杆菌和沙门氏菌作为指示菌,测试其耐药性后选择多重耐药菌株进行拮抗菌筛选。指示菌对环丙沙星和阿米卡星的敏感性结果见表1。

表1 指示菌对环丙沙星和阿米卡星的敏感性Table 1 Sensitivity of indicator bacteria to ciprofloxacin and amikacin
表1结果显示,致病菌株SWX、SXS、ECJX对两种抗生素均表现耐药。一般鸡场发病时多表现为多种致病菌交叉感染,故选择这3株致病菌进行后续拮抗菌筛选。
2.2 拮抗乳酸菌的筛选和菌种鉴定
2.2.1 抑菌活性初筛
本试验前期从自然发酵椰子水中分离筛选到多株乳酸菌,挑选29株在椰子水中生长较好的乳酸菌进行拮抗菌筛选。首先筛选到对7株鸡致病菌都有抑制作用的乳酸菌共 5 株:A32、L11、L20、L48 和 L51,对双重耐药菌株SWX、SXS和ECJX的抑菌活性如图1所示,发现菌株A32、L11、L51的抑菌活性较强于其他菌株,因此选择这3株乳酸菌进行后续试验。
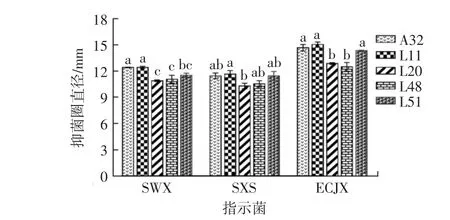
图1 不同乳酸菌的抑菌圈直径Fig.1 Diameter of inhibition zone of different lactic acid bacteria
2.2.2 耐受性复筛
为了筛选到对鸡肠道健康有利的乳酸菌,对筛选到的3株乳酸菌进行耐受性测试,结果如图2、图3所示。

图2 不同乳酸菌的耐酸存活率Fig.2 The acid-resistant survival rate of different lactic acid bacteria
由图2可知,在pH4.0的培养基中培养16 h后,A32的存活率为45.76%,显著高于L11和L51(p<0.05),L11的存活率也显著高于L51(p<0.05);在pH3.0下,A32和L11的存活率均显著高于 L51(p<0.05);在pH2.0的培养基中几乎不生长。综上可知,A32和L11的耐酸能力强于L51。
如图3,随着胆盐浓度的增加,乳酸菌的生长受到了不同程度的抑制。在胆盐浓度为0.6%、0.9%的培养基中培养16 h后,A32的存活率分别为8.38%、5.21%,显著高于L11和L51(p<0.05);3株乳酸菌中A32的耐胆盐能力最好,存活率较高。

图3 不同乳酸菌的耐胆盐存活率Fig.3 Bile salt resistant survival rate of different lactic acid bacteria
综上所述,拟选定抑菌能力强、耐酸和耐胆盐能力都较好的A32菌株作进一步研究。
2.2.3 菌种鉴定
A32革兰氏染色镜检图见图4。
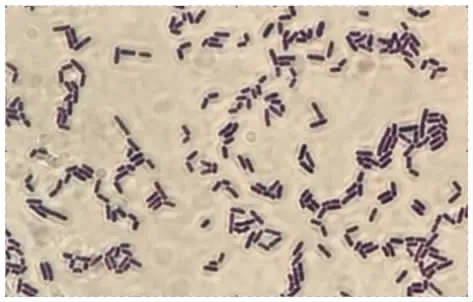
图4 A32革兰氏染色镜检图Fig.4 Microscopic view of A32 Gram stain
如图4(放大倍数为100×10)所示,A32菌株为两端钝圆的短杆菌、革兰氏阳性菌,单个或成对排列,经16S rDNA分子生物学鉴定为发酵乳杆菌(Lactobacillus fermentum)。据报道,发酵乳杆菌具有较强的抑菌活性、并对肠道环境有较好的耐受性,同时还具有免疫调节、抗氧化、降解胆固醇等益生特性,是人和动物肠道的正常菌群[22]。
2.3 目标乳酸菌在椰子水中的生长规律
前述研究已显现菌株A32能在椰子水中快速生长繁殖,为考察其生长规律及未来以椰子水液态制剂直接应用时活力的稳定性,研究了培养1 d~5 d活菌数变化,结果见图5。
由图5可知,发酵24 h其活菌数可迅速增加至9.05 lg cfu/mL,并在1 d~3 d内都趋于稳定、活菌数维持在9 lg cfu/mL左右,发酵至第4天,活菌数开始缓慢下降,但仍达8 lg cfu/mL以上,但当至第5天时,活菌数剧烈下降至6.03 lg cfu/mL。说明该菌株在椰子水中能保持旺盛生长1 d~4 d,初步显示其进行活菌菌剂开发应用时的稳定性较好。
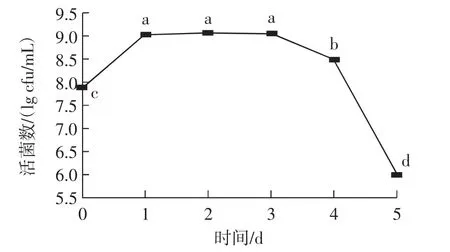
图5 目标乳酸菌A32在椰子水中的生长规律Fig.5 Growth regularity of target strain A32 in coconut water
2.4 目标乳酸菌发酵椰子水的抑菌特性
为考察筛得的目标乳酸菌A32的抑菌物质的特点,开展了其抑菌特性研究。
2.4.1 在椰子水中抑菌活性的变化规律
A32菌株在椰子水中能维持4 d较好的生长,为考察其抑菌活性与菌体生长之间的关系,以双重耐药的致病菌SWX、SXS、ECJX为指示菌,研究了A32发酵椰子水的抑菌活性变化规律,结果见图6。
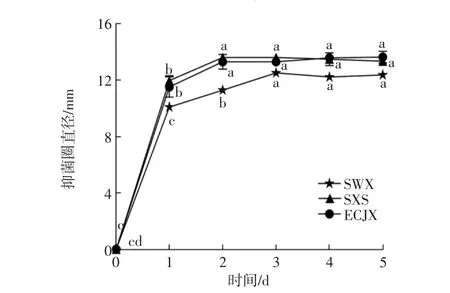
图6 A32发酵椰子水抑菌活性随发酵时间的变化Fig.6 Changes of antibacterial activity of fermented coconut water with fermentation time
由图6可知,抑菌活性在第1天后迅速增强,第3天后不再有明显增加(p>0.05),维持到第5天时也未出现明显下降,说明抑菌活性在完成对数生长后迅速增大,但并不与活菌数直接相关,由此推测,抑菌物质可能主要为初级代谢产物。
2.4.2 目标乳酸菌发酵椰子水中抑菌物质的稳定性
酶、酸和热处理对A32发酵椰子水抑菌活性的影响见表2。
由表2可知,A32菌株发酵椰子水在经过胃蛋白酶、胰蛋白酶、中性蛋白酶等不同蛋白酶处理2 h后的抑菌活性几乎无变化(p>0.05),说明其抑菌物质对蛋白酶不敏感,应该不是蛋白质和多肽类。

表2 酶、酸和热处理对A32发酵椰子水抑菌活性的影响Table 2 Effects of enzymes,acids and heat treatment on the antibacterial activity of A32 fermented coconut water
在乳酸菌A32抑菌活性对pH值的稳定性试验中发现,当调至pH4.0时,其对3株耐药性致病菌SWX、SXS、ECJX的抑制活性均有所降低;而当pH值调到5.0或者6.0时,抑菌圈完全消失。在热稳定性试验中,A32发酵椰子水分别经过60、80、100℃水浴处理30min后对3株指示菌的抑制活性几乎无变化(p>0.05)。说明A32的抑菌物质有较好的耐热性,且可能主要为有机酸类成分。
2.4.3 目标乳酸菌在椰子水中的产酸规律
为直接了解菌株A32的产酸规律,研究了其pH值、总酸和有机酸随发酵时间的变化情况,结果见图7、图 8。

图7 A32发酵椰子水pH值和总酸随发酵时间的变化Fig.7 Changes of pH and total acid of A32 fermented coconut water with fermentation time
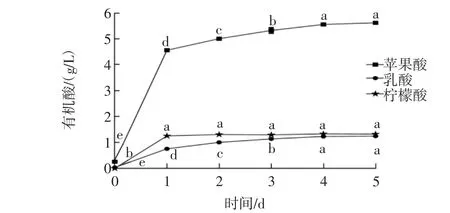
图8 A32发酵椰子水主要有机酸随发酵时间的变化Fig.8 Changes of main organic acid in A32 fermented coconut water with fermentation time
由图7可知,前3 d,A32发酵椰子水的pH值不断下降、总酸含量不断增加,但第3天后pH值与总酸含量趋于稳定、不再有显著性变化(p>0.05),第3天时其pH值为3.55、总酸含量为17.09 g/L。结合图6的抑菌活性分析,发现A32发酵椰子水的抑菌活性与总酸含量呈显著正相关关系(p<0.05),说明A32在椰子水中产生的抑菌物质可能主要是有机酸类物质。
经前期检测,A32发酵椰子水中产生的有机酸主要有苹果酸、柠檬酸、乳酸、丙酮酸等,其中苹果酸、柠檬酸和乳酸的含量约占总有机酸含量的64%、15%、14%。通过测定不同时间3种主要有机酸的变化情况(如图8)发现,柠檬酸含量在发酵第1天就达到较高值(1.255 g/L),之后都未有显著性增加(p>0.05)。但苹果酸和乳酸的含量在前4d一直呈显著性增加(p<0.05),第4天苹果酸和乳酸的含量分别为5.553、1.232 g/L。柠檬酸、苹果酸和乳酸对大肠杆菌和沙门氏菌均有一定的抑制作用,同浓度情况下,乳酸的抑菌活性更强[23]。酸类对微生物的抑制作用不仅取决于氢离子浓度,还与酸根离子、未解离的分子及有机酸的种类有关[24]。苹果酸在高酸性条件下不电离,其杀菌能力比中性时的离解态大100倍以上,同时,苹果酸还具有抗氧化作用、螯合作用和高细胞膜透过作用[25]。因此,菌株A32高活性的抑菌作用与其较强的产酸能力和较高的苹果酸、乳酸含量有关。
3 结论
本文以筛选自自然发酵椰子水中生长良好的乳酸菌为研究对象,以来自病死肉鸡的沙门氏菌和大肠杆菌为指示菌进行抑菌活性初筛,得到抑菌活性较高的A32、L11与L51 3个菌株,再经过耐酸耐胆盐的复筛,获取了一株优良菌株A32,经分子生物学鉴定其为发酵乳杆菌(Lactobacillusfermentum)。A32菌株在椰子水中能保持旺盛生长1 d~4 d,活菌数维持9 lg cfu/mL左右,这是该株发酵乳杆菌的一个独特特性,使其以椰子水活菌制剂用作饲料添加剂成为可能。蛋白酶和高温处理对其抑菌活性几乎未产生影响,但调整pH值至5.0以上时其抑菌活性消失,其抑菌活性与其总酸含量呈显著正相关关系(p<0.05),因此,推测A32在椰子水中所产抑菌物质主要是有机酸类,具体种类主要有苹果酸、柠檬酸和乳酸,其中苹果酸含量占64%以上。发酵乳杆菌A32在椰子水中快速和高密度繁殖后较高活性的抑菌作用可能与其较高的总酸含量和较高苹果酸含量有关,具体机制有待深入研究。
