青刺果发酵液对UVA损伤人皮肤成纤维细胞的修复作用
2021-12-21张永涛赵丹安全张佳婵王昌涛李萌
张永涛,赵丹,安全,张佳婵,王昌涛,3,李萌*
(1.北京工商大学 化学与材料工程学院 北京市植物资源研究开发重点实验室,北京 100048;2.云南白药集团股份有限公司,云南 昆明 650504;3.北京工商大学 北京食品营养与人类健康高精尖创新中心,北京 100048)
青刺果(Prinsepia utilis Royle)又名青刺尖、打油果等,是蔷薇科扁核木属植物总花扁核的果实,主要生长在四川、贵州、云南和西藏等地区。青刺果常用于治疗皮肤烧伤、跌打损伤、攻毒、活血、祛瘀等[1]。现代研究表明,青刺果内富含黄酮和多酚类化合物[2],具有较好的抗氧化、降血糖血脂、抗炎等功效[3-6],因此青刺果的提取成分多被用于药品、食品和化妆品中[7-8]。
紫外线(ultraviolet,UV)是导致皮肤衰老、损伤重要的原因之一,尤其是在长期的长波紫外线(ultraviolet A,UVA)(320 nm~400 nm)辐照下会对皮肤真皮层造成细胞损伤,导致皮肤发生光损伤、光老化甚至光致癌[9-10]。研究发现,UVA照射培养人成纤维细胞后,会使细胞内活性氧(reactive oxygen species,ROS)水平提高而产生氧化应激反应,伴随着抗氧化酶适应性上调。这些抗氧化酶,尤其是过氧化氢酶(catalase,CAT)的表达,能进一步增强人成纤维细胞对UVA的光保护[11]。
已有研究表明,黄酮类化合物和多酚类化合物具有很好的抗氧化作用,对UVA损伤的人皮肤成纤维细胞(human skin fibroblasts,HSF)有很好的修复作用[12-14]。研究表明微生物发酵作为一种天然产物提取的方法存在降低提取物毒性、分解物质为易吸收的小分子活性物质或修饰物质结构以增强功效活性等优点[15-17],本研究对比了青刺果发酵液(fermentation extract of P.utilisRoyle,FEP)和青刺果水提液(waterextractofP.utilis Royle,WEP)中总黄酮和总多酚的含量,并分析两者对UVA诱导损伤后的人皮肤成纤维细胞的修复作用,旨在分析FEP与WEP存在的差异性。
1 材料与方法
1.1 材料与试剂
青刺果:云南白药集团股份有限公司;德氏乳杆菌保加利亚亚种(CICC 20247):中国食品发酵工业研究院有限公司;人皮肤成纤维细胞(human skin fibroblast,HSF):中国医学科学院基础医学研究所细胞资源中心;焦性没食子酸:国药集团化学试剂有限公司;DMEM 培养基、胎牛血清(fetal bovine serum,FBS)、链霉素、青霉素、胰蛋白酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA):美国 GIBCO 生命技术公司;磷酸盐缓冲液(phosphate buffered solution,PBS):北京索莱宝科技有限公司;TransScriptOne-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒、TransStartTop Green qPCR SuperMix试剂盒:北京全式金生物技术有限公司;芦丁标准品、1,1-二苯基-2-苦苯肼(DPPH):上海麦克材生化科技有限公司;Cell Counting Kit-8(CCK8)试剂盒、总抗氧化能力检测试剂盒:百瑞极生物科技有限公司;总RNA抽提试剂盒、过氧化氢酶检测试剂盒、活性氧检测试剂盒:碧云天生物技术有限公司。以上试剂均为分析纯。
1.2 仪器与设备
恒温水浴锅(SY21-Ni4型):北京市精科华瑞仪器有限公司;恒温培养箱(HWS智能型):宁波江南仪器厂;超净工作台(YJ-2450型):苏州净化设备厂;高速台式冷冻离心机(Sigma 3-18KS):德国Sigma公司;电子天平(ME104E型):梅特勒-托利多仪器(上海)有限公司;酶标仪(Tecan Sunrice):帝肯(上海)贸易有限公司;超声波细胞破碎仪(BILON-1500Y型):上海比朗仪器制造有限公司;CO2培养箱(HeracellTMVIOS 250i)、实时荧光定量PCR仪(Quantudio3-Real Time):赛默飞世尔科技(中国)有限公司;TLD18WBLB无臭氧UVA灯:飞利浦中国有限公司。
1.3 试验方法
1.3.1 WEP的制备
称取粒径为50目的青刺果粉20 g,以料液比1∶15(mg/mL)加去离子水,在70℃水浴摇床中提取3 h,4 900 r/min离心15 min,取上清液过膜备用。
1.3.2 FEP的制备
称取粒径为50目的青刺果粉20 g,以料液比1∶15(mg/mL)加入去离子水,120℃高温灭菌 20 min,冷却后接入5%的德氏乳杆菌扩培菌液,在28℃恒温培养箱中静置培养2 d后高温灭菌20 min,4 000 r/min离心15 min,取上清液过膜备用。
1.3.3 总黄酮含量测定
参照文献[18]的方法测定WEP和FEP中总黄酮的含量,设置 6个梯度(0.2 mg/mL~0.7 mg/mL)的芦丁标准溶液,用酶标仪测定A510,分别以芦丁标准溶液的浓度和吸光度为横坐标和纵坐标,绘制标准曲线,并计算回归方程。得到标准曲线为y=0.855 4x+0.000 6(R2=0.9965)。分别吸取1mL的WEP和FEP,按同样方法进行试验,测定A510,代入标准曲线计算总黄酮含量。
1.3.4 总多酚含量测定
参照文献[19]的方法测定WEP和FEP中总多酚含量,设置焦性没食子酸的浓度梯度,用酶标仪测定A765,分别以没食子酸的浓度和吸光度为横坐标和纵坐标,绘制标准曲线,计算回归方程。得到标准曲线为y=0.8591x+0.0793(R2=0.9982)。准确称取 0.5mL 的WEP和FEP,按照同样方法进行试验,测定A765,代入标准曲线计算总多酚含量。
1.3.5 DPPH自由基清除试验
DPPH自由基清除试验的操作方法参考文献[20],测定不同稀释倍数的WEP和FEP的DPPH自由基的清除率,测定在517 nm处的吸光度,根据以下公式计算WEP和FEP的DPPH自由基清除率。
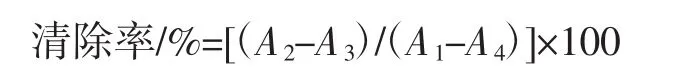
式中:A1为空白对照组吸光度;A2为待测样品组吸光度;A3为无水乙醇和样品溶剂对照组吸光度;A4为无水乙醇溶剂对照组吸光度。
1.3.6 细胞培养
将HSF细胞在含有10%胎牛血清和1%青霉素-链霉素的DMEM培养液的培养瓶中进行培养。细胞保存在含5%CO2的37℃恒温培养箱中培养2 d。所有细胞试验在第3代和第6代之间的细胞基础上进行。
1.3.7 UVA诱导损伤
将人皮肤成纤维细胞以3×105个细胞/孔的密度接种于6孔板中,在37℃的DMEM完全培养液中孵育24 h,倒掉培养液,用PBS洗涤2次,并覆盖一层薄薄的PBS。使用配备15 W无臭氧UVA灯的UV光疗仪器将HSF细胞以18 J/cm2的剂量暴露于UVA照射2.5 h。暴露于UVA后将细胞分别在含有WEP和FEP的完全培养基中再培养24 h。
1.3.8 细胞活性测定
取对数生长期的HSF细胞用0.05%的胰酶消化细胞2 min~5 min,用DMEM完全培养液停止胰酶消化,经离心稀释成细胞浓度大约为8×104个细胞/mL~1×105个细胞/mL 细胞悬液,以 100 μL/孔接种于 96 孔板中(每孔8×103个~1×104个细胞),空白孔每孔 100μL PBS,培养12 h,倒掉培养液,用PBS洗涤2次,设置6组平行,每孔加入100 μL配制好的6个浓度梯度的样品溶液 (0.125%、0.25%、0.50%、1.00%、2.00%、5.00%),对照组加100 μL无血清的DMEM,空白孔加100 μL PBS,培养24 h;倒掉培养液,用 PBS洗涤 2次,所有孔加入100 μL无血清DMEM和10 μLCCK8试液,孵育2 h~3 h,用酶标仪测定A450。UVA诱导损伤模型组按以上同样的方法,测定A450。按照以下公式计算细胞存活率。
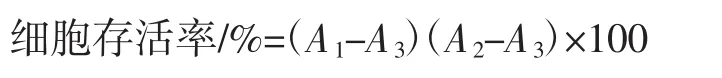
式中:A1为样品组吸光度;A2为对照组吸光度;A3为空白组吸光度。
1.3.9 HSF细胞内ROS水平测定
按检测试剂盒中方法测定细胞内ROS含量。暴露于UVA后的HSF用体积分数分别为0.50%、1.00%、2.00%的WEP和FEP的完全培养基培养24 h,倒掉样品溶液并用PBS清洗2次,后续步骤按照试剂盒给定的方法进行操作,并使用荧光酶标仪在488 nm激发波长和525 nm发射波长处检测WEP和FEP处理后细胞内ROS的荧光强度。
1.3.10 HSF细胞抗氧化能力测定
按照总抗氧化能力检测试剂盒测定FEP和WEP对UVA诱导损伤后HSF细胞的总抗氧化能力。根据样品对细胞存活率的影响结果,最终选择体积分数为5.00%、2.00%、1.00%的青刺果发酵液,作用于UVA诱导损伤的HSF细胞24 h,收集约1×106个细胞,在200 μL PBS中,用超声充分破碎细胞,释放HSF中的抗氧化物,4℃下12 000×g离心5 min,取上清液用于后续测定。按照总抗氧化能力检测试剂盒给定的方法进行试验操作,最后用酶标仪测定A734,根据标准曲线计算出样品的总抗氧化能力。
1.3.11 HSF细胞内CAT活力测定
按照过氧化氢酶检测试剂盒给定的方法,分别配制浓度分别为 0、0.625、1.25、2.5、3.75 mmol/L 的过氧化氢溶液,各取4 μL和200 μL显色工作液加入96孔板中,在25℃下至少孵育15 min后用酶标仪测定A520,并绘制标准曲线。分别取4 μL经青刺果水提液和发酵液处理24 h的细胞裂解液于1.5 mL离心管中,加入37 μL过氧化氢酶检测缓冲液和10 μL 250 mmol/L过氧化氢,充分混匀后反应5 min,加入450 μL过氧化氢酶反应终止液,充分混匀以终止反应。在离心管中加入40 μL过氧化氢酶检测缓冲液和10 μL已终止并混匀的反应体系,混匀,在25℃条件下孵育15 min后,利用酶标仪测定A520,并用试剂盒方式计算过氧化氢酶活力。
1.3.12 总RNA提取和反转录
按照总RNA抽提试剂和反转录试剂盒中的要求进行RNA的提取和反转录试验。
1.3.13 引物及探针的设计和合成
根据美国国家生物信息中心(National Center for Biotechnology Information,NCBI) 发布的序列基因,用Primer Express软件设计出目的基因的特异性引物(包含管家基因β-actin),如表1所示。

表1 实时荧光定量PCR引物序列Table 1 Primer sequences for real-time PCR
1.3.14 实时荧光聚合酶链式反应(polymerase chain reaction,PCR)
1.4 数据处理
本研究中的试验数据均利用Prism9软件进行统计学分析处理,组间比较采用单因素ANOVA分析,两两比较采用t检验,以p<0.05为差异有统计学意义,所得结果以(平均值±标准差)表示。
2 结果与分析
2.1 WEP和FEP中总黄酮和总多酚含量
WEP和FEP中总黄酮、总多酚含量测定结果见图1。
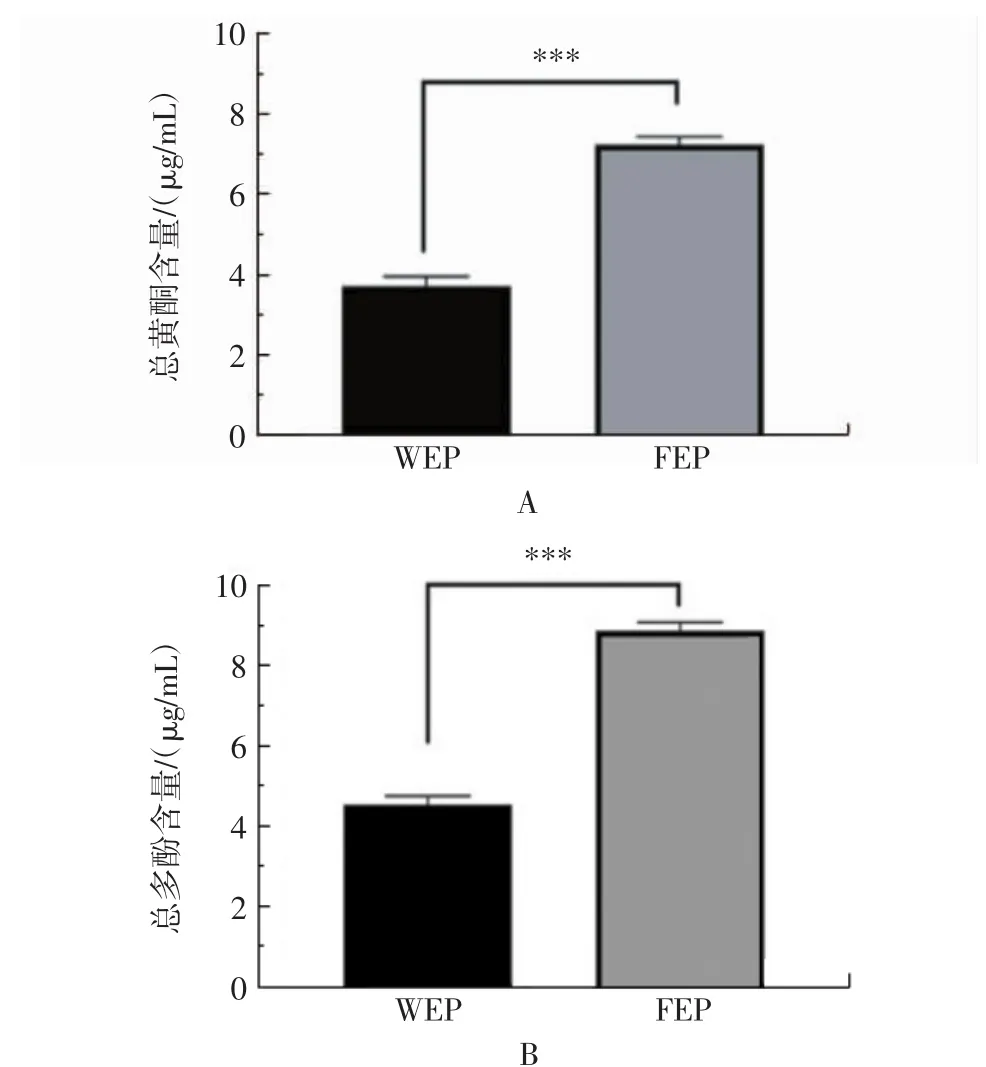
图1 WEP和FEP中总黄酮及总多酚含量Fig.1 The content of total flavonoids and total polyphenols in WEP and FEP
由图1所示,WEP总黄酮含量为(3.73±0.25)μg/mL,总多酚含量为(4.54±0.22)μg/mL;FEP中,总黄酮含量为 (7.24±0.19)μg/mL,总多酚的含量为(8.89±0.21)μg/mL。FEP中总黄酮和总多酚的含量均高于WEP,且存在高度显著的差异性(p<0.001)。
2.2 WEP和FEP体外抗氧化能力
WEP和FEP对DPPH自由基清除率如图2所示。

图2 WEP和FEP体外抗氧化能力Fig.2 In vitro antioxidant capacity of WEP and FEP
由图2A可知,WEP和FEP在稀释0到15倍之间,均具有很高的DPPH自由基清除率,未有明显的差别,随着稀释倍数的加大,二者对DPPH自由基清除能力的差异也越来越显著,由图2B可知,当DPPH自由基清除率在50%时,WEP和FEP的稀释倍数分别为54.797倍和86.446倍,FEP是WEP的1.58倍。由此可见,FEP的DPPH自由基清除能力明显强于WEP。
2.3 WEP和FEP对UVA诱导损伤的HSF模型的修复作用
2.3.1 WEP和FEP对HSF细胞活性的影响
WEP和FEP对HSF细胞活性的影响如图3所示。
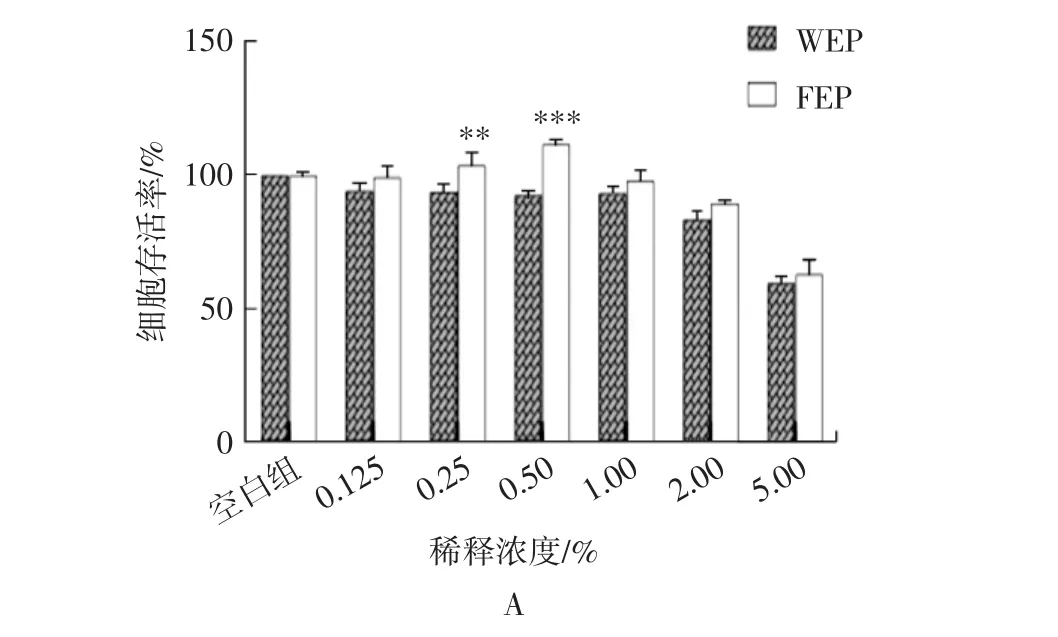

图3 WEP和FEP对HSF细胞活性的影响Fig.3 Effects of WEP and FEP on HSF cell activity
由图3 A可知,当样品浓度在0%~2%时,细胞存活率在85%以上,浓度为0.25%和0.5%时,WEP和FEP之间存在极显著(p<0.01)和高度显著的差异(p<0.001)。由图3B可知,FEP的80%最大效应浓度比WEP高,可见FEP对细胞的毒性更低;由图3C可知,不同浓度的WEP和FEP对UVA损伤后的HSF细胞都有不同程度的修复作用。总体来看,FEP对HSF细胞的毒性和修复能力更强。并按照结果综合分析选择了3个浓度进行后续试验,分别为0.5%、1.0%和2.0%。
2.3.2 WEP和FEP对HSF内ROS水平的影响
在探究WEP和FEP对UVA诱导的损伤后HSF的抗氧化作用中,分别使用0.50%、1.00%、2.00%的WEP和FEP处理UVA诱导的损伤后的HSF细胞,使用活性氧检测试剂盒检测HSF细胞中的ROS含量,结果如图4所示。
由图4可知,空白对照组ROS水平高度显著低于UVA诱导损伤后的ROS水平(p<0.001);而样品组相比于UVA模型组,WEP和FEP均显著降低了UVA诱导损伤后HSF内ROS水平;并且在浓度为0.50%和1.00%时,FEP与WEP分别存在高度显著差异(p<0.001)和极显著差异(p<0.01)。结果表明,FEP 在降低UVA诱导损伤的HSF内ROS水平的能力强于WEP。

图4 WEP和FEP对UVA诱导损伤的HSF内ROS水平的影响Fig.4 The effect of WEP and FEP on the level of ROS in HSF induced by UVA
2.3.3 WEP和FEP对细胞总抗氧化能力的影响
考察3个浓度的WEP和FEP对UVA诱导损伤的HSF的总抗氧化能力,结果如图5所示。
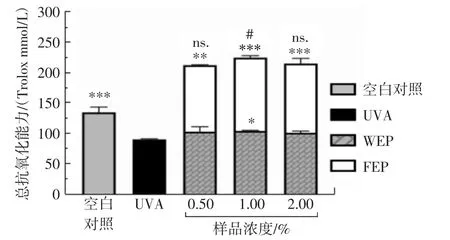
图5 WEP和FEP对UVA诱导损伤的HSF总抗氧化能力的影响Fig.5 The effect of WEP and FEP on the total antioxidant capacity of UVA-induced damage to HSF
由图5可知,与UVA损伤模型相比,WEP只有在1.0%时有统计学差异(p<0.05),而不同浓度的FEP都存在显著性差异(p<0.01,p<0.001),由此表明,FEP 的总抗氧化能力明显强于WEP。
2.3.4 WEP和FEP对HSF内CAT酶活性的影响
考察3个浓度的WEP和FEP对UVA损伤后的HSF的过氧化氢酶活力的影响,结果如图6所示。
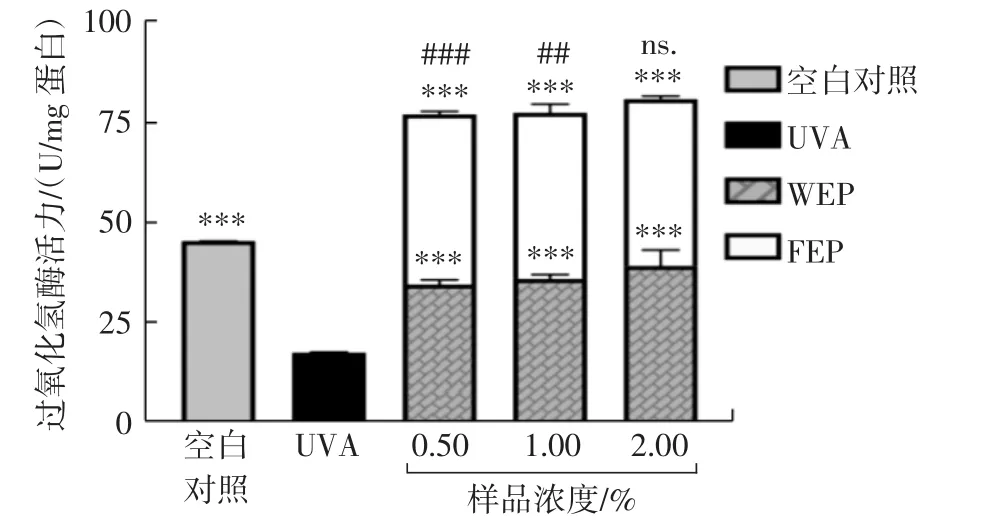
图6 WEP和FEP对UVA诱导损伤的HSF内过氧化氢酶活性的影响Fig.6 The effect of WEP and FEP on catalase activity in HSF induced by UVA
由图6可知,相比于UVA模型组,WEP和FEP能高度显著促进过氧化氢酶活力(p<0.001);并且在0.5%和1.0%时WEP和FEP相比对过氧化氢酶活力的促进作用分别有极显著差异(p<0.01)和高度显著差异(p<0.001),即FEP对损伤后HSF的过氧化氢酶活力有更强的促进作用。
2.3.5 WEP和FEP对HSF内CAT mRNA表达水平的影响
通过实时荧光定量PCR对过氧化氢酶mRNA的表达水平的分析,结果如图7所示,

图7 WEP和FEP对UVA诱导损伤的HSF内过氧化氢酶表达水平的影响Fig.7 The effect of WEP and FEP on the expression level of catalase in HSF with UVA-induced damage
由图7可知,空白对照组细胞内过氧化氢酶mRNA的表达水平高度显著于UVA诱导损伤的细胞。而样品组相比于UVA模型组,WEP和FEP对过氧化氢酶mRNA的表达水平的提升都有高度显著作用(p<0.001)。WEP和FEP对提升过氧化氢酶表达作用在浓度为1.0%时有显著差异(p<0.05),在浓度为2.0%时存在极显著差异(p<0.01),在浓度为0.5%时存在高度显著差异(p<0.001)。由此可知,FEP对提升过氧化氢酶表达的作用更强。
3 结论
本试验分别通过微生物发酵法和水提取法制得青刺果提取物FEP和WEP,FEP中总黄酮和总多酚的含量分别达到了(7.24±0.19)、(8.89±0.21)μg/mL,约为水提液含量的两倍左右。通过体外抗氧化和细胞试验表明WEP和FEP均具有较高的自由基清除能力,能提高氧化应激诱导的细胞存活率。通过细胞试验发现青刺果提取物也可以降低HSF内ROS水平和提高过氧化氢酶活性和mRNA的表达水平以增强损伤细胞的总抗氧化能力,修复UVA诱导的氧化应激损伤。但与WEP相比,FEP的抗氧化能力以及对UVA诱导损伤的HSF的修复能力更为显著。
