鱼藤素通过NF-κB/MAPK信号通路对幼鼠过敏性哮喘的抑制作用*
2021-12-21李超李敬风雷尚斌顾坚陈霞唐宋琪
李超 李敬风 雷尚斌 顾坚 陈霞 唐宋琪
(1.湖北省十堰市太和医院儿童医疗中心3病区,湖北 十堰 442000;2.海南医学院,海南 海口 571100)
过敏性哮喘是一种临床常见的慢性炎症性疾病,近年来,哮喘在儿童中的发病率逐年增加,对儿童的生活和学习带来严重影响[1-2]。目前,临床治疗儿童过敏性哮喘多采用传统西医疗法,虽然可以在一定程度上缓解患儿的病情和症状,但同时伴随着较多不良反应,复发率较高[3]。鱼藤素是一种天然异黄酮化合物,可从三叶鱼藤等豆科藤本植物中提取分离,能够抑制癌细胞增殖、侵袭和迁移,具有较强的细胞选择性和高效低毒的特点[4-5]。核因子κB(nuclear factor kappa-B,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路与哮喘的发生发展密切相关,抑制NF-κB/MAPK信号通路可改善哮喘小鼠的过敏性气道炎症反应[6]。研究证明,鱼藤素可通过下调NF-κB信号通路产生抗炎活性,从而减轻卵清蛋白(ovalbumin,OVA)诱导的小鼠哮喘[7]。虽已有研究证明鱼藤素具有确切的抗肿瘤作用和一定的抗哮喘作用,但其在儿童过敏性哮喘中的作用研究尚少,其作用机制尚不清楚。因此,本研究通过OVA致敏和激发在幼鼠中建立过敏性哮喘模型,观察鱼藤素对幼鼠过敏性哮喘的抑制作用,并初步探究其作用机制。
1 实验与方法
1.1 实验动物 BALB/c小鼠50只,雌雄各半,4周龄,体质量(14.5±0.2)g,购自北京维通利华实验动物技术有限公司。实验动物及饲养条件符合《实验动物管理条件》要求。饲养条件:室温(22±2)℃,湿度(50±10)%,每天定时换气,保持12 h:12 h光暗照明,食水不限。本研究方案获医院伦理委员会批准。
1.2 主要试剂与仪器 鱼藤素(纯度>95%,Sigma-Aldrich,批号:R8875),甲强龙(辉瑞公司,批号:AT8319),IgE、IL-1β、IL-13 ELISA试剂盒(武汉伊莱瑞特生物科技有限公司,批号:E-EL-M3034,E-EL-M0037c,E-EL-M0727c),p-NF-κB p65、p-IκBα、p-p38 MAPK、p-ERK1/2、p-JNK兔源单克隆抗体,羊抗兔二抗(美国CST公司,批号:8242,4812,8690,4370,4668,14708),RevertAidTMfirst Strand cDNA Synthesis Kit(美国Thermo Scientific,批号:K1622),蛋白定量试剂盒(博士德生物,批号:AR0146),OVA、瑞氏-姬姆萨复合染液、HE染色试剂盒(北京索莱宝科技有限公司,批号:A8041,G1020,G1121),压缩空气式雾化器(石家庄大桥医疗器械有限公司),MET VX200-T型涡旋振荡器[施锐(上海)贸易有限公司],DW-86L626超低温冰箱(海尔集团),DYCZ-24KS型双板垂直电泳仪(北京六一仪器厂),IX53显微镜(日本奥林巴斯),G:BOX多功能凝胶成像系统(Syngene),Multiskan MK3酶标仪(Thermo Fisher Scientific),TGL16MB高速冷冻离心机(长沙湘智离心机仪器有限公司)。
1.3 方法
1.3.1 分组与造模 将50只BALB/c小鼠随机分为正常组、模型组、甲强龙组、鱼藤素高剂量组、鱼藤素低剂量组,每组各10只。除正常组外,其余各组小鼠均建立过敏性哮喘模型。造模方法:分别在第1天和第14天对小鼠腹腔注射0.2 mL OVA致敏液(1 mg氢氧化铝和0.4 mg OVA溶于PBS缓冲液中)进行致敏,在第21~23天时将小鼠置于雾化器内,进行1% OVA溶液雾化吸入激发,每次30 min,每天1次,连续3 d。若小鼠出现呼吸频率升高、口唇发绀、点头呼吸和站立不稳等现象则表明造模成功,正常组采用PBS代替OVA致敏液进行致敏和雾化激发[8]。造模期间观察显示,模型组、甲强龙组、鱼藤素高剂量组、鱼藤素低剂量组小鼠均成功建立过敏性哮喘模型。
1.3.2 给药方法 造模第21天开始给药。雾化前1 h,鱼藤素高剂量组、鱼藤素低剂量组小鼠腹腔分别注射4 mg/kg、2 mg/kg 鱼藤素溶液(用DMSO溶解后采用生理盐水稀释至DMSO浓度小于0.1%),甲强龙组小鼠腹腔注射1 mg/kg甲强龙溶液,正常组和模型组小鼠腹腔注射等量生理盐水,每天1次,连续3 d(造模第21~23天)。
1.3.3 血浆和支气管肺泡灌洗液(BALF)收集 末次OVA雾化激发24 h后,各组小鼠摘眼球取血,与枸橼酸钠溶液混合均匀(血液与枸橼酸钠溶液的比例为9∶1),4℃环境下3 000 r/min离心10 min,离心半径为12.5 cm,收集上层血浆,分装在EP管中,置于-80℃冰箱中保存。取血完成后,打开小鼠颈部,分离气管,在气管上做一T形切口,插入静脉留置针,用PBS缓冲液冲洗3次,收集BALF,2500 r/min离心10 min,离心半径为12.5 cm,分别保存上清和沉淀备用。
1.3.4 ELISA试剂盒检测血浆总IgE和BALF中IL-1β、IL-13水平 取各组待测血浆和BALF上清加入到反应孔中,每孔100 μL,每组分别设4个复孔, 37℃孵育90 min,弃掉孔内液体,加入100 μL生物素化抗体工作液,37℃孵育60 min,弃掉孔内液体,洗涤3次,随后加入100 μL酶结合物工作液,37℃孵育30 min后弃掉孔内液体,洗涤5次,每孔加入90 μL底物溶液,37℃孵育15 min,加50 μL终止液,450 nm波长下检测,按照标准曲线计算各组大鼠血浆中总IgE和BALF中IL-1β、IL-13的含量。
1.3.5 BALF中炎性细胞分类计数 离心后的BALF沉淀用0.5 mL PBS缓冲液重悬,移液器吸取10 μL进行细胞计数,然后取50 μL细胞悬液涂片,自然干燥后滴加瑞氏-姬姆萨复合染液2~3滴使之覆盖到整个细胞涂片,染色1~2 min,然后滴加等量PBS缓冲液,轻轻晃动涂片,使之与瑞氏-吉姆萨染液混合均匀后再染色3~5 min,染色完毕后水洗,置于高倍镜下对细胞进行分类计数。
1.3.6 HE染色观察小鼠肺组织病理变化 取各组小鼠肺组织,置于4%多聚甲醛中固定48 h,蒸馏水清洗,然后置于不同浓度的酒精中进行梯度脱水,制作组织蜡块,冰上预冷切片,切片厚度为4 μm,二甲苯脱蜡30 min,在不同浓度梯度的乙醇溶液中复水,使用苏木精和伊红染液分别染细胞核和细胞质,脱水、透明后用中性树胶封片,置于显微镜下观察各组小鼠肺组织病理变化。
1.3.7 qRT-PCR检测小鼠肺组织IL-1β和IL-13 mRNA水平 称取0.1 g小鼠肺组织,冰上研磨,加1 mL Trizol裂解液提取组织总RNA,使用RevertAidTMfirst Strand cDNA Synthesis Kit逆转录试剂盒合成cDNA,作为荧光定量模版。引物由日本Takara 公司设计合成,所有样品均以GAPDH为内参。反应体系:dNTPs 0.5 μL+5×Buffer 5 μL+Taq 酶0.3 μL+MgCl21.5 μL+cDNA 模板2 μL +上下游引物分别1 μL,加去离子水至总体积25 μL。反应条件为:95℃预变性 5 min,95℃变性 30 s、62℃退火 30 s、72℃延伸 30 s,共40个循环,最后72℃延伸10 min,4℃再延伸 5 min终止反应,实验重复3次。采用2-△△CT的方法计算目的基因mRNA相对表达水平。引物序列见表1。

表1 基因引物序列
1.3.8 Western blot检测肺组织p-NF-κB p65、p-IκBα、p-p38 MAPK、p-ERK1/2、p-JNK蛋白表达水平 称取各组小鼠肺组织0.1 g,剪碎后置于研磨器中冰上研磨,离心后取沉淀,沉淀中加入RIPA裂解液处理组织匀浆,提取组织蛋白,BCA法蛋白定量,确定蛋白浓度,随后配置15%的分离胶和5%的浓缩胶进行SDS-PAGE电泳,上样后80 V电泳2 h,60 V转膜2 h,5%脱脂奶粉封闭2 h,将条带放入10 mL p-NF-κB p65、p-IκBα、p-p38 MAPK、p-ERK1/2、p-JNK兔源一抗稀释液中(抗体稀释比例均为1∶1 000),条带在一抗稀释液中4℃过夜,第2天用TBST缓冲液清洗3次,每次10 min,然后加入羊抗兔二抗(1∶1 000),37℃孵育2 h,TBST缓冲液清洗3次后滴加ECL发光液,反应1 min后置于凝胶成像系统显影。免疫印迹实验的内参蛋白为GAPDH,用Image J软件分析各个蛋白对应的灰度值,计算蛋白的相对表达量,蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值。
2 结果
2.1 各组小鼠血浆总IgE和BALF中IL-1β、IL-13水平比较 与正常组比较,模型组、甲强龙组、鱼藤素高剂量组、鱼藤素低剂量组小鼠血浆IgE和BALF中IL-1β、IL-13水平均显著升高(P<0.05);与模型组比较,甲强龙组、鱼藤素高剂量组、鱼藤素低剂量组小鼠血浆IgE和BALF中IL-1β、IL-13水平均降低(P<0.05);与甲强龙组比较,鱼藤素高剂量组、鱼藤素低剂量组小鼠血浆IgE和BALF中IL-1β、IL-13水平升高(P<0.05),其中,鱼藤素高剂量组小鼠血浆IgE和BALF中IL-1β、IL-13水平低于鱼藤素低剂量组(P<0.05),见表2。

表2 各组小鼠血浆总IgE和BALF中IL-1β、IL-13水平比较
2.2 各组小鼠BALF中炎性细胞数量比较 模型组、甲强龙组、鱼藤素高剂量组、鱼藤素低剂量组小鼠BALF中炎性细胞总数、中性粒细胞、嗜酸性粒细胞和淋巴细胞数量均高于正常组(P<0.05);与模型组比较,甲强龙组、鱼藤素高剂量组和低剂量组BALF炎性细胞总数、中性粒细胞、嗜酸性粒细胞和淋巴细胞数量均减少(P<0.05);鱼藤素高剂量组BALF炎性细胞总数、中性粒细胞、嗜酸性粒细胞和淋巴细胞数量与甲强龙组比较,差异无统计学意义(P>0.05),鱼藤素低剂量组BALF炎性细胞总数、中性粒细胞、嗜酸性粒细胞和淋巴细胞数量高于甲强龙组(P<0.05);鱼藤素高剂量组BALF炎性细胞总数、中性粒细胞、嗜酸性粒细胞和淋巴细胞数量低于鱼藤素低剂量组(P<0.05),见表3。

表3 各组小鼠BALF中炎性细胞数量比较
2.3 各组小鼠肺组织病理变化比较 HE染色结果显示,正常组小鼠肺组织中气道血管周围有少量炎性细胞存在;与正常组比较,模型组小鼠气道血管周围有大量的炎性细胞浸润,肺泡轮廓不清晰,肺泡壁增厚;与模型组比较,甲强龙组、鱼藤素高剂量组、鱼藤素低剂量组小鼠气道血管周围的炎症细胞浸润现象明显减轻,其中甲强龙组的炎症渗出减少最显著,鱼藤素高剂量组和低剂量组次之,与正常组比较,肺组织仍存在肺泡壁水肿、增厚和肺泡轮廓欠清晰现象,见图1。

图1 各组小鼠肺组织病理变化(400×)
2.4 各组小鼠肺组织IL-1β和IL-13 mRNA表达水平比较 与正常组比较,模型组、甲强龙组、鱼藤素高剂量组和低剂量组小鼠肺组织IL-1β和IL-13 mRNA表达水平均显著升高(P<0.05);与模型组比较,甲强龙组、鱼藤素高剂量组和低剂量组小鼠肺组织IL-1β和IL-13 mRNA表达水平降低(P<0.05);与甲强龙组比较,鱼藤素高剂量组和低剂量组小鼠肺组织IL-1β和IL-13 mRNA表达水平升高(P<0.05),其中,鱼藤素高剂量组小鼠肺组织IL-1β和IL-13 mRNA表达水平低于鱼藤素低剂量组(P<0.05),见表4。

表4 各组小鼠肺组织IL-1β和IL-13 mRNA表达水平比较
2.5 各组小鼠肺组织p-NF-κB p65、p-IκBα、p-p38 MAPK、p-ERK1/2、p-JNK蛋白表达水平比较 与正常组比较,模型组、甲强龙组、鱼藤素高剂量组和低剂量组小鼠肺组织p-NF-κB p65、p-IκBα、p-p38 MAPK、p-ERK1/2、p-JNK蛋白表达水平均显著升高(P<0.05);与模型组比较,甲强龙组、鱼藤素高剂量组和低剂量组p-NF-κB p65、p-IκBα、p-p38 MAPK、p-ERK1/2、p-JNK蛋白表达水平均降低(P<0.05);与甲强龙组比较,鱼藤素高剂量组p-NF-κB p65、p-IκBα、p-p38 MAPK、p-ERK1/2、p-JNK蛋白表达水平差异无统计学意义(P>0.05),鱼藤素低剂量组p-NF-κB p65、p-IκBα、p-p38 MAPK、p-ERK1/2、p-JNK蛋白表达水平升高(P<0.05);与鱼藤素高剂量组比较,鱼藤素低剂量组p-NF-κB p65、p-IκBα、p-p38 MAPK、p-ERK1/2、p-JNK蛋白表达水平升高(P<0.05),见图2、表5。
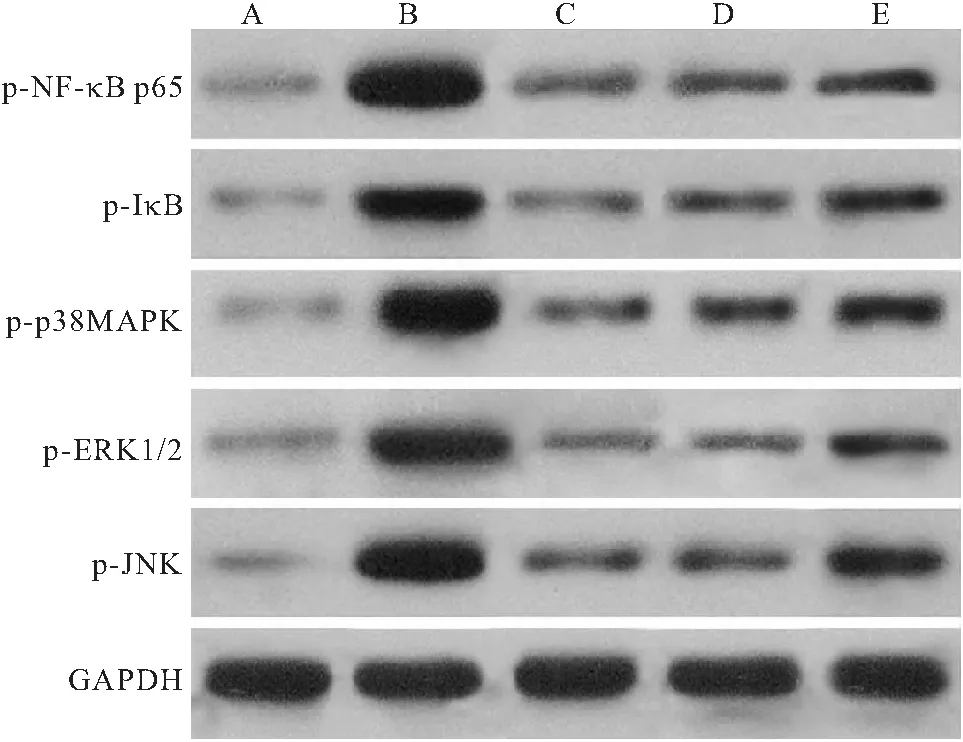
图2 Western blot法检测肺组织p-NF-κB p65、p-IκBα、p-p38 MAPK、p-ERK1/2、p-JNK蛋白表达

表5 各组小鼠肺组织p-NF-κB p65、p-IκBα、p-p38 MAPK、p-ERK1/2、p-JNK蛋白表达水平比较
3 讨论
过敏性哮喘是一种以气道高反应性、气道炎症和可逆的气道阻塞为主要特征的慢性呼吸系统疾病[9]。流行病学研究显示,全球5%~16%的人口患有过敏性哮喘,其中儿童患过敏性哮喘的比例正在逐年上升,严重影响儿童的成长、学习和生活[10]。鱼藤素是一种从植物中提取的天然异黄酮化合物,具有较强的抗肿瘤活性,同时能够减轻小鼠过敏性哮喘气道炎症,但其在儿童过敏性哮喘中的作用尚不清楚[11-12]。本研究采用OVA致敏和激发在幼鼠中建立过敏性哮喘模型,观察鱼藤素对幼鼠过敏性哮喘的作用,探究其作用机制。
IgE是介导Ⅰ型变态反应的抗体,其升高与过敏性疾病的发生密切相关[13]。IL-1β和IL-13等炎性因子能够刺激中性粒细胞、嗜酸性粒细胞等炎性细胞向气道聚集,增加气道黏液分泌和气道重塑[14-15]。本研究发现,OVA致敏和雾化吸入激发可使小鼠血浆IgE和BALF中IL-1β、IL-13水平显著升高。与模型组比较,高剂量和低剂量鱼藤素可使小鼠血浆IgE和BALF中IL-1β、IL-13水平降低,其中,鱼藤素高剂量组小鼠血浆IgE和BALF中IL-1β、IL-13水平低于鱼藤素低剂量组,略高于甲强龙组。qRT-PCR检测结果与上述结果一致,甲强龙、高剂量和低剂量鱼藤素均可使小鼠肺组织IL-1β和IL-13 mRNA表达水平降低,但与甲强龙组比较,鱼藤素高剂量组和低剂量组IL-1β和IL-13 mRNA表达增加,表明鱼藤素能够减轻哮喘小鼠过敏性和炎性反应。
炎症是过敏性哮喘的典型病理特点,过敏性哮喘的不同阶段均有中性粒细胞、嗜酸性粒细胞和淋巴细胞等炎症细胞在肺组织的浸润和聚集,此类细胞又可以分泌多种炎症细胞因子,对过敏性哮喘气道病变有重要作用[16-17]。本研究发现,模型组、甲强龙组、鱼藤素高剂量组和低剂量组小鼠BALF炎性细胞总数、中性粒细胞、嗜酸性粒细胞和淋巴细胞数量均高于正常组。与模型组比较,高剂量和低剂量鱼藤素均减少BALF炎性细胞总数、中性粒细胞、嗜酸性粒细胞和淋巴细胞数量,其中高剂量鱼藤素的作用与甲强龙组相当。HE染色结果显示,模型组小鼠气道血管周围有大量的炎性细胞浸润,肺泡轮廓不清晰,肺泡壁异常增厚,而甲强龙和鱼藤素可改善OVA所致的炎症细胞浸润和肺泡壁增厚水肿现象,其中甲强龙组的炎症渗出减少最显著,鱼藤素高剂量组和低剂量组次之,表明鱼藤素可减轻过敏性哮喘小鼠肺组织病理改变,抑制炎症细胞浸润。
NF-κB和MAPK信号通路在哮喘发生发展中发挥重要作用。研究表明,NF-κB信号通路在炎症和免疫反应中均存在大量的基因表达,当被细胞因子、活性氧等刺激后,可诱导IκB从p50和p65二聚体解离并发生磷酸化,从而促进过敏性哮喘中的炎症反应[18-19]。MAPK信号通路在多种疾病中普遍表达,几乎涉及到哮喘炎症网络的所有方面,是哮喘治疗的潜在靶标,抑制MAPK信号通路中的三种主要激酶ERK1/2、JNK和p38 MAPK的活化可显著改善哮喘炎症反应和气道重塑[20-22]。本研究结果显示,与模型组比较,甲强龙、高剂量和低剂量鱼藤素可使小鼠肺组织p-NF-κB p65、p-IκBα、p-p38 MAPK、p-ERK1/2、p-JNK蛋白表达降低,其中,鱼藤素高剂量组p-NF-κB p65、p-IκBα、p-p38 MAPK、p-ERK1/2、p-JNK蛋白表达水平低于鱼藤素低剂量组,与甲强龙组蛋白表达水平相当,表明鱼藤素可抑制过敏性哮喘小鼠肺组织NF-κB/MAPK信号通路相关蛋白的活化。
4 结论
鱼藤素能够减少哮喘小鼠血浆IgE,降低BALF和肺组织炎症因子IL-1β、IL-13表达,改善肺组织病变并抑制炎症细胞浸润,其作用机制与抑制NF-κB/MAPK信号通路相关蛋白的活化有关。
