LncRNA MIR4435-1HG对胃癌细胞生物学特性的影响
2021-12-21边康麒费素娟李莉
边康麒 费素娟 李莉
(徐州医科大学附属医院消化内科,江苏 徐州 221000)
近年来肿瘤的治疗技术显著提高,明显改善了患者的预后及生存率,但胃癌患者的5年生存率仍然较低[1]。虽然有大量的研究探究了胃癌的临床诊断方法以及化疗药物,但胃癌患者依然存在预后较差、复发率高等问题[2]。胃癌细胞的恶性增殖以及侵袭、迁移能力的增强是导致患者肿瘤组织生长、转移的主要原因,也是患者死亡率较高的主要诱导因素[3]。因此,探究胃癌细胞增殖、侵袭、转移的分子机制对改善患者的生活质量,提高预后存活率具有重要的意义。长链非编码RNA(long chain non-coding RNA, LncRNA)是一类非编码蛋白的RNA,可通过介导下游靶基因的沉默或激活,参与肿瘤细胞的增殖、侵袭、迁移等生物学过程[4-6]。LncRNA MIR4435-1HG 位于人染色体2q13,目前其对胃癌细胞恶性生物学行为的影响和机制还未知。因此,本文通过下调LncRNA MIR4435-1HG的表达量,观察其对胃癌细胞增殖、凋亡、侵袭、迁移的影响,为胃癌的靶向分子诊断以及新药物的研发提供实验依据。
1 材料与方法
1.1 实验主要材料 人胃癌细胞系(MGC-803、MKN45、AGS)以及胃黏膜上皮细胞GES-1购自美国生物标准品收藏中心公司,胎牛血清、RPMI-1640、DMEM培养基、F-12K培养基购自杭州四季青生物工程有限公司,Trizol试剂、Lipofectamine 2000、荧光定量PCR(Quantitative polymerase chain reaction, qPCR)试剂盒、凋亡试剂盒购自美国Invitrogen公司,细胞计数试剂盒(Cell Counting Kit-8, CCK-8)购自日本株式会社同仁化学研究所,MIR4435-1HG-wt、MIR4435-1HG-mut双荧光素酶报告载体购自上海吉凯基因公司,Mataigel胶购自美国BD公司,Transwell小室购自美国Corning公司。
1.2 实验方法
1.2.1 细胞的培养 GES-1、MGC-803细胞培养于DMEM培养基,MKN45细胞培养于RPMI-1640培养基,AGS细胞培养于F-12K培养基,各培养基中均含有10%胎牛血清,置于5%CO2、37℃、饱和湿度的细胞培养箱中,每2~3 d换液,加入胰酶传代(1∶3)。
1.2.2 细胞的转染 选取对数期AGS细胞,分为对照组、siRNA-NC组、siRNA-MIR4435-1HG组。对照组AGS细胞常规培养,siRNA-NC组、siRNA-MIR4435-1HG组根据Lipofectamine 2000说明书的指示将siRNA NC和siRNA MIR4435-1HG质粒转染入AGS细胞,继续培养24 h。siRNA-MIR4435-1HG(5′-CACCGTTCTCCGAACGTGTCACGTCAAGA GATTACGTGACACGTTCGGAGAATTTTTTG-3′)、siRNA-NC(5′-CACCGCCCAGATTTAAGGGCTAT TTCAAGAGAATAGCCCTTAAATCTGGGCCTTT TTTG-3′)质粒合成于上海吉玛生物科技有限公司。
1.2.3 qPCR实验检测LncRNA MIR4435-1HG表达量 加入Trizol试剂提取各组AGS细胞总RNA,在反转录试剂的诱导下合成cDNA。LncRNA MIR4435-1HG、miR-150-5p、U6引物均合成于上海生工公司,见表1。以U6为内参,进行荧光定量PCR,扩增条件为95℃ 10 min,95℃ 20 s,59℃ 30 s,35个循环,2-ΔΔCt法计算LncRNA MIR4435-1HG表达量。

表1 引物序列
1.2.4 CCK-8检测各组AGS细胞吸光值 收集对照组、siRNA-NC组、siRNA-MIR4435-1HG组AGS细胞,接种至96孔板(1×104个/孔),5%CO2、37℃分别培养24、48、72 h,每孔加入10 μL CCK-8,继续培养2.5 h,酶标仪检测450 nm下AGS细胞吸光值(OD值)。
1.2.5 流式细胞术检测各组凋亡率 在凋亡试剂盒说明书的指示下,将对照组、siRNA-NC组、siRNA-MIR4435-1HG组AGS细胞密度调整为1×106/mL,培养24 h,每孔加入10 μL 磷脂酰结合蛋白V-FITC和5 μL 碘化丙啶,4℃染色15 min,置于流式细胞仪上分析凋亡率。
1.2.6 细胞划痕实验检测划痕愈合率 分别收集2×105个对照组、siRNA-NC组、siRNA-MIR4435-1HG组AGS细胞,接种至6孔板,5%CO2、37℃培养24 h,待细胞密度为80%~90%,通过一次性吸头在培养板中划线,记录0、24 h划痕宽度,计算划痕愈合率。划痕愈合率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.2.7 Transwell实验检测各组迁移能力 将Mataigel胶与无血清培养基1∶8混合,吸取50 μL Mataigel胶稀释液加入Transwell上室膜,37℃静置2 h,凝固后备用。收集各组转染24 h AGS细胞,更换为无血清培养基,吸取200 μL(5×105个/mL) AGS细胞悬液加入Transwell上室中,下室加入600 μL含10%胎牛血清的培养基,37℃孵育24 h,棉签去除残留AGS细胞,4%多聚甲醛固定30 min,0.1%结晶紫染色30 min,显微镜下计数。
1.2.8 双荧光素酶报告基因 在线数据库DIANA-LncBase v2(http://www.microrna.gr/LncBase)预测LncRNA MIR4435-1HG与微小RNA-150-5p(micro RNA-150-5p,miR-150-5p)的靶向关系。MIR4435-1HG-wt为野生型双荧光素酶报告载体,含有与miR-150-5p靶向结合的位点;MIR4435-1HG-mut为突变型双荧光素酶报告载体,不含与miR-150-5p靶向结合的位点;将MIR4435-1HG-wt和MIR4435-1HG-mut分别与过表达miR-150-5p、miR-NC质粒共转染,测定AGS细胞中荧光素酶的相对活性。
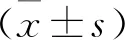
2 结果
2.1 LncRNA MIR4435-1HG在细胞系中的表达量 与胃黏膜上皮细胞GES-1相比,LncRNA MIR4435-1 HG在MGC-803、AGS、MKN45细胞系中的表达量上调,差异具有统计学意义(P<0.05),见表2。其中在AGS细胞中的表达量相对较高,因此作为后续研究对象。

表2 LncRNA MIR4435-1HG在胃癌细胞系中的表达量
2.2 转染后AGS细胞中LncRNA MIR4435-1HG表达量的变化 siRNA-NC组AGS细胞中LncRNA MIR4435-1HG表达量与对照组相比差异无统计学意义(P>0.05),但siRNA-MIR4435-1HG组AGS细胞中LncRNA MIR4435-1HG表达量降低,差异具有统计学意义(P<0.05),见表3。

表3 转染后AGS细胞中LncRNA MIR4435-1HG表达量的变化
2.3 下调LncRNA MIR4435-1HG对AGS细胞增殖、凋亡的影响 siRNA-NC组AGS细胞增殖与对照组相比差异无统计学意义(P>0.05),但siRNA-MIR4435-1HG组AGS细胞增殖在24 h差异不显著,在48、72 h增殖明显降低,差异具有统计学意义(P<0.05),见表4。siRNA-NC组AGS细胞与对照组凋亡率比较差异无统计学意义(P>0.05),但siRNA-MIR4435-1HG组细胞凋亡率明显增加(P<0.05),见图1。

表4 下调LncRNA MIR4435-1HG对AGS细胞增殖的影响

图1 下调LncRNA MIR4435-1HG对AGS细胞凋亡的影响
2.4 下调LncRNA MIR4435-1HG对AGS细胞侵袭、迁移的影响 siRNA-NC组AGS细胞划痕愈合率、侵袭细胞数与对照组相比差异无统计学意义(P>0.05),但siRNA-MIR4435-1HG组AGS细胞划痕愈合率、侵袭细胞数明显降低,差异具有统计学意义(P<0.05),见表5、图2~3。

表5 下调LncRNA MIR4435-1HG对AGS细胞侵袭、迁移的影响

图2 下调LncRNA MIR4435-1HG对AGS细胞划痕愈合率的影响

图3 下调LncRNA MIR4435-1HG对AGS细胞侵袭的影响
2.5 靶基因的预测和验证 在线软件DIANA-LncBase v2预测LncRNA MIR4435-1HG的下游靶基因结果显示,LncRNA MIR4435-1HG基因3′端非翻译区域可特异性结合于miR-150-5p,见图4。双荧光素酶验证报告进一步验证结果显示,上调miR-150-5p与MIR4435-1HG-wt共转染较miR-NC组与MIR4435-1HG-wt共转染降低AGS细胞荧光素酶活性(P<0.05);但上调miR-150-5p与MIR4435-1HG-mut共转染对AGS细胞荧光素酶相对活性无明显影响,见表6。

图4 LncRNA MIR4435-1HG与miR-150-5p结合位点

表6 双荧光素酶活性检测结果
3 讨论
胃癌的病理进程与多种病因相关,如吸烟、遗传因素、饮食习惯等均可诱导胃癌的发生、发展[7]。胃癌患者约95%为腺癌,早发现、早治疗是临床治疗胃癌最有效的方法,但由于早期诊断方法的局限性,导致大部分患者确诊时已是晚期或已发生转移[8]。因此明确胃癌的发生、发展分子机制对临床探究特异性的分子诊断物尤为重要。
LncRNA是一类长度超过200个核苷酸的小分子非编码RNA,参与肿瘤的发生、发展过程[9]。LncRNA MIR4435-1HG是近年来发现的一种非编码RNA,在多种肿瘤中发挥调控作用。研究[10]表明,LncRNA MIR4435-1HG在肾癌中表达升高,其高表达与TNM分期、肿瘤大小和Fuhrman等级及患者预后密切相关,敲低其表达可抑制肾癌细胞增殖、迁移和侵袭。LncRNA MIR4435-1HG在口腔癌组织中表达上调,其高表达的患者总生存期和无复发生存期相对较短[11]。但目前,LncRNA MIR4435-1HG对胃癌发生、发展的影响还未知。本研究显示,LncRNA MIR4435-1HG在胃癌细胞系中的表达量明显上调,进一步下调LncRNA MIR4435-1HG的表达量发现,降低LncRNA MIR4435-1HG的水平抑制了胃癌AGS细胞增殖、侵袭和迁移,且诱导其凋亡,提示LncRNA MIR4435-1HG在胃癌中也发挥促癌基因作用,促进胃癌的发展进程,其可能是胃癌治疗的潜在分子靶点。
LncRNA可作为竞争性内源性RNA与miRNA靶向结合,调控其靶基因的表达,进而影响疾病的发展进程[12-13]。miRNA也是一类广泛存在于真核生物中的小分子非编码RNA,其长度为18~25个核苷酸,在肿瘤的病理进程中发挥重要调节作用[14-16]。miR-150-5p在骨肉瘤[17]、肺鳞癌[18]、胶质瘤[19]、结肠癌[20]和黑色素瘤[21]等多种肿瘤组织中表达下调,上调其表达抑制了肿瘤细胞的增殖、侵袭等恶性行为;而在乳腺癌[22]、宫颈癌[23]等肿瘤中表达升高,发挥促癌基因作用。为进一步探究LncRNA MIR4435-1HG调节胃癌细胞增殖、侵袭的作用机制,本实验通过在线数据库预测LncRNA MIR4435-1HG的下游靶miRNA结果显示,miR-150-5p可能是LncRNA MIR4435-1HG的靶基因,进一步通过双荧光素酶报告基因实验证实了这一结果,提示LncRNA MIR4435-1HG可能通过靶向调控miR-150-5p促进AGS细胞增殖、侵袭、迁移。当然,本研究尚存在一些不足,如缺乏动物模型、临床样本等研究数据以及LncRNA MIR4435-1HG靶向调节miR-150-5p的分子机制尚不十分清楚,均需进一步深入研究。
4 结论
LncRNA MIR4435-1HG在多种胃癌细胞系中表达量上调;下调LncRNA MIR4435-1HG抑制AGS细胞增殖、侵袭、迁移,诱导凋亡,可能通过靶向调控miR-150-5p发挥作用,为胃癌的早期诊断、治疗提供了基础实验。
