罗哌卡因诱导子宫内膜癌生长阻滞和氧化损伤*
2021-12-21何花丽朱明霞赵小娟单兆亚任天彤
何花丽 朱明霞 赵小娟 单兆亚 任天彤
(1.陕西中医药大学附属医院,陕西 咸阳 712000;2.西安市第四医院,陕西 西安 710004)
子宫内膜癌是子宫癌的一种,属于子宫内膜上皮恶性肿瘤,最常见的子宫癌是子宫内膜腺源性腺癌,占75%~80%[1-2]。约67%的宫内膜癌患者处于早期阶段,约21%局部扩散到盆腔淋巴结和周围器官,约8%发生远处转移[3]。迄今为止,子宫内膜癌的主要治疗方法是手术,然后是辅助放疗和化学疗法[4-5]。 但这些疗法并未有效降低子宫内膜癌死亡的风险,术后2~3年,子宫内膜癌的复发率高于60%~80%[6]。目前,越来越多的研究表明麻醉药和麻醉技术对术后复发有益,并且可以提高各种癌症的存活率[7-8]。罗哌卡因是一种酰胺连接的局部麻醉药,可通过阻断电压门控钠通道(voltage-gated sodium channel,VGSC)流入阻止轴突中传播的动作电位的产生[9]。VGSC在癌细胞中功能上过表达,并参与局部麻醉药的抗癌活性[10]。据报道,罗哌卡因在多种类型的癌症中会抑制其生长、迁移和存活[11]。罗哌卡因在癌细胞中作用的分子机制似乎是癌症特异性的,包括上调活性氧(Reactive oxygen species,ROS)和激活的促丝裂原激活的蛋白激酶(Mitogen-activated protein kinase,MAPK)途径,抑制Src活性,阻断磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/AKT/雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR) 和粘着斑激酶信号途径[11-13]。研究表明,罗哌卡因抑制长链非编码RNA(long noncoding RNA,lncRNA) THRIL 对子宫内膜癌细胞增殖、细胞周期和迁移[14]。但是罗哌卡因对子宫内膜癌细胞的微管形成和氧化损伤尚不清楚。
1 材料与方法
1.1 细胞培养及处理 HEC-1B和Ishikawa 细胞购于中国科学院细胞库,并用含10%胎牛血清的Dulbecco改良的Eagle培养基(Dulbecco's Modified Eagle Medium,DMEM)培养于37℃培养箱。
1.2 CCK-8法检测细胞活性 在96孔板中,将HEC-1B和Ishikawa细胞分别用不同浓度罗哌卡因(0.1、0.5和1 mM)处理24、48、72 h时,然后向每孔加入10 μL CCK-8 溶液。最后用酶免疫分析仪在450 nm处测量吸光度。各浓度处理组细胞的吸光度与0.15 mmol/L组细胞的吸光度的比值表示细胞活性。
1.3 Western blot检测蛋白水平 HEC-1B和Ishikawa细胞处理后,裂解缓冲液裂解细胞,然后在4℃并以14000 rpm离心15 min,浓缩蛋白质。蛋白质浓度由BCA蛋白定量检测盒(上海碧云天生物有限公司)进行测量。取20 μg总蛋白在12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)并转移至聚偏二氟乙烯(PVDF)膜。将膜在37℃下用1 h封闭5%的牛血清白蛋白,然后与抗E-cadherin、Vimentin和VEGF在4℃过夜。用TTBS洗涤后缓冲液[含0.5 mL Tween-20(sigma, USA)的Tris缓冲盐水],加入辣根过氧化物酶标记的山羊抗兔IgG(二抗)37℃反应1 h;洗膜后ECL曝光成像并应用quantity one(Bio-Rad, San Francisco, California,USA)软件分析蛋白条带的灰度值。
1.4 克隆形成实验检测细胞增殖率 将HEC-1B和Ishikawa 细胞用1 mM罗哌卡因处理,用冷的甲醇-冰醋酸固定HEC-1B和Ishikawa细胞,并用结晶紫染色。
1.5 流式细胞术检测细胞的凋亡率 流式细胞仪检测HEC-1B和Ishikawa细胞凋亡,采用Annexin v-荧光素(AV)和碘化丙啶(PI)细胞凋亡检测试剂盒 (Invitrogen, Carlsbad, CA, USA)流式细胞术检测不同处理HEC-1B和Ishikawa细胞的凋亡率。刺激后,用PBS洗涤细胞,10 L Annexin V-FITC和5 L PI在室温黑暗中孵育15 min。流式细胞术使用FACScan流式细胞仪(Beckman Coulter, Fullerton, CA, USA)进行流式分析,数据使用FlowJo软件 (Tree Star, Ashland, OR, USA) 进行分析。
1.6 Transwall试验检测细胞的侵袭数量 用不含血清的DMEM将接种5×104/200 μL HEC-1B和Ishikawa细胞在Transwell室上部。 下腔室充满500 μL 10%FBS EMEM。孵育24 h后,将下腔室中的细胞固定在95%乙醇中,然后用苏木精染色。在倒置显微镜下计算细胞的侵袭数量。
1.7 微管形成试验观察微管样结构形式情况 将 Matrigel 人工基质胶稀释后平铺于 24 孔板的孔底,5×104/ 200 μL HEC-1B和Ishikawa细胞接种于24孔板,常规培养16 h,每隔 4 h 观察微管样结构形成情况。用倒置显微镜下随机拍照(100×),采用 Microvision Saisam 软件分析微管形成结节数。
1.8 试剂盒检测细胞ROS、8-OHdG、ATP和线粒体超氧化物的表达水平 用药物处理1×104/孔的细胞24 h。 根据制造商的说明书,使用ATPlite发光测定试剂盒(美国Perkin Elmer)测量ATP水平。 ROS使用CM-H2DCFDA(美国利弗技术公司)检测含量。 将细胞与10 μM CMH2DCFDA(Life Technologies,US)在37℃孵育1 h。 使用Spectramax M5酶标仪在ex/em为495/525 nm下测量吸光度。 使用DNEasy Mini Kit(Qiagen)提取DNA。 按照制造商的规程,使用OxiSelect氧化性DNA损伤ELISA试剂盒(Cell Biolabs)对8-OHdG进行了定量。 在Spectramax M5上读取吸光度酶标仪在450 nm。
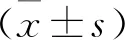
2 结果
2.1 罗哌卡因对HEC-1B和Ishikawa 细胞活性的影响 随着罗哌卡因浓度的增加,HEC-1B和Ishikawa 细胞活性明显下降;随着培养时间增加,HEC-1B和Ishikawa细胞活性逐渐下降,见图1。我们选择药物浓度1 mM,作用时间48 h作后续实验。

图1 罗哌卡因对HEC-1B和Ishikawa 细胞活性的影响
2.2 罗哌卡因对HEC-1B和Ishikawa 细胞增殖和凋亡的影响 细胞克隆形成试验结果表明,与对照组相比,罗哌卡因药物处理HEC-1B和Ishikawa 细胞后,HEC-1B和Ishikawa 细胞增殖降低(P<0.01)。流式细胞术结果表明,与对照组相比,罗哌卡因药物处理HEC-1B和Ishikawa 细胞后,HEC-1B和Ishikawa 细胞凋亡增加(P<0.01),见图2。

图2 罗哌卡因对HEC-1B和Ishikawa 细胞增殖和凋亡的影响
2.3 罗哌卡因对HEC-1B和Ishikawa 细胞侵袭的影响 Transwall试验检测HEC-1B和Ishikawa细胞的侵袭结果表明,与对照组相比,罗哌卡因药物处理HEC-1B和Ishikawa 细胞后,HEC-1B和Ishikawa 细胞侵袭降低(P<0.01),见图3A。Western blot 检测相关侵袭相关蛋白的表达量,与对照组相比,E-cadherin蛋白表达量显著上调,而Vimentin蛋白表达量显著下调在HEC-1B和Ishikawa 细胞(P<0.05),见图3B。

图3 罗哌卡因对HEC-1B和Ishikawa 细胞侵袭的影响
2.4 罗哌卡因对HEC-1B和Ishikawa 细胞微管形成的影响 微管形成试验检测结果表明检测HEC-1B和Ishikawa细胞微管形成结果表明,与对照组相比,罗哌卡因药物处理HEC-1B和Ishikawa 细胞后,HEC-1B和Ishikawa 细胞微管形成数降低(P<0.01),见图4A。Western blot 检测相关细胞微管形成相关蛋白的表达量,与对照组相比,VEGF蛋白表达量显著下调在HEC-1B和Ishikawa 细胞(P<0.05),见图4B。

图4 罗哌卡因对HEC-1B和Ishikawa细胞微管形成的影响
2.5 罗哌卡因对HEC-1B和Ishikawa 细胞氧化损伤的影响 试剂盒检测HEC-1B和Ishikawa细胞中ROS、8-OHdG、ATP和线粒体超氧化物的表达水平。结果表明,与对照组相比,罗哌卡因药物处理HEC-1B和Ishikawa 细胞后,HEC-1B和Ishikawa细胞中ROS、 8-OHdG 和线粒体超氧化物的表达水平显著增加,ATP的表达水平显著降低(P<0.05),见图5。

图5 罗哌卡因对HEC-1B和Ishikawa 细胞氧化损伤的影响
3 讨论
有研究表明,局麻药在减少癌症复发和改善癌症患者整体生存中的有益作用可能是由于其对癌细胞的直接抑制作用[15];其可影响患者围术期、预后及术后转移和复发,还与肿瘤患者免疫功能相关[16-17]。临床前研究表明,局部麻醉药通过抑制癌细胞功能的多个方面,如生长、存活、迁移和侵袭等对癌细胞具有活性[18-19]。研究报道罗哌卡因显著降低了原发性和转移性结肠癌细胞的活力[20]。罗哌卡因切口局部浸润麻醉联合静脉自控镇痛(PCIA)对肝癌肝切除术患者术后镇痛效果明显,缩短住院时间,加速术后康复,同时不加重肝肾功能的损伤,安全性较好[21]。
罗哌卡因通过调控miR-520a-3p的表达,进而抑制胃癌细胞的生长、迁移和侵袭,并进一步抑制WEE1和PI3K/AKT信号通路[22]。罗哌卡因通过调节整合素 α2 (integrin α-2 ,ITGA2)的表达来抑制甲状腺乳头状癌细胞的增殖、侵袭、迁移和促进细胞凋亡[23]。本研究结果显示,与对照组相比,罗哌卡因药物处理HEC-1B和Ishikawa 细胞后,HEC-1B和Ishikawa 细胞增殖降低 ,而HEC-1B和Ishikawa 细胞凋亡增加,与李福祥[14]研究一致。
E-cadherin是一种单通道跨膜蛋白,介导同性细胞和细胞间的相互作用。E-cadherin介导的细胞-细胞粘附和整合素介导的周围细胞外基质(extracellular matrix,ECM)接触的粘附有协调调节,而这些信号调节癌细胞定向迁移和侵袭[24]。波形蛋白(Vimentin)是中间纤维蛋白家族的主要组成部分,在正常间质细胞中广泛表达,并被认为能够维持细胞的完整性和抵抗应激。波形蛋白在各种上皮性癌症中过度表达,包括前列腺癌、宫颈癌、胃肠道肿瘤、中枢神经系统肿瘤、乳腺癌、恶性黑色素瘤和肺癌。波形蛋白在肿瘤中的过表达与肿瘤生长、侵袭和预后不良密切相关[25]。在本研究中,与对照组相比,罗哌卡因药物处理HEC-1B和Ishikawa 细胞后,HEC-1B和Ishikawa 细胞侵袭降低。与对照组相比,E-cadherin蛋白表达量显著上调,而Vimentin蛋白表达量显著下调在HEC-1B和Ishikawa 细胞,与李福祥[14]的研究一致。
血管内皮生长因子(Vascular endothelial growth factor ,VEGF)是一种同型二聚糖蛋白,分子量约为45 kDa,是新血管形成的关键介质,并与两个VEGF receptor-1和VEGF receptor-2结合,在血管内皮细胞上表达。在健康人群中,VEGF促进胚胎发育中的血管生成,并在成人的伤口愈合中发挥重要作用。VEGF是癌症血管生成的关键介质,在肿瘤中其受到癌基因表达、多种生长因子和缺氧的影响而上调[26]。研究表明,联合检测生长抑素受体(somatostatin receptor,SSTR)和VEGF对子宫内膜癌预后的评估有一定临床意义[27]。反复给予罗哌卡因和罗哌卡因负载脂质体和能量限制可通过降低晚期癌痛小鼠VEGF-A水平而持续缓解癌痛[28]。在本研究中,与对照组相比,罗哌卡因药物处理HEC-1B和Ishikawa 细胞后,HEC-1B和Ishikawa 细胞微管形成数降低。与对照组相比,VEGF蛋白表达量显著下调在HEC-1B和Ishikawa 细胞。
研究表明罗哌卡因促进ROS和8-OHdG的产生,且其通过钠通道无关的线粒体功能障碍和氧化应激抑制肿瘤血管生成[29]。罗哌卡因促进线粒体超氧化物的表达水平,抑制ATP的表达水平,且罗哌卡因通过干扰线粒体功能对乳腺癌有抑制作用[30]。在本研究中,与对照组相比,罗哌卡因药物处理HEC-1B和Ishikawa 细胞后,HEC-1B和Ishikawa细胞中ROS、 8-OHdG 和线粒体超氧化物的表达水平显著增加,ATP的表达水平显著降低。
4 结论
罗哌卡因抑制HEC-1B和Ishikawa 细胞增殖,侵袭及微管形成,并促进细胞凋亡和氧化损伤,为子宫内膜癌的治疗提供临床依据。
