糖苷结构对苦荞黄酮促进葡萄糖在C2C12小鼠骨骼肌细胞中摄取作用的影响
2021-12-16吴伟菁吴兰兰马国宇
吴伟菁,仇 菊 ,吴兰兰,朱 宏,马国宇,谢 文
(1.厦门医学院,福建厦门 361023;2.天然化妆品福建省高校工程研究中心,福建厦门 361023;3.福建省食品微生物与酶工程重点实验室,福建厦门 361018;4.农业农村部食物与营养发展研究所,北京 100081)
苦荞 (Fagopyrum tataricum) 富含黄酮类物质,含量为6.65~22.27 mg/g,其中芦丁占90%以上[1-2]。虽然,苦荞中的黄酮以芦丁为主[3-4]。由于苦荞含有芦丁降解酶,芦丁降解酶遇水可立即将苦荞中的双糖苷结构的黄酮-芦丁降解为黄酮前体-槲皮素[5]。通过提前热处理进行灭酶,能够保护苦荞中的芦丁不被降解[6]。因此,不同加工顺序会对苦荞黄酮类化合物的组成产生影响[6]。另外,苦荞黄酮提取物通过添加柚苷酶、高压并加入α-L-鼠李糖苷酶,可将芦丁转化为单糖苷结构的黄酮-异槲皮素[7-8]。因此,对比苦荞中芦丁及降解产物之间的活性[2](三者的结构如图1),有助于阐明不同加工方式对苦荞黄酮的营养成分保持及功效活性的影响,进而选择合适的苦荞加工技术[9]。

图1 槲皮素(Q)、异槲皮素(I)及芦丁(R)的结构Fig.1 Structure of quercetin(Q), isoquercetin(I) and rutin(R)
不同糖苷结构的苦荞黄酮具有不同的生物活性。芦丁及其降解产物(异槲皮素及槲皮素)具有抑制碳水化合物消化酶的作用[10-12],槲皮素比芦丁和异槲皮素具有更高的抑制活性。但在一定的浓度范围内,芦丁和异槲皮素则无显著性差异[11]。也有研究表明,槲皮素能够直接被大鼠肠道吸收,而带有糖苷结构的异槲皮素和芦丁吸收利用率较低[13]。苦荞的芦丁和槲皮素也具有调节脂代谢的作用,且槲皮素为主要的生物效应结构单元[14]。但也有研究发现芦丁抑制肥胖的效果显著高于槲皮素[15]。同时,苦荞黄酮提取物具有降血糖作用[7,16-21]。从苦荞食品加工的角度来看,不同加工技术促使苦荞芦丁不同程度的转化为槲皮素,槲皮素的苦味可令产品口感受到影响,这促使苦荞脱苦、抑制芦丁转化为槲皮素成为部分企业倾向于选择的加工技术。然而,芦丁与其前体或降解产物之间的转化,对苦荞黄酮功效活性的影响却没有直接报道,更缺乏关于细胞水平上作用机制的差异报道。因此,研究芦丁及其降解产物的降血糖效果不仅有助于进一步揭示苦荞黄酮的降血糖机制,而且能为苦荞黄酮生物活性保持的加工技术提供理论依据。本研究采用高效液相串联质谱,对苦荞中的黄酮类化合物进行分析定量。同时基于C2C12小鼠骨骼肌细胞,从细胞水平上比较芦丁、槲皮素、异槲皮素这三类含有不同糖苷结构的黄酮对于葡萄糖摄取的效果,并从分子水平上阐明其作用机制的差异。
1 材料与方法
1.1 材料与仪器
苦荞粉(西荞2号) 国家燕麦荞麦产业技术体系凉山综合试验站;芦丁、槲皮素、异槲皮素标准品
中检所;DMEM(Dulbecco’s Modified Eagle Medium)细胞培养基及双抗 Hycolne公司;胎牛血清、双抗 澳洲康宁公司;马血清 Gibco公司;2-NBDG荧光葡萄糖(2-[N-(7-硝基苯-2-氧杂-1,3-二唑-4-基)氨基 ]-2-脱氧 D-葡萄糖) 美国 Thermo-fisher公司;胰岛素注射液(40 IU/mL, 255 μmol/L) 万邦医药公司;30%丙烯酰胺和甲叉双丙烯酰胺溶液(29:1)储备液、牛血清白蛋白V 北京拜尔迪生物科技有限公司;RIPA(Radio-Immunoprecipitation assay)裂解缓冲液 索莱宝科技公司;一抗(Insulin receptor substract-1(IRS-1)、AKT、phospho-AKT(p-AKT)、AMP-activated protein kinase(AMPK)、 phospho-AMPK (p-AMPK)、acetyl-CoA carboxylase (ACC)、phospho-ACC (p-ACC)、β-actin等),二抗(鼠抗IgG及兔抗IgG) 美国Cell signal Technology公司;ECL(Enhanced chemiluminescence)发光液、PVDF(polyvinylidene fluoride)膜 美国密理博公司;BCA蛋白含量测定试剂盒 美国Bigma公司;小鼠C2C12骨骼肌细胞(ATCC号:CRL-1772™) 中国科学院细胞库;其余药品 均为分析纯。
LC-MS 8050型液相色谱串联质谱、HPLC色谱柱(C18, 2 mm×7.5 mm, 1.6 μm) 日本岛津公司;Infinite M200型酶标仪 奥地利Tecan公司;电泳、Mini protean Tetra Cell转膜装置、 ChemiDoc XRS+凝胶成像仪 Bio-rad公司;CCL-170B-8型细胞培养箱、AC2-6SI型超净工作台 ESCO公司;3-18K型小型离心机 Sigma公司;IC1000型细胞计数器Count Star公司;DMI-300B型倒置显微镜 莱卡公司;细胞超声破碎仪器 美国 Sonics公司;BSA224S型分析天平 赛多利斯公司。
1.2 实验方法
1.2.1 苦荞水浸泡处理及黄酮的提取 样品处理:精密称取5 g干燥的苦荞全粉, 先加入蒸馏水30 mL,摇匀,室温下使苦荞粉与水充分接触30 min后,再加入120 mL纯甲醇,使得甲醇终体积分数为80%。另外,取干燥苦荞粉5 g,直接加入体积分数为80%的甲醇溶液,作为水浸泡处理前的样品。
黄酮提取方法参考文献[7],并做一定修改。在上述条件下,采用80 ℃回流提取2 h,抽滤获得滤液,滤渣重复提取1次。合并两次滤液,50 ℃减压旋转蒸发,获得苦荞黄酮提取物。随后充分溶解并定容于100 mL甲醇,用于黄酮分析实验。
1.2.2 苦荞黄酮分析(HPLC/ESI/MS法) 苦荞黄酮的分析方法参考文献[22-23],并做一定修改。精密称取一定量芦丁、槲皮素标准品,用甲醇溶液配制成一定浓度的对照液(0~1 mg/mL),以浓度为横坐标,峰面积为纵坐标绘制黄酮的标准曲线(芦丁标准曲线方程为y=9378.1x+1417.3,R2=0.9951;槲皮素标准曲线方程为y=38465x+1401.8,R2=0.9965)。总黄酮含量为芦丁和槲皮素总量。所有标准品及样品均通过0.22 μm微孔滤膜过滤后,取滤液进样。HPLC条件:流动相A为0.1%甲酸水,流动相B为乙腈。流速 0.25 mL/min,进样量为 0.4 μL。流动相梯度:0~5 min,10% 乙腈;5~25 min,20% 乙腈;25~40 min,30%乙腈;40~50 min,50%乙腈。PDA检测波长350 nm。质谱条件如下:采用负离子全扫描;粒子源:ESI;雾化气流:2 L/min;界面温度:300 ℃;DL 温度:250 ℃;曲线脱溶剂单元:400 ℃。
1.2.3 C2C12细胞培养 C2C12细胞培养采用的完全培养基为DMEM培养基(高糖)+10%胎牛血清+1%双抗,分化培养基为DMEM培养基(高糖)+2%马血清+1%双抗,无血清培养基为DMEM培养基(低糖)+1%双抗。将细胞接种于细胞培养皿中,置于37 ℃,5% CO2细胞培养箱中培养。2~3 d更换一次完全培养基,细胞生长70%进行传代或播种。
1.2.4 C2C12细胞葡萄糖摄取实验 葡萄糖摄取实验参考文献[24],并做一定修改。将C2C12细胞播种至96孔细胞板(8000个细胞/孔),培养24 h后更换分化培养基,每隔1 d更换分化培养基,分化5 d后,80%~90%细胞呈现肌管形态后,采用无血清培养基培养12 h后进行葡萄糖摄取实验。
将芦丁、槲皮素及异槲皮素充分溶于10 μL的DMSO,随后用无血清培养基稀释至相应浓度。阳性对照采用胰岛素,将胰岛素注射液采用无血清培养基稀释至100 nmol/L。吸弃旧培养基后,加入100 μL不同浓度待测样品,阳性对照加入胰岛素,反应30 min。对照及空白则加入无血清培养基。在相同培养时间(1 h)下,选取不同加样浓度(10、25、50、100、200、400 μmol/L),探究不同浓度的样品对糖吸收的影响;在相同的样品浓度(50 μmol/L)下,选取不同培养时间梯度(0.5、1、3 h),探究不同培养时间对糖吸收的影响;将终浓度为100 μmol/L的芦丁、槲皮素及异槲皮素样品与终浓度为100 nmol/L的胰岛素共同反应30 min,探究样品与胰岛素的协同效应。葡萄糖摄取采用2-NBDG法测定。样品培养反应结束后,用37 ℃预热的KRPH缓冲液(pH7.4,118 mmol/L NaCl,5 mmol/L KCl, 1.2 mmol/L KH2PO4, 1.3 mmol/L CaCl2,1.2 mmol/L MgSO4,30 mmol/L HEPES)清洗细胞1次后,加入50 μL溶于KRPH缓冲液的2-NBDG(100 μmol/L),空白孔加入KRPH缓冲液,随后培养板避光放入细胞培养箱继续培养30 min后。用4 ℃预冷PBS清洗细胞3次,最后加入150 μL PBS。由荧光分光光度计测定(激发波长485 nm,发射波长535 nm)荧光强度。2-NBDG摄取率根据以下公式计算:

1.2.5 蛋白印迹法测定C2C12细胞蛋白表达 测定蛋白相关信号通路的表达量和磷酸化水平参考文献[24]。将C2C12细胞播种于6孔细胞板培养,采用方法1.2.4进行分化。待细胞充分分化后,无血清培养12 h,将细胞与100及400 μmol/L的芦丁、槲皮素、异槲皮素样品反应1 h。阳性对照采用1 μmol/L胰岛素作用30 min。随后,细胞用PBS清洗2次后,加预冷的RIPA裂解缓冲液,并超声3 s充分裂解细胞。以14000 ×g的转速离心30 min,收集上清液,即为总细胞裂解液。按比例加入上样缓冲液,混匀后于95 ℃加热5 min。取20 μg蛋白/道上样并电泳(浓缩胶 80 V,0.5 h;分离胶 120 V,1.5 h)。电泳结束,湿法转移至PVDF膜(100 V,1.5 h),与5%BSA封闭1 h。封闭完毕后,加入溶于5% BSA溶液的一抗(一抗稀释比例为1:2000),4 ℃轻摇过夜。PVDF膜用TBST洗3次,每次5 min。加入溶于5% BSA的二抗(二抗稀释比例为1:5000),室温孵育1 h。PVDF膜用TBST洗3次。将ECL试剂盒的AB液体混合,与二抗孵育后的PVDF膜轻摇反应30 s,将PVDF膜平铺于凝胶成像仪中曝光。
1.3 数据处理
统计分析采用SPSS 24.0统计软件进行。实验数据用均数±标准误(Mean±S.D.)表示。多组之间的比较采用单因素方差分析(One-Way ANOVA),事后比较采用Duncan分析。
2 结果与分析
2.1 苦荞黄酮组成分析及水浸泡处理对黄酮的影响
苦荞(西荞2号)黄酮的色谱分析如图2A所示。通过与标准品的保留时间进行比对及质谱信息,一共鉴定出4种黄酮,分别是槲皮素-芸香葡萄糖苷、芦丁、山奈酚-芸香糖苷及槲皮素。其中,芦丁和槲皮素的质谱图如图2B和图2C所示,它们的[M-H]-(m/z)分别为609及301。苦荞中鉴定出的黄酮种类与Jiang和Li的研究结果一致[22-23]。
如图2A及2D所示,苦荞中的芦丁含量为3.09%,占总黄酮的94.81%;槲皮素含量为0.26%,占总黄酮的0.84%,因而芦丁为苦荞黄酮的核心组成部分,与Li和Liu的报道一致[3-4]。但经水浸泡处理后,苦荞粉中的芦丁几乎全部降解为槲皮素。槲皮素含量为1.58%,而芦丁含量可忽略不计(图2D)。槲皮素分子量约为芦丁的一半,因此总黄酮含量下降近一半,本结果与先前的报道一致[24-25]。

图2 苦荞中黄酮组成的分析Fig.2 Analysis of flavonoids extracted from tartary buckwheat
2.2 不同糖苷结构的黄酮对C2C12细胞糖摄取的影响
不同浓度的黄酮对于C2C12细胞2-NBDG吸收的影响如图3所示。槲皮素在浓度≥50 μmol/L具有明显促进2-NBDG摄取的作用,而芦丁和异槲皮素在浓度≥100 μmol/L具有明显促进糖摄取的作用。浓度≥100 μmol/L下,槲皮素促进2-NBDG摄取的效果显著大于芦丁和异槲皮素(P<0.05)。在浓度100~200 μmol/L条件下,芦丁和异槲皮素的促进糖摄取作用无显著差别(P>0.05)。当浓度为400 μmol/L,异槲皮素的促进作用显著大于芦丁(P<0.05)。

图3 不同浓度的黄酮对于C2C12细胞2-NBDG吸收的影响Fig.3 Concentration-dependent effects of flavonoids on 2-NBDG uptake in C2C12 myotubes
不同反应时间对C2C12细胞的2-NBDG摄取的影响如图4所示。在低浓度50 μmol/L下,槲皮素反应0.5 h则可显著促进2-NBDG的摄取(P<0.05),且随反应时间增加可增加2-NBDG的摄取。相比之下,芦丁和异槲皮素的反应时间达3 h才可显著促进2-NBDG 的摄取(P<0.05)。

图4 不同反应时间的黄酮对C2C12细胞的2-NBDG摄取的影响Fig.4 Time-dependent effects of flavonoids on 2-NBDG uptake in C2C12 myotubes
黄酮与胰岛素协同效应的实验中(如图5所示),100 μmol/L的芦丁和异槲皮素促进2-NBDG摄取与胰岛素持平,而槲皮素显著高于胰岛素刺激后葡萄糖摄取水平(P<0.05)。这说明槲皮素促进C2C12细胞摄取葡萄糖可能存在着非胰岛素依赖型的信号通路。由上述结果可获得,苦荞黄酮对于C2C12细胞葡萄糖摄取作用大小顺序如下:槲皮素>异槲皮素>芦丁。
2.3 不同糖苷结构的黄酮对C2C12细胞信号通路的影响
如图6及图7,通过蛋白印迹法发现芦丁、异槲皮素对于胰岛素依赖性的信号通路(IRS-1及AKT磷酸化)无增效作用,而槲皮素会抑制IRS-1及AKT 的磷酸化。低浓度(100 μmol/L)及高浓度(400 μmol/L)的槲皮素可明显促进AMPK及下游ACC的磷酸化,且高于芦丁和异槲皮素。低浓度(100 μmol/L)的芦丁和异槲皮素没有促进AMPK磷酸化,但高浓度(400 μmol/L)的芦丁、异槲皮素均可促进AMPK/ACC磷酸化,且异槲皮素的作用大于芦丁。

图6 黄酮对于C2C12小鼠骨骼肌细胞的蛋白表达的影响(代表性条带)Fig.6 Effect of flavonoids on signal pathway of C2C12 myotubes
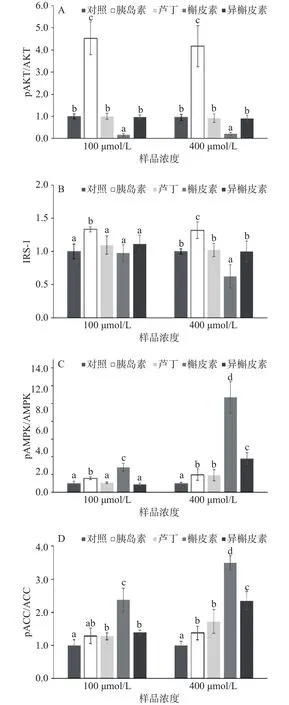
图7 小鼠骨骼肌C2C12细胞蛋白表达量Fig.7 Relative protein expression of C2C12 myotubes
3 讨论与结论
苦荞黄酮中核心组成部分为芦丁,但不同加工顺序直接影响苦荞中黄酮的组成。先与水接触会引起苦荞中黄酮从芦丁转化为槲皮素,并且总黄酮含量下降近一半。而苦荞中核心黄酮成分的变化对于其在细胞水平上的降血糖作用也有一定影响。芦丁和异槲皮素在低浓度下无明显促进葡萄糖摄取作用,随着反应时间增加至3 h,它们也开始具有促进葡萄糖摄取的作用。有研究表明,延长培养时间至24 h,低浓度(1 μmol/L)芦丁可显著促进大鼠骨骼肌细胞的葡萄糖摄取作用[26-27]。结合本研究说明,由于糖苷结构替代槲皮素中的C3-OH基团,导致了异槲皮素及芦丁空间结构增大,空间结构增大可能降低其黄酮的糖摄取活性。另外,在低浓度下,芦丁和异槲皮素在促进葡萄糖摄取上无显著性差异,并且不超过阳性对照胰岛素(P>0.05)。这说意味着空间效应比替代C3-OH的引起的葡萄糖摄取变化作用小。但而随着浓度增加至400 μmol/L,异槲皮素促进葡萄糖摄取作用显著高于芦丁(P<0.05),说明了异槲皮素和芦丁空间结构上的差异在高浓度下可能引起糖摄取作用的差异。结果表明,槲皮素促进骨骼吸收葡萄糖效果最佳。同时,已有报道称槲皮素在抑制碳水化合物消化酶效果显著[10-12]。因此,在能够接受槲皮素带来的苦荞食品的苦味的情况下,食用富含槲皮素的苦荞食品更有利于对血糖的有益调控。值得注意的是,近年来为了迎合消费者口感的需求,市场上的出现了阻止芦丁转化为槲皮素的苦荞加工技术,生产的苦荞食品中芦丁含量高且口感不苦,深受消费者喜爱,那么这些富含芦丁的苦荞食品,虽然没有槲皮素效果好,但也仍然具有一定的调控血糖的作用。
糖苷结构的增加会引起信号通路的变化及信号通路强度的变化。芦丁和异槲皮素(100及400 μmol/L)不能激活胰岛素依赖型信号通路中的IRS-1及AKT磷酸化表达。有研究发现,芦丁不能促进大鼠骨骼肌细胞的InsR及AKT的磷酸化[24]。芦丁可能是通过胰岛素依赖型信号通路的另外一条PKC信号通路促进葡萄糖摄取作用[28]。因此,芦丁和异槲皮素在低浓度下(100 μmol/L)对于糖摄取的促进作用可能是通过胰岛素依赖型的其他信号通路,而非AKT通路。在高浓度下(400 μmol/L),芦丁和异槲皮素通过非胰岛素依赖型信号通路中的AMPK/ACC磷酸化促进骨骼肌的葡萄糖摄取,并且异槲皮素促进AMPK/ACC磷酸化的效果显著大于芦丁。研究结果与先前报道一致,低浓度(100 μmol/L)的芦丁不能促进AMPK的磷酸化[24]。异槲皮素能够促进AMPK的磷酸化,与文献相符[29]。结合本研究结果说明,糖苷结构空间结构的增加可能会下调AMPK/ACC磷酸化表达,从而导致细胞对于葡萄糖摄取率的下降。槲皮素虽然抑制了胰岛素依赖型信号通路IRS-1及AKT磷酸化的表达,但是,在此条件下,槲皮素依旧能通过AMPK/ACC磷酸化显著促进骨骼肌的葡萄糖摄取,并显著高于芦丁、异槲皮素及胰岛素的促进作用(P<0.05)。也有研究表明槲皮素不通过胰岛素依赖型的信号通路,而是通过AMPK信号通路并引起线粒体中的能量代谢变化[30]。
综上所述,芦丁、异槲皮素及槲皮素均促进C2C12小鼠骨骼肌细胞对葡萄糖的摄取作用,但是糖苷键的增加会降低槲皮素糖摄取的效果,作用顺序如下:槲皮素>异槲皮素>芦丁。糖苷键的增加下调非胰岛素依赖型信号通路的表达,从而降低糖摄取。带有糖苷键结构的芦丁和异槲皮素对于胰岛素依赖型信号通路中的AKT通路无明显促进作用,无糖苷结构的槲皮素反而抑制胰岛素依赖型信号通路。本研究揭示了不同糖苷结构的黄酮在细胞水平上促进葡萄糖摄取的构效关系的区别,对于充分理解苦荞黄酮降血糖机理提供了科学依据,有助于根据消费者实际情况选择合适的苦荞加工技术。
